
Gammagard S/d

Consulta con un médico sobre la receta médica de Gammagard S/d

Cómo usar Gammagard S/d
GAMMAGARD S/D 50 mg/ml 5 g; 10 g
polvo y disolvente para preparar una solución para infusión
inmunoglobulina humana normal (IVIg)
Es importante leer las instrucciones detalladas antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar este prospecto para poder volver a leerlo si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en este prospecto, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice del prospecto
- 1. Qué es Gammagard S/D y para qué se utiliza
- 2. Información importante antes de usar Gammagard S/D
- 3. Cómo usar Gammagard S/D
- 4. Posibles efectos adversos
- 5. Cómo conservar Gammagard S/D
- 6. Contenido del envase y otra información
1. Qué es Gammagard S/D y para qué se utiliza
Gammagard S/D pertenece a un grupo de medicamentos llamados inmunoglobulinas. Los medicamentos de este grupo contienen anticuerpos humanos presentes en la sangre humana. Los anticuerpos ayudan al organismo a combatir las infecciones. Los medicamentos como Gammagard S/D se utilizan en caso de deficiencia de anticuerpos en la sangre. Los pacientes con deficiencia de anticuerpos a menudo se infectan. Gammagard S/D también puede ser utilizado si el paciente necesita anticuerpos adicionales para tratar ciertas afecciones inflamatorias (enfermedades autoinmunes).
Gammagard S/D se utiliza para los siguientes indicaciones:
Tratamiento de pacientes que no tienen suficientes anticuerpos (tratamiento de sustitución).
Hay seis grupos de estos pacientes:
- 1. Pacientes con deficiencia congénita de anticuerpos (deficiencias primarias de la inmunidad - DPI), como:
- agammaglobulinemia o hipogammaglobulinemia congénita
- deficiencia variable común
- deficiencias combinadas graves
- síndrome de Wiskott-Aldrich.
- 2. Pacientes con cáncer de sangre (leucemia linfocítica crónica) que conduce a la pérdida de la capacidad de producir anticuerpos y a infecciones recurrentes, en los que el tratamiento profiláctico con antibióticos ha fallado.
- 3. Pacientes con cáncer de médula ósea (mieloma múltiple) que conduce a la pérdida de la capacidad de producir anticuerpos y a infecciones recurrentes debido a una respuesta inadecuada a la vacunación contra ciertas bacterias (neumococos).
- 4. Niños y adolescentes (de 0 a 18 años) con SIDA congénito, que a menudo se infectan.
- 5. Recién nacidos con bajo peso al nacer, que corren el riesgo de infecciones.
- 6. Pacientes con bajo nivel de anticuerpos después de un trasplante de células madre de otra persona.
Tratamiento de pacientes con ciertas afecciones inflamatorias (inmunomodulación). Hay tres grupos de estos pacientes:
- 1. Pacientes con recuento bajo de plaquetas (trombocitopenia idiopática) y alto riesgo de sangrado o cirugía programada en el futuro cercano.
- 2. Pacientes con enfermedad asociada con múltiples inflamaciones de los nervios en todo el cuerpo (síndrome de Guillain-Barré).
- 3. Pacientes con enfermedad que causa múltiples inflamaciones de varios órganos del cuerpo (enfermedad de Kawasaki).
2. Información importante antes de usar Gammagard S/D
Cuándo no usar Gammagard S/D
NO DEBE USARSE Gammagard S/D
- si el paciente es alérgico a las inmunoglobulinas o a alguno de los demás componentes de este medicamento mencionados en el punto 6.
- en caso de deficiencia de inmunoglobulina A (IgA). En la sangre del paciente pueden estar presentes anticuerpos contra la inmunoglobulina A. Sin embargo, Gammagard S/D contiene solo pequeñas cantidades de inmunoglobulina A (no más de 3 microgramos/ml en una solución al 5%).
Precauciones y advertencias
Antes de comenzar a usarlo, debe discutirlo con su médico, farmacéutico o enfermera.
Durante cuánto tiempo se requiere una observación estricta del paciente durante la infusión
- Durante la infusión de Gammagard S/D, el paciente estará bajo observación estricta para asegurarse de que no experimente una reacción adversa. El médico se asegurará de que la velocidad de administración de Gammagard S/D sea adecuada,
- si el medicamento se administra a una velocidad alta,
- si el paciente padece una enfermedad con bajo nivel de anticuerpos en la sangre (hipo- o agammaglobulinemia),
- en pacientes que no han recibido previamente este medicamento,
- si ha habido un largo intervalo (por ejemplo, varias semanas) desde la última administración del medicamento. En estos casos, durante la administración y durante al menos una hora después de la finalización de la infusión, el paciente debe estar bajo observación estricta.
- Si el paciente ha recibido previamente Gammagard S/D, debe ser observado durante la infusión y durante al menos 20 minutos después de la administración del medicamento.
Cuándo puede ser necesario reducir la velocidad o interrumpir la infusión
En casos muy raros, el organismo del paciente puede mostrar sensibilidad a los medicamentos que contienen anticuerpos. Esto puede ocurrir especialmente en caso de deficiencia de inmunoglobulina A. En estos casos raros, pueden ocurrir reacciones alérgicas, como una caída repentina de la presión arterial o un choque, incluso si el paciente ha sido tratado previamente con medicamentos que contienen anticuerpos.
- Si ocurren alguno de los siguientes efectos adversos, debe informar inmediatamente a su médico o enfermera:
- Dificultad respiratoria repentina (respiración silbante), dificultad para respirar o presión en el pecho
- Dolor de cabeza
- Fiebre
- Hinchazón de los párpados, cara, labios o vasos sanguíneos
- Erupciones cutáneas o manchas rojas picantes
- Picazón en todo el cuerpo. Dependiendo de la decisión del médico, la velocidad de administración del medicamento se reducirá o se interrumpirá la infusión.
Grupos especiales de pacientes
- El médico tendrá especial cuidado en pacientes con sobrepeso, ancianos, diabéticos o inmovilizados. El médico observará estrechamente a los pacientes:
- con hipertensión
- con volumen sanguíneo reducido (hipovolemia)
- con viscosidad sanguínea aumentada o problemas de vasos sanguíneos (enfermedades vasculares).
- En caso de estas afecciones, las inmunoglobulinas pueden aumentar el riesgo de infarto de miocardio, accidente cerebrovascular, trombosis pulmonar o trombosis venosa profunda, aunque solo en casos muy raros. Si el paciente padece diabetes, debe informar a su médico. Gammagard S/D no contiene sacarosa ni maltosa. La solución al 5% de Gammagard S/D contiene aproximadamente 20 mg/ml de glucosa, lo que puede afectar el nivel de azúcar en sangre del paciente.
- El médico también tendrá especial cuidado
- si el paciente tiene problemas renales o ha tenido problemas renales, o si el paciente está tomando medicamentos que pueden ser perjudiciales para los riñones (medicamentos nefrotóxicos), ya que existe un riesgo muy raro de insuficiencia renal aguda. Debe informar a su médico sobre cualquier trastorno renal.
El contenido de proteínas puede aumentar, lo que puede causar un aumento de la viscosidad sanguínea.
Información sobre la materia prima utilizada para producir Gammagard S/D
Gammagard S/D se produce a partir de suero humano (parte líquida de la sangre). En el caso de medicamentos producidos a partir de sangre humana o suero, se toman numerous medidas para prevenir la transmisión de infecciones. Estas medidas incluyen la selección cuidadosa de los donantes para excluir a las personas que corren el riesgo de transmitir infecciones, y las pruebas de las donaciones individuales y de los lotes de suero para detectar la presencia de virus/infecciones. Los fabricantes de este tipo de medicamentos también incorporan etapas de inactivación o eliminación de virus en el proceso de tratamiento de la sangre y el suero. A pesar de esto, no se puede excluir completamente la posibilidad de transmisión de factores infecciosos al administrar medicamentos producidos a partir de sangre humana o suero. Esto incluye virus desconocidos o recientemente descubiertos, así como otros tipos de infecciones.
Las acciones tomadas durante la producción de Gammagard S/D se consideran efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana adquirida (VIH), el virus de la hepatitis B y el virus de la hepatitis C, así como contra los virus sin envoltura como el virus de la hepatitis A y el parvovirus B19. Gammagard S/D también contiene anticuerpos específicos que pueden prevenir infecciones por el virus de la hepatitis A o el parvovirus B19.
Gammagard S/D y otros medicamentos
- Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar o las vacunas que ha recibido en las últimas seis semanas.
- La infusión de inmunoglobulinas como Gammagard S/D puede reducir la eficacia de algunas vacunas que contienen virus vivos, como la vacuna contra el sarampión, la rubéola, las paperas y la varicela. La vacunación con vacunas que contienen virus vivos atenuados debe realizarse al menos tres meses después de la última administración de Gammagard S/D. En el caso de la vacuna contra el sarampión, puede ser necesario prolongar este período a un año.
Efecto en las pruebas de sangre
Gammagard S/D contiene una amplia gama de anticuerpos diferentes, algunos de los cuales pueden afectar los resultados de las pruebas de sangre. En caso de someterse a pruebas de sangre, debe informar a la persona que toma la muestra de sangre o al médico sobre la administración de Gammagard S/D.
La administración de inmunoglobulinas humanas puede causar resultados falsos positivos en la detección de beta-D-glucanos en suero en el diagnóstico de infecciones fúngicas; este estado puede persistir durante un período prolongado después de la infusión del medicamento.
Embarazo, lactancia y fertilidad
- Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento. El médico decidirá si se puede usar Gammagard S/D durante el embarazo o la lactancia.
- No se han realizado estudios clínicos con Gammagard S/D en mujeres embarazadas o en período de lactancia. La experiencia clínica a largo plazo con el uso de medicamentos que contienen anticuerpos sugiere que no tienen un efecto perjudicial en el curso del embarazo, el feto o el recién nacido.
- En el caso de la lactancia, los anticuerpos contenidos en Gammagard S/D pueden aparecer en la leche materna. De esta manera, el niño puede estar protegido contra ciertas infecciones.
Conducción de vehículos y uso de máquinas
Los pacientes pueden experimentar síntomas (como náuseas o mareos) mientras reciben Gammagard S/D, que pueden afectar su capacidad para conducir vehículos o operar máquinas.
Si esto ocurre, debe esperar a que estos síntomas desaparezcan.
Información importante sobre algunos componentes de Gammagard S/D
El medicamento contiene aproximadamente 2,0 g de glucosa por frasco de 5 g y aproximadamente 4,0 g de glucosa por frasco de 10 g. Debe tenerse en cuenta en pacientes con diabetes.
El medicamento contiene aproximadamente 334 mg de sodio (principal componente de la sal común) en cada frasco de 5 g y aproximadamente 668 mg de sodio en cada frasco de 10 g. Esto corresponde a aproximadamente el 17% y el 34% de la ingesta diaria máxima recomendada de sodio en la dieta para adultos.
3. Cómo usar Gammagard S/D
Gammagard S/D está indicado para administración intravenosa (infusión intravenosa). El medicamento lo administra un médico o enfermera. La dosis y la frecuencia de las infusiones varían según el estado clínico del paciente y su peso corporal.
Inicialmente, Gammagard S/D se administrará a una velocidad baja. Dependiendo de cómo se tolere la infusión, el médico puede aumentar gradualmente la velocidad de la infusión.
Uso en niños
Las mismas indicaciones, dosis y frecuencia de infusiones se aplican a adultos y niños (de 0 a 18 años).
Uso de una dosis mayor que la recomendada de Gammagard S/D
La sobredosis del medicamento puede causar una concentración excesiva de la sangre (viscosidad sanguínea excesiva). Cuanto más espesa sea la sangre, más difícil será que se mueva a través de los vasos sanguíneos del paciente. Como resultado, menos oxígeno se entrega a los órganos importantes, como el cerebro, los pulmones, etc. Esto puede ocurrir especialmente en pacientes con factores de riesgo, como pacientes ancianos o pacientes con problemas cardíacos o renales. Debe asegurarse de que el paciente haya recibido la cantidad adecuada de líquidos y no esté deshidratado, y debe informar a su médico sobre cualquier problema de salud.
4. Posibles efectos adversos
Como cualquier medicamento, Gammagard S/D puede causar efectos adversos, aunque no todos los pacientes los experimentarán. Sin embargo, los posibles efectos adversos pueden limitarse reduciendo la velocidad de la infusión.
Los siguientes efectos adversos pueden ocurrir después del tratamiento con inmunoglobulinas (medicamentos como Gammagard S/D):
- Efectos adversos frecuentes o poco frecuentes (que ocurren en menos de 1 de cada 10 pacientes, pero más de 1 de cada 1,000 pacientes) son: escalofríos, dolor de cabeza, fiebre, vómitos, reacciones alérgicas, náuseas (sensación de mareo), dolor en las articulaciones, presión arterial baja y dolor de espalda moderado.
- Efectos adversos raros que ocurren en menos de 1 de cada 1,000 pacientes son:
- caídas repentinas de la presión arterial
- erupciones cutáneas transitorias
- Efectos adversos muy raros que ocurren en menos de 1 de cada 10,000 pacientes o que no pueden estimarse a partir de los datos disponibles son:
- reacciones alérgicas (choque anafiláctico), incluso en pacientes que no habían mostrado ninguna reacción a las administraciones anteriores,
- meningitis aséptica transitoria,
- anemia hemolítica reversible,
- aumento de los índices de función hepática (transaminasas hepáticas), aumento del nivel de creatinina en sangre y insuficiencia renal,
- trombosis venosa profunda.
Si se agrava alguno de los efectos adversos o si ocurren efectos adversos no mencionados en este prospecto, debe informar a su médico, farmacéutico o enfermera.
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos todos los efectos adversos no mencionados en el prospecto, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 00
Fax: +34 91 596 24 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Gammagard S/D
- Conservar en un lugar donde no pueda ser accesible para los niños.
- No usar este medicamento después de la fecha de caducidad que se indica en el envase. La fecha de caducidad es el último día del mes indicado.
- No usar este medicamento si se observan partículas sólidas o si ha cambiado de color.
- Conservar a una temperatura inferior a 25°C.
- No congelar.
- Los frascos deben conservarse en el envase exterior de cartón para protegerlos de la luz.
No debe tirar los medicamentos por el desagüe ni por los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene Gammagard S/D?
- El principio activo de Gammagard S/D es la inmunoglobulina humana normal. Gammagard S/D se reconstituye en agua para inyección para obtener una solución de proteína al 5% (50 mg/ml). Al menos el 90% de la proteína es inmunoglobulina G (IgG).
Gammagard S/D también puede ser reconstituido en agua para inyección para obtener una solución de proteína al 10% (100 mg/ml).
- Los demás componentes son: albúmina humana, glicina, cloruro de sodio y glucosa monohidratada.
Cómo se presenta Gammagard S/D y qué contiene el envase?
Gammagard S/D es un polvo liofilizado blanco o ligeramente amarillento, sin partículas extrañas visibles.
Gammagard S/D está disponible en los siguientes tamaños de envase: 5 g y 10 g.
Cada envase contiene
- un frasco con polvo de 5 g o 10 g
- 96 ml o 192 ml de agua para inyección
- un dispositivo de transferencia
- un conjunto de administración con filtro.
Título del responsable
Takeda Pharma, S.A.
Calle María de Molina, 41
28006 Madrid
Fabricante
Baxalta Belgium Manufacturing SA
Boulevard René Branquart, 80
7860 Lessines, Bélgica
Fecha de la última revisión del prospecto:
Información destinada exclusivamente a profesionales de la salud:
Precauciones especiales de conservación
Si la preparación de la solución se realiza en condiciones asépticas fuera de una cámara de flujo laminar, la administración debe comenzar lo antes posible, pero no más de 2 horas después de la preparación de la solución. Si la preparación de la solución se realiza en condiciones asépticas en una cámara de flujo laminar, el medicamento preparado puede conservarse en condiciones refrigeradas (2°C - 8°C) durante 24 horas. Si estas condiciones no se cumplen, la esterilidad del producto reconstituido puede no mantenerse. Los frascos con solución parcialmente utilizada deben eliminarse según el procedimiento vigente.
Reconstitución - seguir las reglas de asepsia:
- A. Solución al 5%:
- 1. Llevar el medicamento Gammagard S/D y el agua para inyección (disolvente) a temperatura ambiente. Esta temperatura debe mantenerse hasta que se obtenga la reconstitución completa del polvo.
- 2. Retirar la tapa del frasco con polvo y del frasco con disolvente para exponer la parte central de los tapones de goma.
- 3. Desinfectar las superficies de los tapones de goma con una solución bactericida.
- 4. Retirar la cubierta protectora de un extremo del dispositivo de transferencia.
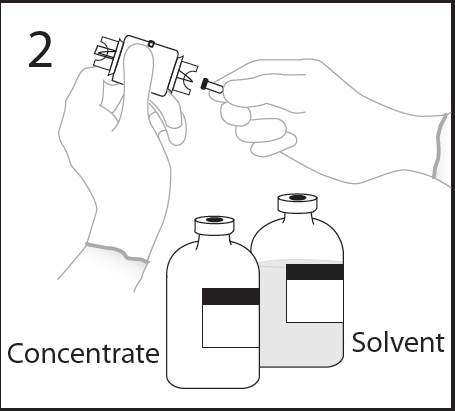
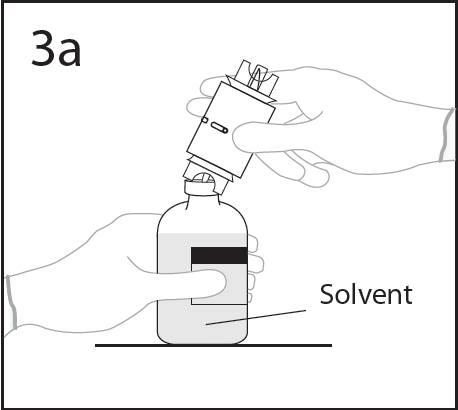
- 5. Colocar el frasco con disolvente en una superficie plana, sosteniendo el frasco para evitar que se resbale, y perforar en el centrodel tapón de goma del frasco con disolvente con la punta del dispositivo de transferencia.
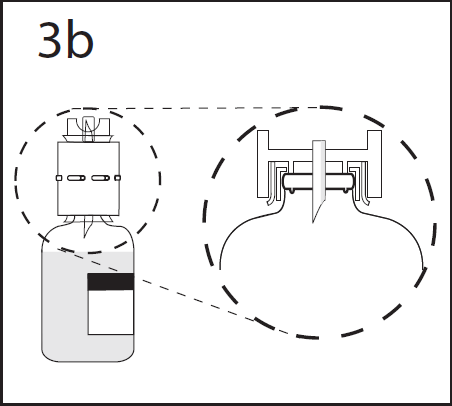
- 6. Asegurarse de que el dispositivo de transferencia esté firmemente sujeto y que el collar esté completamente insertado en el dispositivo.
ADVERTENCIA: La perforación de la aguja fuera del centro del tapón puede causar que el tapón se mueva.
- 7. Retirar la cubierta protectora del otro extremo de la punta del dispositivo de transferencia. Sostener el dispositivo de transferencia para evitar que se resbale.
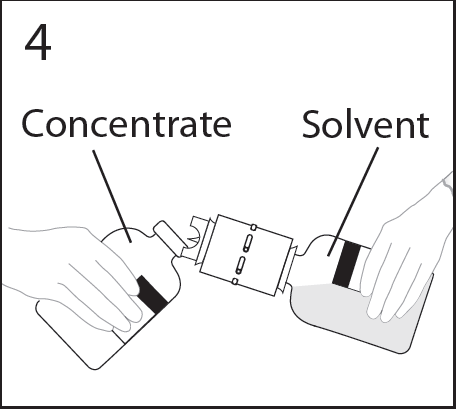
- 8. Sostener firmemente el frasco y colocarlo en un ángulo de aproximadamente 45 grados. Inclinar el frasco con disolvente y el dispositivo de transferencia hacia el frasco con polvo (en un ángulo de aproximadamente 45 grados) y perforar firmemente el dispositivo de transferencia en el centro del tapón de goma del frasco con polvo.
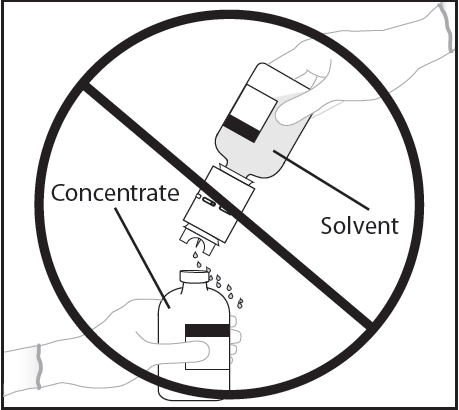
ADVERTENCIA: Invertir rápidamente el frasco con disolvente y el dispositivo de transferencia hacia el frasco con polvo para evitar el derrame del disolvente.
ADVERTENCIA: La perforación de la aguja fuera del centro del tapón puede causar que el tapón se mueva y se pierda la vacío.
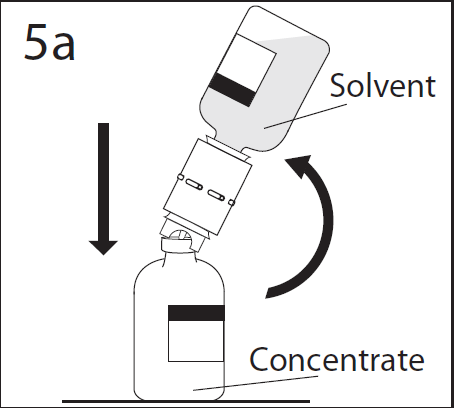
- 9. El disolvente fluirá rápidamente hacia el frasco con polvo. Después de completar la transferencia del disolvente, desconectar el frasco vacío de disolvente y el dispositivo de transferencia del frasco con polvo. El dispositivo de transferencia debe desecharse después de su uso único.
- 10. Humedecer completamente el polvo seco mediante inclinación o inversión y rotación cuidadosa del frasco. No agitar. No permitir que se forme espuma en la solución.
- 11. Repetir el mezclado suave mediante rotación del contenido del frasco hasta que desaparezca el producto no disuelto.
- B. Solución al 10% Seguir el procedimiento descrito anteriormente en los puntos 1-3 de la sección A.
- 4. Reconstitución del polvo utilizando el volumen adecuado de disolvente con una jeringa estéril para inyección subcutánea y una aguja. Para obtener una solución al 10% con 5,0 g de polvo, se necesitan 48 ml de disolvente, y con 10 g de polvo, se necesitan 96 ml de disolvente. Siguiendo las reglas de asepsia, se debe extraer el volumen necesario de disolvente en una jeringa estéril con aguja para inyección subcutánea. Desechar la jeringa llena.
- 5. Utilizando el volumen restante de disolvente en el frasco, realizar los pasos 4-11 descritos anteriormente en la sección A.
Administración - seguir las reglas de asepsia: conjunto de 5 g; 10 g
Administrar la solución según las instrucciones de uso del conjunto de administración para infusión intravenosa que se encuentra en cada envase. Si se utiliza un conjunto diferente, debe asegurarse de que contenga un filtro similar.
Instrucciones para la preparación del medicamento para su uso y eliminación de sus restos
- El polvo debe disolverse completamente en 30 minutos.
- El medicamento debe calentarse a temperatura ambiente o temperatura corporal antes de su uso.
- La solución debe ser clara o ligeramente opalescente y sin color o de color amarillento claro. La solución turbia o con sedimento no es apta para el uso. La solución reconstituida debe evaluarse visualmente antes de la administración para detectar partículas no disueltas y decoloración.
- El medicamento no utilizado o los restos de la solución deben eliminarse según el procedimiento vigente.
- El dispositivo de transferencia debe desecharse después de su uso único.
Método de administración
Para administración intravenosa.
Si es posible, se recomienda administrar soluciones de gammaglobulina al 10% en las venas del codo. Esto puede reducir la probabilidad de malestar en el sitio de administración.
Gammagard S/D en forma de solución al 5% (50 mg/ml) debe administrarse intravenosamente con una velocidad inicial de 0,5 ml/kg de peso corporal por hora. En general, se recomienda que los pacientes que comienzan el tratamiento con Gammagard S/D o que cambian de una inmunoglobulina de un fabricante a otra, comiencen con la velocidad más baja y luego aumenten gradualmente hasta la velocidad máxima, si los pacientes toleran varias infusiones administradas a una velocidad media. Si la infusión se tolera bien, la velocidad de administración puede aumentarse gradualmente hasta un máximo de 4,0 ml/kg de peso corporal por hora. En pacientes que toleran bien la administración de Gammagard S/D al 5% con una velocidad de 4 ml/kg de peso corporal por hora, se puede comenzar la administración de la solución al 10% con una velocidad inicial de 0,5 ml/kg de peso corporal por hora. Si no ocurren efectos adversos, la velocidad de la infusión puede aumentarse gradualmente hasta un máximo de 8 ml/kg de peso corporal por hora.
Precauciones especiales
- En caso de cualquier efecto adverso relacionado con la infusión, debe reducirse la velocidad de administración o interrumpirse la infusión.
- Se recomienda registrar el nombre y el número de lote de Gammagard S/D después de cada administración.
Incompatibilidades farmacéuticas
No debe mezclarse Gammagard S/D con otros medicamentos.
Se recomienda administrar Gammagard S/D por separado cuando el paciente esté tomando otros medicamentos.
Recomendaciones de dosificación
| Indicación | Dosis | Frecuencia de administración |
| Tratamiento de sustitución en síndromes de deficiencia primaria de la inmunidad Tratamiento de sustitución en síndromes de deficiencia secundaria de la inmunidad SIDA congénito Recién nacidos con bajo peso al nacer (niños hasta 7 días de vida) Hipogammaglobulinemia (<4 g l) en pacientes después de un trasplante alogénico células madre
| dosis inicial: 0,4 – 0,8 g/kg de peso corporal, luego 0,2 – 0,8 g/kg de peso corporal, 0,2 – 0,4 g/kg de peso corporal, 0,2 – 0,4 g/kg de peso corporal, 0,5 g/kg de peso corporal, 0,2 – 0,4 g/kg de peso corporal | cada 3 – 4 semanas para alcanzar un nivel de IgG de al menos 5,0 – 6,0 g/l, cada 3 – 4 semanas para alcanzar un nivel de IgG de al menos 5,0 – 6,0 g/l, cada 3 – 4 semanas, 2 infusiones con un intervalo de 1 semana, y luego 5 infusiones cada 14 días o hasta el alta del hospital, cada 3 – 4 semanas para alcanzar un nivel de IgG de al menos 5,0 g/l, una vez a la semana, comenzando 7 días antes y continuando durante 3 meses después del trasplante, una vez al mes hasta que se restaure el nivel normal de anticuerpos |
| Inmunomodulación: trombocitopenia idiopática (ITP) Síndrome de Guillain-Barré Enfermedad de Kawasaki | 0,8 – 1,0 g/kg de peso corporal, o 0,4 g/kg de peso corporal por día, 0,4 g/kg de peso corporal por día, 1,6 – 2,0 g/kg de peso corporal, o 2,0 g/kg de peso corporal | el primer día, con la posibilidad de repetir una vez en un período de 3 días, durante 2 – 5 días, durante 5 días, en varias dosis divididas durante 2 – 5 días, en combinación con ácido acetilsalicílico, como una dosis única en combinación con ácido acetilsalicílico |
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBaxalta Belgium Manufacturing S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Gammagard S/dForma farmacéutica: Solución, 100 mg/mlPrincipio activo: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: Solución, 50 mg/mlPrincipio activo: immunoglobulins, normal human, for intravascular adm.Fabricante: Kedrion S.p.A.No requiere recetaForma farmacéutica: Solución, 50 g/l (50 mg/ml)Principio activo: immunoglobulins, normal human, for intravascular adm.Fabricante: Biotest Pharma GmbHRequiere receta
Alternativas a Gammagard S/d en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Gammagard S/d en Испания
Alternativa a Gammagard S/d en Украина
Médicos online para Gammagard S/d
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Gammagard S/d – sujeta a valoración médica y normativa local.














