
CINRYZE 500 UNIDADES POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar CINRYZE 500 UNIDADES POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Cinryze 500 UI polvo y disolvente para solución inyectable
inhibidor de la esterasa C1 humano
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Cinryze y para qué se utiliza
- Qué necesita saber antes de empezar a usar Cinryze
- Cómo usar Cinryze
- Posibles efectos adversos
- Conservación de Cinryze
- Contenido del envase e información adicional
1. Qué es Cinryze y para qué se utiliza
Cinryze contiene la proteína humana llamada “inhibidor de la esterasa C1” como principio activo.
El inhibidor de la esterasa C1 es una proteína que se produce de forma natural y que normalmente está presente en la sangre. Si el nivel de inhibidor de la esterasa C1 en sangre es bajo o el inhibidor de la esterasa C1 no funciona bien, puede producirse un episodio de hinchazón (llamado angioedema). Los síntomas pueden incluir dolores de estómago e hinchazón de:
- manos y pies
- cara, párpados, labios o lengua
- laringe, que puede hacer que le resulte difícil respirar
- genitales
En adultos y niños, Cinryze puede aumentar la cantidad del inhibidor de la esterasa C1 en la sangre y bien evitar (antes de someterse a un procedimiento médico o dental) que se produzcan estos episodios de hinchazón o frenarlos una vez producidos.
En adultos, adolescentes y niños (de 6 años de edad y en adelante), Cinryze puede aumentar la cantidad de inhibidor de la esterasa C1 en la sangre y evitar de forma rutinaria que se produzcan episodios de hinchazón.
2. Qué necesita saber antes de empezar a usar Cinryze
No use Cinryze
- si es alérgico al inhibidor de la esterasa C1 humano o a alguno de los demás componentes de este medicamento (incluidos en la sección 6). Es importante que informe a su médico si cree haber tenido alguna vez una reacción alérgica a cualquiera de los componentes de Cinryze.
Advertencias y precauciones
- Antes de iniciar el tratamiento con Cinryze, es importante que informe a su médico si tiene, o ha tenido, problemas de coagulación de la sangre (sucesos trombóticos). En dicho caso, se le vigilará estrechamente.
- Si empieza a presentar erupciones cutáneas, opresión de pecho, sibilancias o latido cardiaco rápido una vez que ha utilizado Cinryze, informe a su médico inmediatamente. Ver sección 4.
- Cuando se elaboran medicamentos a partir de sangre o plasma humanos, hay que tomar ciertas medidas para prevenir la transmisión de infecciones a los pacientes. Entre estas medidas están la selección cuidadosa de donantes de plasma y sangre para estar seguros de excluir a personas con riesgo de ser portadoras de infecciones, y el análisis de cada donación y mezcla de plasma para detectar signos de virus/infecciones. Los fabricantes de estos productos también incluyen medidas en el procesamiento de la sangre o del plasma que pueden inactivar y/o eliminar los virus. A pesar de estas medidas, cuando se administran medicamentos elaborados a partir de sangre o plasma humanos, no se puede descartar por completo la posibilidad de transmitir una infección. Esto también es aplicable en el caso de virus desconocidos o emergentes, o de otros tipos de infecciones.
- Las medidas tomadas se consideran efectivas para virus encapsulados tales como el virus de la inmunodeficiencia humana (VIH), los virus de la hepatitis B y hepatitis C, y para los virus no encapsulados de la hepatitis A y el parvovirus B19.
- El médico le podrá recomendar que considere vacunarse contra la hepatitis A y B si recibe habitualmente o repetidamente productos del inhibidor de la esterasa C1 humano elaborados a partir de plasma humano.
- Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el médico o el enfermero debe registrar claramente el nombre y el número de lote del medicamento administrado.
Niños
Cinryze no debe utilizarse en niños menores de 6 años de edad para la prevención de rutina de crisis de angioedema.
Usode Cinryze conotros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. La información relativa a la seguridad del uso de Cinryze en mujeres embarazadas y en periodo de lactancia es limitada. Su médico le informará sobre los riesgos y los beneficios de utilizar este medicamento.
Conducción y uso de máquinas
La influencia de Cinryze sobre la capacidad para conducir y utilizar máquinas es pequeña.
Cinryze contiene sodio
Este medicamento contiene 11,5 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada vial. Esto equivale al 0,5 % de la ingesta diaria máxima de sodio recomendada para un adulto.
3. Cómo usar Cinryze
Su tratamiento se iniciará y controlará bajo supervisión de un médico con experiencia en el cuidado de pacientes con angioedema hereditario (AEH).
Su médico o enfermero podrán preparar y administrarle la inyección de Cinryze. Si su médico decide que usted puede autoadministrarse el medicamento, su médico o enfermero le enseñará a usted o a un miembro de su familia a preparar e inyectar Cinryze. Su médico revisará periódicamente el proceso de preparación y administración con usted o con un miembro de su familia o cuidador.
La dosis recomendada de Cinryze para adultos, adolescentes, niños, ancianos o pacientes con problemas de hígado o de riñón es la siguiente:
Uso en adultos y adolescentes (de 12 años de edad y en adelante)
Tratamiento de los episodios de hinchazón
- Deberá inyectarse una dosis de 1 000 UI (dos viales) de Cinryze con la aparición del primer signo de un episodio de hinchazón.
- Podrá administrarse una segunda inyección de 1 000 UI si los síntomas no mejoran después de 60 minutos.
- Si presenta una crisis severa, especialmente hinchazón de la glotis (laringe), o si se retrasa el inicio del tratamiento, se podrá administrar la segunda dosis de 1 000 UI antes de que transcurran 60 minutos tras la primera dosis, en función de su respuesta clínica.
- Cinryze se administrará por vía intravenosa (en la vena).
Prevención rutinaria de los episodios de hinchazón
- Deberá inyectarse una dosis de 1 000 UI (dos viales) de Cinryze cada 3 o 4 días para la prevención rutinaria de los episodios de hinchazón.
- Su médico podrá ajustar el intervalo de administración en función de su respuesta a Cinryze.
- Cinryze se administrará por vía intravenosa (en la vena).
Prevención preoperatoria de los episodios de hinchazón
- Deberá inyectarse una dosis de 1 000 UI (dos viales) de Cinryze hasta 24 horas antes de una intervención médica, dental o quirúrgica.
- Cinryze se administrará por vía intravenosa (en la vena).
Uso en niños
Tratamiento de las crisis de angioedema | Prevención preoperatoria de las crisis de angioedema | Prevención rutinaria de las crisis de angioedema |
2 a 11 años, > 25kg: Se debe inyectar una dosis de 1 000 UI (dos viales) de Cinryze al primer signo de un episodio de hinchazón. Se puede administrar una segunda inyección de 1 000 UI si los síntomas no han mejorado transcurridos 60 minutos. 2 a 11 años, 10 - 25kg: Se debe inyectar una dosis de 500 UI (un vial) de Cinryze al primer signo de un episodio de hinchazón. Se puede administrar una segunda inyección de 500 UI si los síntomas no han mejorado transcurridos 60 minutos. | 2 a 11 años, > 25kg: Se debe inyectar una dosis de 1 000 UI (dos viales) de Cinryze hasta 24 horas antes de un procedimiento médico, dental o quirúrgico. 2 a 11 años, 10 - 25kg: Se debe inyectar una dosis de 500 UI (un vial) de Cinryze hasta 24 horas antes de un procedimiento médico, dental o quirúrgico. | 6 a 11 años: Se debe inyectar una dosis de 500 UI (un vial) de Cinryze cada 3 o 4 días para la prevención rutinaria de episodios de hinchazón. Su médico puede ajustar el intervalo de administración en función de su respuesta a Cinryze. |
Reconstitución y forma de administración
Normalmente será su médico o enfermera quien le administre la inyección de Cinryze en una vena (vía intravenosa). Usted o su cuidador también podrán encargarse de la administración de Cinryze en una inyección, pero únicamente después de haber recibido la formación oportuna. Si se administra Cinryze usted mismo, siga siempre las instrucciones de su médico con exactitud. En caso de duda, pregunte a su médico. Si su médico decide que usted puede recibir el tratamiento domiciliario, le dará instrucciones detalladas. Se le pedirá que complete un diario para documentar cada tratamiento administrado en casa y que lo lleve a cada una de las consultas con su médico. Usted/su cuidador se someterán a revisiones periódicas de la técnica de inyección para cerciorarse de que manipulan el medicamento adecuadamente.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Esto puede incluir las reacciones de tipo alérgico.
Informe a su médico inmediatamentesi presenta cualquiera de los siguientes síntomas después de usar este medicamento. Aunque es raro, los síntomas pueden ser severos.
Sibilancias repentinas, dificultad respiratoria, hinchazón de los párpados, cara o labios, erupción cutánea o picor (especialmente cuando afectan al cuerpo entero).
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas): dolor de cabeza, náuseas.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas): hipersensibilidad, mareos, vómitos, erupción cutánea, picor o enrojecimiento, erupción o dolor en el sitio de inyección, fiebre.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas): niveles altos de azúcar en la sangre, coágulos de sangre, dolor en las venas, sofocos, tos, dolor de estómago, diarrea, descamación de la piel, hinchazón y dolor en las articulaciones, dolor muscular y molestias torácicas.
Se espera que los efectos adversos en los niños y adolescentes sean similares a los de los adultos.
Comunicaciónde efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Cinryze
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en los viales después de “CAD”.
Conservar por debajo de 25 ºC. No congelar. Conservar en el embalaje original para protegerlo de la luz.
Una vez reconstituido, la solución de Cinryze debe utilizarse inmediatamente.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deCinryze
El principio activo es el inhibidor de la esterasa C1 humano elaborado a partir de plasma de donantes humanos. Cada vial de polvo contiene 500 UI de inhibidor de la esterasa C1 humano. Después de la reconstitución, un vial contiene 500 UI de inhibidor de la esterasa C1 humano por 5 ml, que equivale a una concentración de 100 UI/ml. Dos viales de Cinryze reconstituido contienen 1 000 UI de inhibidor de la esterasa C1 humano por 10 ml, que equivale a una concentración de 100 UI/ml.
El contenido total de proteína de la solución reconstituida es de 15 ± 5 mg/ml.
Una unidad internacional (UI) es equivalente a la cantidad de inhibidor de la esterasa C1 presente en 1 ml de plasma humano normal.
Los demás componentes son cloruro de sodio, sacarosa, citrato de sodio, valina L, alanina L y treonina L (ver sección 2).
Disolvente: agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Polvo y disolvente para solución inyectable.
Cinryze es un polvo blanco que viene en un vial.
Después de su disolución en agua para preparaciones inyectables, la solución es transparente e incolora a ligeramente azul.
Cada envase contiene:
2 viales de Cinryze 500 UI polvo para solución inyectable
2 viales de agua para preparaciones inyectables (5 ml cada uno)
2 trasvasadores con filtro
2 jeringas desechables de 10 ml
2 equipos de venopunción
2 protectores
Utilice únicamente una jeringa sin silicona (facilitada en el envase) para la administración del medicamento.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena
Austria
Fabricación
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena
Austria
Shire International Licensing B.V.
Mercuriusplein 11
2132 HA Hoofddorp
Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Takeda Belgium NV Tél/Tel: +32 2 464 06 11 | Lietuva Takeda, UAB Tel: +370 521 09 070 |
| Luxembourg/Luxemburg Takeda Belgium NV Tél/Tel: +32 2 464 06 11 |
Ceská republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel: +420 234 722 722 | Magyarország Takeda Pharma Kft. Tel.: +36 1 270 7030 |
Danmark Takeda Pharma A/S Tlf.: +45 46 77 10 10 | Malta Τakeda HELLAS S.A. Tel: +30 210 6387800 |
Deutschland Takeda GmbH Tel: +49 (0)800 825 3325 | Nederland Takeda Nederland B.V. Tel: +31 20 203 5492 |
Eesti Takeda Pharma OÜ Tel: +372 6177 669 | Norge Takeda AS Tlf: +47 800 800 30 |
Ελλáδα Τakeda ΕΛΛΑΣ Α.Ε. Tηλ: +30 210 6387800 | Österreich Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
España Takeda Farmacéutica España S.A. Tel: +34 917 90 42 22 | Polska Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
France Takeda France SAS Tél: + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Hrvatska Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | România Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Ireland Takeda Products Ireland Ltd Tel: 1800 937 970 | Slovenija Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 |
Ísland Vistor ehf. Sími: +354 535 7000 | Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel: +421 (2) 20 602 600 |
Italia Takeda Italia S.p.A. Tel: +39 06 502601 | Suomi/Finland Takeda Oy Puh/Tel: 0800 774 051 |
Κúπρος Τakeda ΕΛΛΑΣ Α.Ε. Τηλ: +30 210 6387800 | Sverige Takeda Pharma AB Tel: 020 795 079 |
Latvija Takeda Latvia SIA Tel: +371 67840082 |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
____________________________________________________________________________
Esta información está destinada únicamente a profesionales sanitarios:
Reconstitución y administración de Cinryze
La reconstitución, administración del producto y manipulación del equipo de administración y de las agujas deberán realizarse con cautela.
Utilice el trasvasador con filtro que viene con Cinryze o una aguja de doble punta comercialmente disponible.
Utilice únicamente una jeringa sin silicona (facilitada en el envase) para la administración del medicamento.
Preparación y manipulación
Cinryze está indicado para la administración intravenosa (en la vena) después de la reconstitución con agua para preparaciones inyectables.
El vial de Cinryze es únicamente para un solo uso.
Reconstitución
Para una dosis de 500 UI: se necesita 1 vial de polvo, 1 vial de disolvente, 1 trasvasador con filtro, 1 jeringa desechable de 10 ml, 1 equipo de venopunción y 1 protector. Guarde el vial restante y el equipo para la administración para la próxima dosis.
Para una dosis de 1 000 UI: se necesitan 2 viales de polvo, 2 viales de disolvente, 2 trasvasadores con filtro, 1 jeringa desechable de 10 ml, 1 equipo de venopunción y 1 protector.
Se debe reconstituir cada vial de producto con 5 ml de agua para preparaciones inyectables.
Un vial de Cinryze reconstituido corresponde a una dosis de 500 UI. Por lo tanto, reconstituya solo un vial de Cinryze para una dosis de 500 UI.
Dos viales de Cinryze reconstituido corresponden a una dosis de 1 000 UI. Por lo tanto, para una dosis de 1 000 UI se combinan dos viales.
- Trabaje sobre el protector facilitado y lávese las manos antes de realizar los siguientes procedimientos.
- Utilice una técnica aséptica durante el procedimiento de reconstitución.
- Asegúrese de que el vial del polvo y el vial del disolvente estén a temperatura ambiente (15 ºC – 25 ºC).
- Retire la etiqueta del vial del polvo despegando la tira morada que indica la flecha.
- Retire los precintos de los viales de polvo y de disolvente.
- Limpie los tapones con una toallita desinfectante y déjelos secar antes de usar.
- Retire el precinto de la parte superior del envase del trasvasador. No retire el dispositivo del envase.
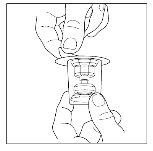
- Nota: el trasvasador debe acoplarse al vial del disolvente antes de ser acoplado al vial del polvo, de modo que no se pierda el vacío en el vial de polvo. Coloque el vial del disolvente sobre una superficie plana e introduzca el extremo azul del trasvasador en el vial del disolvente, empujándolo hacia adentro hasta que el punto penetre por el centro del tapón del vial del disolvente y el dispositivo encaje en su sitio. El trasvasador debe estar en vertical antes de penetrar el tapón.
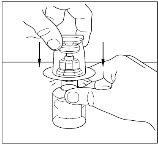
- Retire el precinto del trasvasador y deséchelo. Tenga cuidado de no tocar el extremo expuesto del trasvasador.
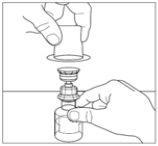
- Coloque el vial del polvo sobre una superficie plana. Invierta el trasvasador y el vial del disolvente que contiene el agua para preparaciones inyectables, e introduzca el extremo transparente del trasvasador en el vial de polvo, empujándolo hacia adentro hasta que el punto penetre el tapón de goma y el trasvasador encaje en su sitio. El trasvasador debe estar en vertical antes de penetrar el tapón del vial del polvo. El vacío del vial del polvo extraerá el disolvente. Si el vial no tiene vacío, no utilice el producto.
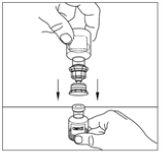
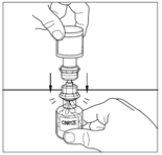
- Mueva cuidadosamente el vial del polvo hasta que esté bien disuelto. No agite el vial del polvo. Asegúrese de que se haya disuelto bien todo el polvo.
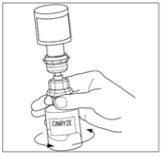
- Desconecte el vial del disolvente girándolo hacia la izquierda. No saque el extremo transparente del trasvasador del vial de polvo.
Un vial de Cinryze reconstituido contiene 500 UI del inhibidor de la esterasa C1 humano en 5 ml, lo que produce una concentración de 100 UI/ml. Pase al proceso de administración si los pacientes reciben una dosis de 500 UI.
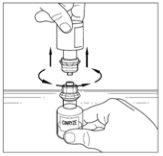
Se deben reconstituir dos viales de polvo de Cinryze para hacer una dosis (1 000 UI/10 ml). Por lo tanto, habrá que repetir los pasos 1 a 12 anteriores, utilizando un nuevo envase con un trasvasador para reconstituir el segundo vial de polvo. No vuelva a utilizar el mismo trasvasador. Una vez que los dos viales han sido reconstituidos, pase al proceso de administración para una dosis de 1 000 UI.
Proceso de administración para una dosis de 500 UI
- Debe utilizar una técnica aséptica durante el procedimiento de administración.
- Después de la reconstitución, las soluciones de Cinryze son incoloras a ligeramente azules y transparentes. No utilice el producto si las soluciones están turbias o teñidas.
- Con una jeringa estéril y desechable de 10 ml, tire del émbolo para que entre aproximadamente 5 ml de aire en la jeringa.
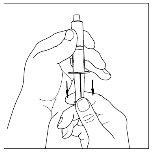
- Acople la jeringa a la parte superior del extremo transparente del trasvasador girándolo hacia la derecha.
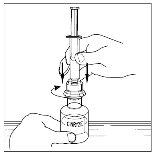
- Invierta con cuidado el vial e inyecte aire en la solución y a continuación extraiga lentamente la solución reconstituida de Cinryze a la jeringa.
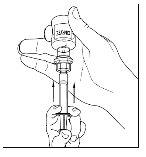
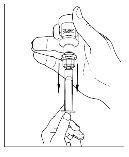
- Desconecte la jeringa del vial girándolo hacia la izquierda y soltándolo del extremo transparente del trasvasador.
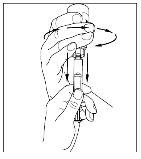
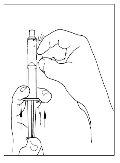
- Antes de la administración, inspeccione la solución reconstituida de Cinryze por si presentara partículas. No utilice el medicamento si observa partículas.
- Acople el equipo de venopunción a la jeringa que contiene la solución de Cinryze y administre la inyección por vía intravenosa (en la vena) al paciente. Administre 500 UI (reconstituidas en 5 ml de agua para preparaciones inyectables) de Cinryze por inyección intravenosa a una velocidad de 1 ml por minuto durante 5 minutos.
Proceso de administración para una dosis de 1 000 UI
- Debe utilizar una técnica aséptica durante el procedimiento de administración.
- Después de la reconstitución, las soluciones de Cinryze son incoloras a ligeramente azules y transparentes. No utilice el producto si las soluciones están turbias o teñidas.
- Con una jeringa estéril y desechable de 10 ml, tire del émbolo para que entre aproximadamente 5 ml de aire en la jeringa.
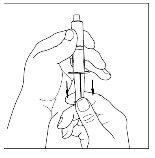
- Acople la jeringa a la parte superior del extremo transparente del trasvasador girándolo hacia la derecha.
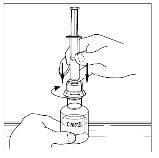
- Invierta con cuidado el vial e inyecte aire en la solución y a continuación extraiga lentamente la solución reconstituida de Cinryze a la jeringa.
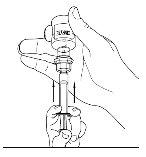
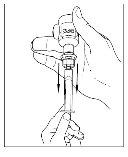
- Desconecte la jeringa del vial girándolo hacia la izquierda y soltándolo del extremo transparente del trasvasador.
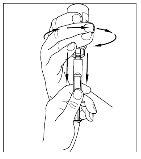
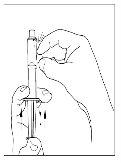
- Utilizando la misma jeringa, repita los pasos 3 a 6 con el segundo vial de Cinryze reconstituido para hacer una dosis completa de 10 ml.
- Antes de la administración, inspeccione la solución reconstituida de Cinryze por si presentara partículas. No utilice el medicamento si observa partículas.
- Acople el equipo de venopunción a la jeringa que contiene la solución de Cinryze y administre la inyección por vía intravenosa (en la vena) al paciente. Administre 1 000 UI (reconstituidas en 10 ml de agua para preparaciones inyectables) de Cinryze por inyección intravenosa (en la vena) a una velocidad de 1 ml por minuto durante 10 minutos.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a CINRYZE 500 UNIDADES POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 1500 UIPrincipio activo: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequiere recetaForma farmacéutica: INYECTABLE, 2000 IUPrincipio activo: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequiere recetaForma farmacéutica: INYECTABLE, 3000 IUPrincipio activo: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequiere receta
Médicos online para CINRYZE 500 UNIDADES POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de CINRYZE 500 UNIDADES POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes
















