Cómo usar Sandostatin Lar
Hoja de instrucciones del paquete: información para el paciente
SANDOSTATIN LAR 10 mg polvo y disolvente para suspensión inyectable
SANDOSTATIN LAR 20 mg polvo y disolvente para suspensión inyectable
SANDOSTATIN LAR 30 mg polvo y disolvente para suspensión inyectable
octreótido
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Sandostatin LAR y para qué se utiliza
- 2. Información importante antes de usar Sandostatin LAR
- 3. Cómo usar Sandostatin LAR
- 4. Posibles efectos adversos
- 5. Cómo conservar Sandostatin LAR
- 6. Contenido del paquete y otra información
1. Qué es Sandostatin LAR y para qué se utiliza
Sandostatin LAR es un derivado sintético de la somatostatina, una sustancia que se encuentra de forma natural en el cuerpo humano y que inhibe la acción de ciertas hormonas, como la hormona del crecimiento. Sandostatin LAR actúa más fuerte que la somatostatina y su efecto dura más tiempo.
Sandostatin LAR se utiliza
- para tratar la acromegalia. La acromegalia es una enfermedad en la que el cuerpo produce demasiada hormona del crecimiento. En personas sanas, la hormona del crecimiento controla el crecimiento de los tejidos, órganos y huesos. Una cantidad excesiva de hormona del crecimiento puede causar un aumento en el tamaño de los huesos y tejidos, especialmente en las manos y pies. Sandostatin LAR alivia significativamente los síntomas de la acromegalia, que incluyen dolor de cabeza, sudoración excesiva, entumecimiento de las manos y pies, fatiga y dolor articular. En la mayoría de los casos, la producción excesiva de hormona del crecimiento se debe a un tumor en la glándula pituitaria (adenoma pituitario); el tratamiento con Sandostatin LAR puede reducir el tamaño del tumor.
Sandostatin LAR se utiliza para tratar a personas con acromegalia:
- en quienes otros tipos de tratamiento para la acromegalia (cirugía o radioterapia) no son adecuados o no son efectivos;
- después de la radioterapia, durante el período de transición, antes de que se produzca el efecto completo de la radioterapia.
- para aliviar los síntomas asociados con la producción excesiva de ciertas hormonas y otras sustancias por el estómago, intestinos y páncreas. La producción excesiva de hormonas y otras sustancias naturales puede ser causada por ciertas enfermedades raras del estómago, intestinos o páncreas. Esto altera el equilibrio hormonal natural del cuerpo y puede causar una variedad de síntomas, como enrojecimiento de la cara, diarrea, presión arterial baja, erupciones cutáneas y pérdida de peso. El tratamiento con Sandostatin LAR ayuda a controlar estos síntomas.
- para tratar tumores neuroendocrinos localizados en el intestino (por ejemplo, en el apéndice, intestino delgado o colon)
Los tumores neuroendocrinos son tumores raros que se encuentran en diferentes partes del cuerpo. Sandostatin LAR también se utiliza para inhibir el crecimiento de este tipo de tumores localizados en el intestino (por ejemplo, en el apéndice, intestino delgado o colon).
- para tratar tumores de la glándula pituitaria que producen demasiada hormona tirotrópica (TSH). Una cantidad excesiva de hormona tirotrópica (TSH) puede causar hipertiroidismo. Sandostatin LAR se utiliza para tratar a personas con tumores de la glándula pituitaria que producen demasiada hormona tirotrópica (TSH):
- cuando otros tipos de tratamiento (cirugía o radioterapia) no son adecuados o no son efectivos;
- después de la radioterapia, durante el período de transición, antes de que se produzca el efecto completo de la radioterapia.
2. Información importante antes de usar Sandostatin LAR
Debe seguir todas las instrucciones de su médico. Estas pueden ser diferentes a la información contenida en esta hoja de instrucciones.
Cuándo no usar Sandostatin LAR:
- si el paciente es alérgico al octreótido o a cualquier otro componente de este medicamento (enumerados en el punto 6).
Precauciones y advertencias
Antes de comenzar a usar Sandostatin LAR, debe discutir con su médico:
- si el paciente tiene o ha tenido piedras en la vesícula biliar o si experimenta síntomas como fiebre, escalofríos, dolor abdominal o ictericia; debe informar a su médico, ya que el uso prolongado de Sandostatin LAR puede causar la formación de piedras en la vesícula biliar. El médico puede ordenar controles periódicos de la vesícula biliar.
- si el paciente tiene diabetes, ya que Sandostatin LAR puede afectar los niveles de azúcar en la sangre. Si el paciente tiene diabetes, debe controlar regularmente sus niveles de azúcar en la sangre.
- si el paciente ha tenido niveles bajos de vitamina B12 en el pasado, el médico puede ordenar controles periódicos de los niveles de vitamina B12.
Exámenes y controles
Si el paciente está recibiendo tratamiento a largo plazo con Sandostatin LAR, el médico puede ordenar controles periódicos de la función tiroidea.
Niños
La experiencia con el uso de Sandostatin LAR en niños es limitada.
Sandostatin LAR y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o que planea tomar.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea quedarse embarazada, debe consultar a su médico antes de usar este medicamento.
Conducción de vehículos y uso de máquinas
Sandostatin LAR no afecta o tiene un efecto insignificante en la capacidad para conducir vehículos o usar máquinas. Sin embargo, algunos efectos adversos que pueden ocurrir durante el tratamiento con Sandostatin LAR, como dolor de cabeza y fatiga, pueden reducir la capacidad del paciente para conducir vehículos o usar máquinas de manera segura.
Sandostatin LAR contiene sodio
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por vial, lo que significa que se considera "libre de sodio".
3. Cómo usar Sandostatin LAR
Sandostatin LAR debe administrarse exclusivamente por inyección intramuscular en el glúteo.
Uso de una dosis mayor que la recomendada de Sandostatin LAR
En caso de sobredosis de Sandostatin LAR, no se han reportado reacciones que ponen en peligro la vida.
Omisión de una dosis de Sandostatin LAR
Si se omite una inyección, debe administrarse lo antes posible y luego continuar con el tratamiento como antes.
Interrupción del tratamiento con Sandostatin LAR
Después de interrumpir el tratamiento con Sandostatin LAR, los síntomas de la enfermedad pueden regresar. Por lo tanto, no debe interrumpir el tratamiento con Sandostatin LAR sin consultar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, Sandostatin LAR puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Algunos efectos adversos pueden ser graves. Debe informar a su médico de inmediato si experimenta alguno de los siguientes síntomas:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Cálculos biliares que causan dolor de espalda agudo.
- Niveles altos de azúcar en la sangre.
Frecuentes(pueden afectar a hasta 1 de cada 10 personas):
- Hipotiroidismo (niveles bajos de hormona tiroidea) que puede afectar el ritmo cardíaco, el apetito o el peso; fatiga, sensación de frío o hinchazón en la parte delantera del cuello.
- Cambios en los resultados de las pruebas de función tiroidea.
- Colelitiasis (piedras en la vesícula biliar); los síntomas pueden incluir dolor en la parte superior derecha del abdomen, fiebre, náuseas, ictericia (amarillamiento de la piel y los ojos).
- Niveles bajos de azúcar en la sangre.
- Intolerancia a la glucosa.
- Bradycardia (frecuencia cardíaca lenta).
No muy frecuentes(pueden afectar a hasta 1 de cada 100 personas):
- Sed, orina escasa, orina oscura, piel seca y enrojecida.
- Taquicardia (frecuencia cardíaca rápida).
Otros efectos adversos graves
- Reacciones de hipersensibilidad (alergia), incluyendo erupciones cutáneas.
- Reacciones alérgicas (anafilaxia), que pueden causar dificultad para tragar o respirar, hinchazón y picazón, con posible caída de la presión arterial y mareo o pérdida de conciencia.
- Pancreatitis; los síntomas pueden incluir dolor agudo en la parte superior del abdomen, náuseas, vómitos, diarrea.
- Hepatitis; los síntomas pueden incluir ictericia (amarillamiento de la piel y los ojos), náuseas, vómitos, pérdida de apetito, malestar general, picazón, orina oscura.
- Arritmia cardíaca.
- Recuento bajo de plaquetas; puede causar sangrado o moretones excesivos.
Si el paciente experimenta alguno de los síntomas mencionados anteriormente, debe informar a su médico de inmediato.
Otros efectos adversos:
Si el paciente experimenta alguno de los siguientes efectos adversos, debe informar a su médico, farmacéutico o enfermera. Estos efectos suelen ser leves y tienden a desaparecer a medida que avanza el tratamiento.
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Diarrea.
- Dolor abdominal.
- Náuseas.
- Estreñimiento.
- Flatulencia.
- Dolor de cabeza.
- Dolor en el lugar de la inyección.
Frecuentes(pueden afectar a hasta 1 de cada 10 personas):
- Disconfort en el estómago después de comer (dispepsia).
- Vómitos.
- Sensación de llenura en el estómago.
- Heces grasas.
- Heces sueltas.
- Decoloración de las heces.
- Mareo.
- Pérdida de apetito.
- Cambios en los resultados de las pruebas de función hepática.
- Pérdida de cabello.
- Dificultad para respirar.
- Debilidad.
Si se producen efectos adversos, debe informar a su médico, enfermera o farmacéutico.
Notificación de efectos adversos
Si se producen efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad y Consumo:
Calle de Alcalá, 56
28071 Madrid
Teléfono: 91 596 34 00
Fax: 91 596 34 01
Página web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
5. Cómo conservar Sandostatin LAR
Debe conservar este medicamento en un lugar fresco y seco, fuera del alcance de los niños.
Debe conservar el medicamento en su embalaje original para protegerlo de la luz.
Debe conservar el medicamento en la nevera (entre 2°C y 8°C). No congelar.
En el día de la inyección, Sandostatin LAR puede conservarse a temperatura ambiente (por debajo de 25°C).
No debe conservar el medicamento después de su preparación (la suspensión preparada debe usarse de inmediato).
No debe usar este medicamento después de la fecha de caducidad que se indica en el envase después de "EXP" y "Fecha de caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
No debe usar este medicamento si observa partículas extrañas o un cambio de color.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Sandostatin LAR?
- El principio activo de Sandostatin LAR es el octreótido. Cada vial contiene 10 mg, 20 mg o 30 mg de octreótido (en forma de octreótido acetato).
- Los demás componentes son: en el polvo (vial): poli(DL-lactida-co-glicolida), manitol (E 421); en el disolvente (jeringa precargada): carmelosa sódica, manitol (E 421), poloxámero 188, agua para inyección.
El agua para inyección es el disolvente.
Cómo se presenta Sandostatin LAR y qué contiene el paquete?
El paquete individual contiene una vial de vidrio de 6 ml cerrada con un tapón de goma de bromobutilo y un capuchón de aluminio con un cierre de ruptura, que contiene el polvo para suspensión inyectable, y una jeringa precargada de vidrio de 3 ml, protegida por dos tapones de goma de clorobutilo (en la parte delantera y en el émbolo), que contiene 2 ml de disolvente para suspensión, empaquetados juntos en un blister sellado con un conector de vial y una aguja segura para inyección.
Título del responsable
Novartis Farmacéutica, S.A.
Calle de Alcalá, 55
28014 Madrid
Teléfono: 91 324 90 00
Fabricante/Importador
Novartis Farmacéutica, S.A.
Calle de Alcalá, 55
28014 Madrid
Novartis Pharma GmbH
Jakov-Lind-Straße 5, Top 3.05
1020 Viena
Austria
Novartis Pharma NV
Medialaan 40 Bus 1
Vilvoorde, B-1800
Bélgica
Novartis Healthcare A/S
Edvard Thomsens Vej 14
Copenhague S, 2300
Dinamarca
Novartis Finland Oy
Metsäneidonkuja 10
Espoo, FI-02130
Finlandia
Novartis Pharma SAS
8-10 rue Henri Sainte-Claire Deville
92500 Rueil Malmaison
Francia
Novartis Pharma GmbH
Roonstrasse 25
90429 Núremberg
Alemania
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Núremberg
Alemania
Novartis (HELLAS) SA
12 km Carretera Nacional Atenas-Lamia
Metamorfosi Attiki, 14451
Grecia
Novartis Hungáry Kft.
Vasút u. 13.
Budaörs, 2040
Hungría
Novartis Farma S.p.A.
Via Provinciale Schito 131
80058 Torre Annunziata (NA)
Italia
Novartis Farma S.p.A.
Viale Luigi Sturzo 43
20154 – Milán (MI) Italia
Novartis Farma - Produtos Farmacêuticos S.A.
Avenida Professor Doutor Cavaco Silva, n.10E, Taguspark
Porto Salvo, 2740-255
Portugal
Novartis Farmacéutica S.A.
Gran Vía de les Corts Catalanes, 764
08013 Barcelona
España
Novartis Sverige AB
Torshamnsgatan 48
164 40 Kista
Suecia
Novartis Pharma B.V.
Haaksbergweg 16
1101 BX Amsterdam
Países Bajos
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Sandostatin LAR
Austria, Bulgaria, Croacia, Chipre, República Checa, Dinamarca, Estonia, Finlandia, Alemania, Grecia, Hungría, Islandia, Irlanda, Letonia, Lituania, Malta, Noruega, Polonia, Rumania, Eslovaquia, Eslovenia, España, Suecia
Sandostatine LAR
Bélgica, Luxemburgo, Países Bajos
Sandostatina LAR
Italia, Portugal
Sandostatine L.P.
Francia
Fecha de la última revisión de la hoja de instrucciones: 10/2024
Información destinada exclusivamente al personal médico especializado:
Cuánta cantidad de Sandostatin LAR debe administrarse?
Acromegalia
Se recomienda iniciar el tratamiento con una dosis de 20 mg de Sandostatin LAR cada 4 semanas durante 3 meses. Los pacientes que estén recibiendo Sandostatin por vía subcutánea pueden iniciar el tratamiento con Sandostatin LAR al día siguiente de la última inyección subcutánea de Sandostatin.
Luego, la dosis debe ajustarse según los niveles de hormona del crecimiento (GH) y factor de crecimiento similar a la insulina 1/somatomedina C (IGF-1) en suero, así como según los síntomas clínicos.
En pacientes que después de 3 meses de tratamiento no tienen síntomas clínicos y parámetros bioquímicos (GH; IGF-1) completamente controlados (niveles de GH aún mayores de 2,5 μg/l), la dosis de Sandostatin LAR puede aumentarse a 30 mg cada 4 semanas.
Si después de otros 3 meses de tratamiento, los parámetros de GH, IGF-1 y/o otros síntomas aún no están adecuadamente controlados con una dosis de 30 mg, la dosis de Sandostatin LAR puede aumentarse a 40 mg cada 4 semanas.
En pacientes que tienen niveles de GH constantemente por debajo de 1 μg/l, y cuyos niveles de IGF-1 en suero se han normalizado, y cuyos síntomas objetivos y subjetivos de acromegalia han remitido después de 3 meses de tratamiento con una dosis de 20 mg, se puede administrar Sandostatin LAR en una dosis de 10 mg cada 4 semanas.
Sin embargo, especialmente en este grupo de pacientes, se recomienda un seguimiento estricto de la eficacia del tratamiento mediante la determinación de los niveles de GH y IGF-1 en suero, así como la evaluación de los síntomas clínicos objetivos y subjetivos durante el tratamiento con esta dosis baja de Sandostatin LAR.
En pacientes que reciben una dosis establecida de Sandostatin LAR, se deben determinar los niveles de GH y IGF-1 cada 6 meses.
Instrucciones para la preparación y administración intramuscular de Sandostatin LAR
EXCLUSIVAMENTE PARA INYECCIÓN INTRAMUSCULAR PROFUNDA
Kit:
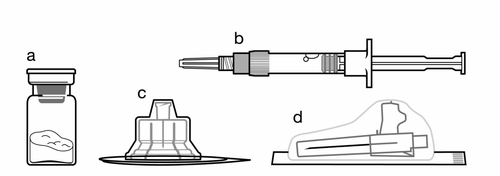
a
Una vial que contiene Sandostatin LAR en polvo
b
Una jeringa precargada que contiene disolvente para suspensión
c
Un conector de vial para reconstituir el producto
d
Una aguja segura para inyección
Debe seguir las instrucciones a continuación para reconstituir correctamente Sandostatin LAR antes de la inyección.
Hay 3 puntos críticos en este proceso. No seguir estos puntos puede resultar en una administración incorrecta del medicamento.
Paso 1
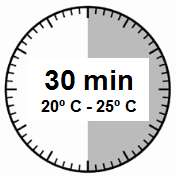
- Saque el kit de inyección de Sandostatin LAR de la nevera donde se ha estado almacenando.
ADVERTENCIA: Es muy importante comenzar el proceso de reconstitución solo cuando el kit de inyección haya alcanzado la temperatura ambiente. Debe dejar el kit a temperatura ambiente durante al menos
30 minutosantes de la reconstitución, pero no más de 24 horas.
Nota: El kit de inyección se puede volver a colocar en la nevera si es necesario.
Paso 2
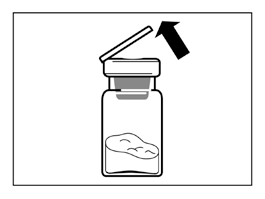
- Retire el tapón de plástico de la vial y limpie el tapón de goma de la vial con un algodón empapado en alcohol.
- Retire la cubierta protectora que cubre el empaque del conector de vial, pero no retire el conector de vial del empaque.
- Sostenga el conector de vial por el empaque y colóquelo en la vial, y presione hasta que encaje con un "clic" audible.
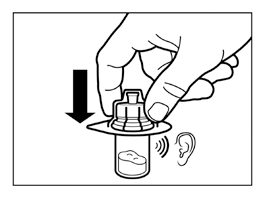
- Retire el empaque del conector de vial levantándolo verticalmente hacia arriba.
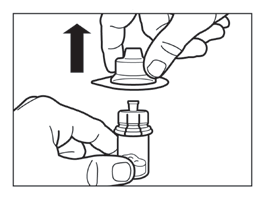
Paso 3
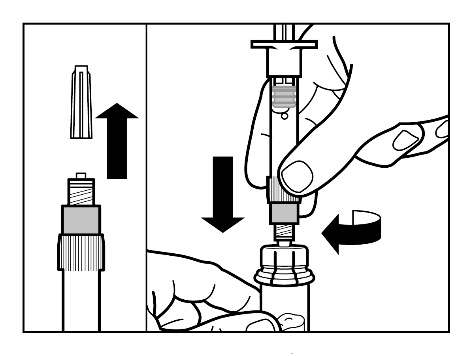
- Retire el capuchón de la jeringa precargada con disolvente y enrosque la jeringa en el conector de vial.
- Baje lentamente el émbolo hasta el final para que todo el disolvente entre en la vial.
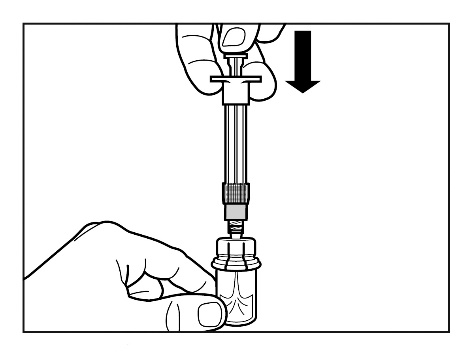
Paso 4
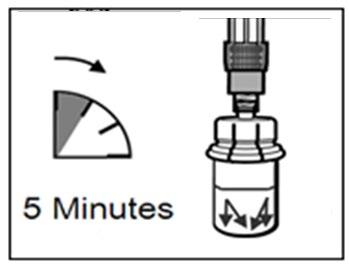
ADVERTENCIA: Es muy importante dejar la vial durante
5 minutospara asegurarse de que el polvo se ha disuelto completamente en el disolvente.
Nota: Si el émbolo se mueve hacia arriba, es normal, debido a una ligera presión en la vial.
5 minutos
- En este momento, debe preparar al paciente para la inyección.
Paso 5
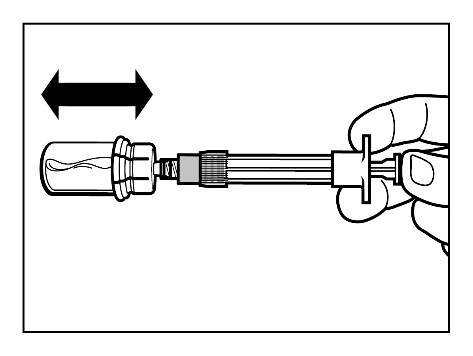
- Después de que el polvo se ha disuelto completamente, verifique que el émbolo esté completamente bajado en la jeringa. ADVERTENCIA:Sostenga el émbolo completamente bajado y agite suavementela vial en posición horizontal durante al menos 30 segundospara asegurarse de que todo el polvo se ha disuelto en una suspensión uniforme (una suspensión blanquecina uniforme). Si parte del polvo no se ha disuelto, repita el agitado suave durante otros 30 segundos.
Paso 6
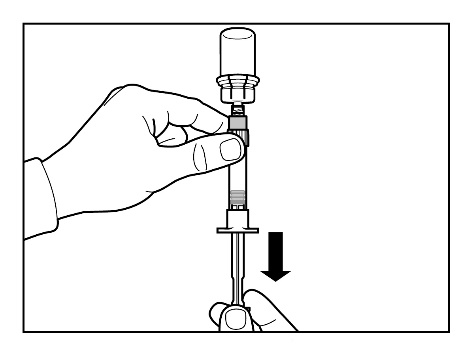
- Prepare el lugar de la inyección limpiándolo con un algodón empapado en alcohol.
- Invierta la jeringa con la vial hacia abajo y, lentamente, baje el émbolo para recoger todo el contenido de la vial en la jeringa.
- Desenrosque la jeringa del conector de vial.
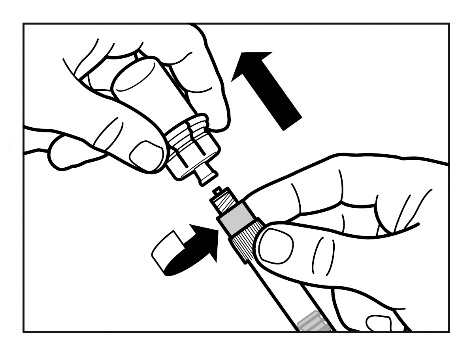
Paso 7
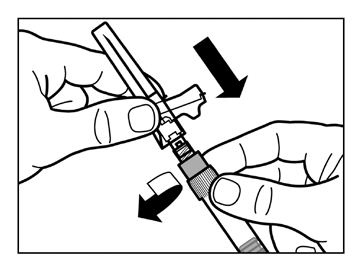
- Enrosque la aguja segura para inyección en la jeringa.
- Agite suavemente la jeringa para asegurarse de que la suspensión sea uniforme justo antes de la inyección.
- Retire la cubierta protectora de la aguja con un movimiento hacia arriba.
- Toque suavemente la jeringa con los dedos para hacer que cualquier burbuja de aire visible se mueva hacia arriba y, a continuación, retire el aire de la jeringa. Debeverificar que el lugar de la inyección no esté contaminado.
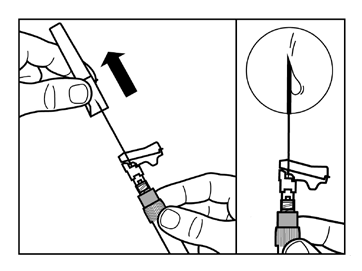
- La suspensión de Sandostatin LAR ahora está lista para la inyección inmediata- proceda al paso 8. Cualquier retraso puede causar la formación de un sedimento.
Paso 8
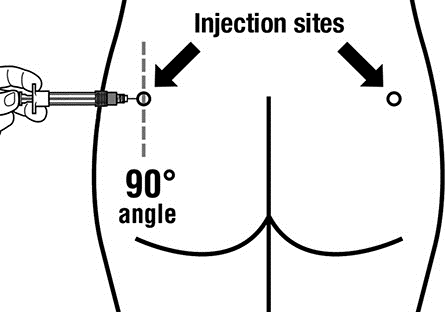
- Sandostatin LAR debe administrarse exclusivamente por inyección intramuscular profunda, NUNCApor vía intravenosa.
- Introduzca toda la aguja en el glúteo izquierdo o derecho en un ángulo de 90° con respecto a la superficie de la piel.
- Baje lentamente el émbolo de la jeringa para asegurarse de que la aguja no esté en un vaso sanguíneo (cambie la posición de la aguja si está en un vaso sanguíneo).
- Presione el émbolo con una fuerza constante hasta que la jeringa esté vacía. Retire la aguja del lugar de la inyección y active la cubierta protectora de la aguja (siguiendo las instrucciones del paso 9).
Paso 9
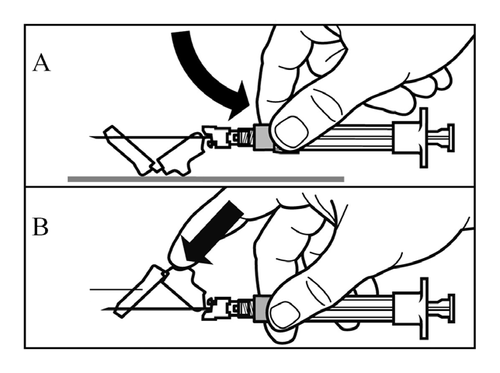
- Active la cubierta protectora de la aguja utilizando uno de los siguientes métodos:
- presione la parte plegable de la cubierta contra una superficie dura (dibujo A)
- o presione la parte plegable de la cubierta con el dedo (dibujo B).
- La activación correcta se confirmará con un "clic" audible.
- Deseche la jeringa de inmediato (en un contenedor adecuado para objetos punzocortantes).
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorNovartis Farma - Produtos Farmacêuticos, S.A. Novartis Farma S.p.A. Novartis Farma S.p.A. Novartis Farmacéutica, S.A. Novartis Finland Oy Novartis Healthcare A/S Novartis (Hellas) SA Novartis Hungary Kft. Novartis Pharma B.V. Novartis Pharma GmbH Novartis Pharma GmbH Novartis Pharma GmbH Novartis Pharma nv/sa Novartis Pharma SAS Novartis Poland Sp. z o.o. Novartis Sverige AB
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Sandostatin LarForma farmacéutica: Polvo, 10 mgPrincipio activo: OctreotidaForma farmacéutica: Polvo, 20 mgPrincipio activo: OctreotidaForma farmacéutica: Polvo, 30 mgPrincipio activo: Octreotida
Alternativas a Sandostatin Lar en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Sandostatin Lar en España
Alternativa a Sandostatin Lar en Ucrania
Médicos online para Sandostatin Lar
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Sandostatin Lar – sujeta a valoración médica y normativa local.