
Cómo usar Okteva
Hoja de instrucciones del paquete: información para el paciente
Okteva, 10 mg, polvo y disolvente para preparar una suspensión inyectable de liberación prolongada
de liberación prolongada
Okteva, 20 mg, polvo y disolvente para preparar una suspensión inyectable de liberación prolongada
Okteva, 30 mg, polvo y disolvente para preparar una suspensión inyectable de liberación prolongada
octreotida
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Okteva y para qué se utiliza
- 2. Información importante antes de usar Okteva
- 3. Cómo usar Okteva
- 4. Posibles efectos adversos
- 5. Cómo conservar Okteva
- 6. Contenido del paquete y otra información
1. Qué es Okteva y para qué se utiliza
Okteva es un medicamento que contiene la sustancia activa octreotida, una somatostatina sintética que inhibe la acción de ciertas hormonas, como la hormona del crecimiento. Okteva actúa más fuerte y durante más tiempo que la somatostatina.
Okteva se utiliza
- para tratar la acromegalia, una enfermedad en la que el cuerpo produce demasiada hormona del crecimiento. En personas sanas, la hormona del crecimiento influye en el crecimiento de los tejidos, órganos y huesos. Una cantidad excesiva de hormona del crecimiento puede causar un aumento en el tamaño de los huesos y tejidos, especialmente en las manos y pies. Okteva alivia significativamente los síntomas de la acromegalia, como el dolor de cabeza, la sudoración excesiva, la entumecimiento de las manos y pies, la fatiga y el dolor articular. En la mayoría de los casos, la producción excesiva de hormona del crecimiento se debe a un tumor en la glándula pituitaria (adenoma pituitario); el tratamiento con Okteva puede reducir el tamaño del tumor.
Okteva se utiliza en el tratamiento de la acromegalia:
- en pacientes para los que otros tratamientos para la acromegalia (cirugía o radioterapia) no son adecuados o no han sido efectivos;
- después de la radioterapia, durante el período de transición, antes de que la radioterapia tenga un efecto completo;
- para aliviar los síntomas asociados con la producción excesiva de ciertas hormonas y sustancias similares por el estómago, intestinos y páncreas; la producción excesiva de hormonas y sustancias similares puede ser causada por ciertas enfermedades raras del estómago, intestinos o páncreas. Esto puede alterar el equilibrio hormonal natural del cuerpo y causar una variedad de síntomas, como enrojecimiento de la cara, diarrea, presión arterial baja, erupciones cutáneas y pérdida de peso. El uso de Okteva ayuda a aliviar estos síntomas:
- en el tratamiento de tumores neuroendocrinos localizados en el intestino (por ejemplo, en el apéndice, intestino delgado o colon); los tumores neuroendocrinos son tumores raros que se encuentran en diferentes partes del cuerpo. Okteva también se utiliza para inhibir el crecimiento de este tipo de tumores, si se encuentran en el intestino (por ejemplo, en el apéndice, intestino delgado o colon);
- en el tratamiento de tumores pituitarios que producen demasiada hormona tireotrópica (TSH); una cantidad excesiva de hormona tireotrópica (TSH) puede causar hipertiroidismo. Okteva se utiliza en pacientes con tumores pituitarios que producen demasiada hormona tireotrópica (TSH):
- cuando otros tratamientos (cirugía o radioterapia) no son adecuados o no han sido efectivos;
- después de la radioterapia, durante el período de transición, antes de que la radioterapia tenga un efecto completo.
2. Información importante antes de usar Okteva
Debe seguir las instrucciones de su médico. Pueden ser diferentes a la información contenida en esta hoja de instrucciones.
Debe leer la siguiente información antes de usar Okteva.
Cuándo no usar Okteva:
- si el paciente es alérgico a la octreotida o a cualquier otro componente de este medicamento (enumerados en el punto 6).
Precauciones y advertencias
Antes de comenzar a usar Okteva, debe discutir con su médico:
- si el paciente sabe que tiene o ha tenido en el pasado cálculos biliares; o si se producen complicaciones, como fiebre, escalofríos, dolor abdominal o ictericia; debe informar a su médico, ya que el uso prolongado de Okteva puede causar la formación de cálculos biliares. El médico puede ordenar un control periódico de la vesícula biliar;
- si el paciente tiene diabetes, ya que Okteva puede afectar los niveles de azúcar en la sangre. Si el paciente tiene diabetes, los niveles de azúcar en la sangre deben ser controlados regularmente;
- si el paciente ha tenido en el pasado una disminución de los niveles de vitamina B12, el médico puede ordenar un control periódico de los niveles de vitamina B12.
Exámenes y controles
Si el paciente está recibiendo tratamiento a largo plazo con Okteva, el médico puede ordenar un control periódico de la función tiroidea.
El médico controlará la función hepática del paciente.
El médico puede ordenar un control de la función de los enzimas pancreáticos.
Niños
La experiencia con el uso de Okteva en niños es limitada.
Okteva y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o que planea tomar.
En general, se puede continuar tomando otros medicamentos durante el tratamiento con Okteva.
Sin embargo, se ha informado que Okteva puede afectar la acción de ciertos medicamentos, como la cimetidina, la ciclosporina, la bromocriptina, la quinidina y la terfenadina.
Si el paciente está tomando un medicamento para reducir la presión arterial (por ejemplo, un bloqueador beta o un antagonista del calcio) o un medicamento para mantener el equilibrio de líquidos y electrolitos, el médico puede ajustar la dosis.
En pacientes con diabetes, puede ser necesario ajustar la dosis de insulina por parte del médico.
Si el paciente va a recibir tratamiento con oksodotreotida lutetu (Lu), una terapia radiofarmacéutica, el médico puede suspender o ajustar el tratamiento con Okteva durante un período corto de tiempo.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea quedarse embarazada, debe consultar a su médico antes de usar este medicamento.
Okteva solo debe usarse durante el embarazo si es absolutamente necesario.
Las mujeres en edad reproductiva deben usar métodos anticonceptivos efectivos durante el tratamiento con Okteva.
No se debe amamantar durante el tratamiento con Okteva. No se sabe si Okteva se excreta en la leche materna.
Conducción de vehículos y uso de máquinas
Okteva no tiene efecto o tiene un efecto mínimo en la capacidad para conducir vehículos o usar máquinas. Sin embargo, ciertos efectos adversos que pueden ocurrir durante el tratamiento con Okteva, como el dolor de cabeza y la fatiga, pueden reducir la capacidad del paciente para conducir vehículos o usar máquinas de manera segura.
Okteva contiene sodio
Okteva contiene menos de 1 mmol (23 mg) de sodio por dosis, lo que significa que es esencialmente "libre de sodio".
3. Cómo usar Okteva
Okteva debe administrarse exclusivamente por inyección intramuscular en el glúteo.
Durante el tratamiento a largo plazo, se deben administrar inyecciones alternando entre el glúteo izquierdo y el derecho.
Uso de una dosis mayor que la recomendada de Okteva
No se han informado reacciones graves después de una sobredosis de Okteva.
Los síntomas de sobredosis incluyen: sofocos, frecuencia urinaria, fatiga, depresión, ansiedad y falta de concentración.
Si se sospecha una sobredosis y el paciente experimenta alguno de estos síntomas, debe informar a su médico de inmediato.
Olvido de una dosis de Okteva
Si se olvida una inyección, debe administrarse lo antes posible y luego continuar con el tratamiento como antes. La administración de una dosis varios días después no es perjudicial, pero puede causar un retorno temporal de los síntomas de la enfermedad hasta que se reanude el esquema de tratamiento planeado.
Suspensión del tratamiento con Okteva
Después de suspender el tratamiento con Okteva, los síntomas de la enfermedad pueden regresar. Por lo tanto, no debe suspender el tratamiento con Okteva sin consultar a su médico.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico, enfermera o farmacéutico.
4. Posibles efectos adversos
Como todos los medicamentos, Okteva puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Algunos efectos adversos pueden ser graves. Debe informar a su médico de inmediato si experimenta alguno de los siguientes síntomas:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Cálculos biliares que causan dolor de espalda repentino
- Niveles elevados de azúcar en la sangre
Frecuentes(pueden afectar a hasta 1 de cada 10 personas):
- Hipotiroidismo (disminución de la función tiroidea) que puede afectar el ritmo cardíaco, el apetito o el peso; fatiga, sensación de frío o hinchazón en la parte delantera del cuello
- Cambios en los resultados de las pruebas de función tiroidea
- Colecistitis (inflamación de la vesícula biliar); los síntomas pueden incluir dolor en la parte superior derecha del abdomen, fiebre, náuseas, ictericia (amarillamiento de la piel y los ojos)
- Niveles bajos de azúcar en la sangre
- Alteración de la tolerancia a la glucosa
- Bradycardia (frecuencia cardíaca lenta)
No muy frecuentes(pueden afectar a hasta 1 de cada 100 personas):
- Sed, orina escasa, orina oscura, piel seca y enrojecida
- Taquicardia (frecuencia cardíaca rápida)
Otros efectos adversos graves
- Reacciones de hipersensibilidad (alergia), incluyendo erupciones cutáneas
- Reacción alérgica (anafilaxia), que puede causar dificultad para tragar o respirar, hinchazón y picazón, con posible caída de la presión arterial y mareo o pérdida de conciencia.
- Pancreatitis (inflamación del páncreas); los síntomas pueden incluir dolor repentino en la parte superior del abdomen, náuseas, vómitos, diarrea
- Hepatitis (inflamación del hígado); los síntomas pueden incluir ictericia (amarillamiento de la piel y los ojos), náuseas, vómitos, pérdida de apetito, malestar general, picazón, orina clara
- Arritmia cardíaca (frecuencia cardíaca irregular)
- Recuento bajo de plaquetas; puede causar sangrado o moretones excesivos.
Si el paciente experimenta alguno de los síntomas mencionados anteriormente, debe informar a su médico de inmediato.
Otros efectos adversos:
Si el paciente experimenta alguno de los siguientes efectos adversos, debe informar a su médico, farmacéutico o enfermera. Estos efectos suelen ser leves y tienden a desaparecer a medida que avanza el tratamiento.
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Diarrea
- Dolor abdominal
- Náuseas
- Estreñimiento
- Flatulencia
- Dolor de cabeza
- Dolor en el lugar de la inyección.
Frecuentes(pueden afectar a hasta 1 de cada 10 personas):
- Disconfort en el estómago después de comer (dispepsia)
- Vómitos
- Sensación de llenura en el estómago
- Heces grasas
- Heces sueltas
- Decoloración de las heces
- Mareo
- Pérdida de apetito
- Cambios en los resultados de las pruebas de función hepática
- Pérdida de cabello
- Dificultad para respirar
- Debilidad
Si se producen efectos adversos, debe informar a su médico, enfermera o farmacéutico.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: 22 49-21-301
Fax: 22 49-21-309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Okteva
El medicamento debe conservarse en un lugar donde no pueda ser visto o alcanzado por los niños.
Conservar en el embalaje original para protegerlo de la luz.
Conservar en la nevera (2°C – 8°C). No congelar.
El día de la inyección, Okteva puede conservarse a una temperatura inferior a 25°C.
No conservar Okteva después de reconstituirlo. La suspensión preparada debe usarse de inmediato.
No usar este medicamento después de la fecha de caducidad indicada en el etiquetado y embalaje después de "EXP" y "Fecha de caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
No usar este medicamento si se observan partículas extrañas o un cambio de color.
No tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Okteva?
- La sustancia activa de Okteva es la octreotida. Cada vial contiene 10 mg, 20 mg o 30 mg de octreotida (en forma de octreotida acetato).
- Los demás componentes son: en el polvo (vial): copolímero de ácido láctico y glicólico (55:45) y manitol (E 421). en el disolvente (jeringa precargada): carmelosa sódica, manitol (E 421), poloxámero 188 y agua para inyección.
Cómo se presenta Okteva y qué contiene el paquete?
Okteva 10 mg
Cada paquete individual contiene: 1 vial de vidrio que contiene 10 mg de octreotida cerrado con un tapón de goma y un sellado de aluminio con una tapa de tipo flip-off de color azul oscuro, 1 jeringa precargada de vidrio que contiene 2 ml de disolvente, 1 aguja segura para inyección y 1 conector de vial o,
3 viales de vidrio que contienen 10 mg de octreotida, 3 jeringas precargadas que contienen 2 ml de disolvente, 3 agujas seguras para inyección y 3 conectores de vial.
Okteva 20 mg
Cada paquete individual contiene: 1 vial de vidrio que contiene 20 mg de octreotida cerrado con un tapón de goma y un sellado de aluminio con una tapa de tipo flip-off de color naranja, 1 jeringa precargada de vidrio que contiene 2 ml de disolvente, 1 aguja segura para inyección y 1 conector de vial o,
3 viales de vidrio que contienen 20 mg de octreotida, 3 jeringas precargadas que contienen 2 ml de disolvente, 3 agujas seguras para inyección y 3 conectores de vial.
Okteva 30 mg
Cada paquete individual contiene: 1 vial de vidrio que contiene 30 mg de octreotida cerrado con un tapón de goma y un sellado de aluminio con una tapa de tipo flip-off de color rojo oscuro, 1 jeringa precargada de vidrio que contiene 2 ml de disolvente, 1 aguja segura para inyección y 1 conector de vial o,
3 viales de vidrio que contienen 30 mg de octreotida, 3 jeringas precargadas que contienen 2 ml de disolvente, 3 agujas seguras para inyección y 3 conectores de vial.
No todas las tallas de paquete deben estar en circulación.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Teva B.V.
Swensweg 5
2031 GA Haarlem
Países Bajos
Fabricante
PLIVA HRVATSKA d.o.o. (PLIVA CROATIA Ltd.)
Prilaz baruna Filipovića 25
Zagreb 10000
Croacia
Merckle GmbH,
Ludwig-Merckle-Str. 3
Blaubeuren
89143
Alemania
Pharmathen International S.A
Parque Industrial Sapes
Prefectura de Rodopi, bloque 5
Rodopi 69300
Grecia
Para obtener más información sobre el medicamento y sus nombres en otros países miembros del Espacio Económico Europeo, debe dirigirse al representante del titular de la autorización de comercialización:
Teva Pharmaceuticals Polska Sp. z o.o., ul. Emilii Plater 53, 00-113 Varsovia, tel. (22) 345 93 00.
Fecha de la última actualización de la hoja de instrucciones:febrero 2024.
Información destinada exclusivamente al personal médico especializado:
Cuánta cantidad de Okteva debe usarse?
Acromegalia
Se recomienda comenzar el tratamiento con Okteva en una dosis de 20 mg cada 4 semanas durante 3 meses. Los pacientes que reciben octreotida por vía subcutánea pueden comenzar el tratamiento con Okteva al día siguiente de la última administración subcutánea de octreotida. Luego, la dosis debe ajustarse según los niveles de hormona del crecimiento (GH) y factor de crecimiento similar a la insulina 1/somatomedina C (IGF-1) y los síntomas clínicos.
En pacientes que después de 3 meses de tratamiento no tienen los síntomas clínicos y los parámetros bioquímicos (GH; IGF-1) completamente controlados (los niveles de GH siguen siendo mayores que 2,5 microgramos/l), la dosis de Okteva puede aumentarse a 30 mg cada 4 semanas. Si después de otros 3 meses los parámetros GH, IGF-1 y (o) otros síntomas siguen sin estar adecuadamente controlados con una dosis de 30 mg, la dosis puede aumentarse a 40 mg cada 4 semanas.
En pacientes que después de 3 meses de tratamiento tienen los síntomas clínicos y los parámetros bioquímicos (GH; IGF-1) completamente controlados, y cuyos síntomas de acromegalia han disminuido, se puede usar Okteva en una dosis de 10 mg cada 4 semanas. Sin embargo, especialmente en este grupo de pacientes, es importante un seguimiento estricto de la eficacia del tratamiento mediante la determinación de los niveles de GH y IGF-1 en suero y la evaluación de los síntomas clínicos objetivos y subjetivos durante el tratamiento con esta dosis baja de Okteva.
En pacientes que reciben una dosis establecida de Okteva, se deben determinar los niveles de GH y IGF-1 cada 6 meses.
Tumores hormonales activos del estómago, intestinos y páncreas
- Tratamiento de pacientes con síntomas asociados con tumores neuroendocrinos hormonales activos del estómago, intestinos y páncreas
Se recomienda comenzar el tratamiento con Okteva en una dosis de 20 mg cada 4 semanas.
Los pacientes que reciben octreotida por vía subcutánea deben continuar con este tratamiento en la dosis previamente efectiva durante 2 semanas después de la primera inyección de Okteva.
En pacientes que después de 3 meses de tratamiento tienen un alivio satisfactorio de los síntomas y una mejora de los parámetros biológicos, se puede reducir la dosis de Okteva a 10 mg cada 4 semanas.
En pacientes que después de 3 meses de tratamiento solo tienen un alivio parcial de los síntomas, se puede aumentar la dosis de Okteva a 30 mg cada 4 semanas.
En los días en que, a pesar del tratamiento con Okteva, los síntomas asociados con los tumores del estómago, intestinos y páncreas son severos, se recomienda administrar octreotida por vía subcutánea en la dosis utilizada antes de la introducción de Okteva. Esto puede ocurrir especialmente durante los primeros 2 meses de tratamiento, antes de que se alcance la concentración terapéutica de octreotida.
- Tratamiento de pacientes con tumores neuroendocrinos avanzados que se originan en la parte media del intestino delgado o con un origen primario desconocido, siempre que se haya excluido un origen primario que no se encuentre en la parte media del intestino delgado
La dosis recomendada de Okteva es de 30 mg, administrada cada 4 semanas. El tratamiento con Okteva para inhibir el crecimiento del tumor debe continuar en ausencia de progresión del tumor.
- Tratamiento de adenomas que secretan TSH
Se debe comenzar el tratamiento con Okteva en una dosis de 20 mg cada 4 semanas, y continuar durante 3 meses antes de ajustar la dosis. Luego, la dosis se puede ajustar según la secreción de TSH y la hormona tiroidea.
Instrucciones para la preparación y administración de Okteva por inyección intramuscular
SÓLO PARA INYECCIÓN INTRAMUSCULAR PROFUNDA EN EL GLÚTEO
Kit:

aUn vial que contiene Okteva en polvo
bUna jeringa precargada que contiene disolvente para preparar la suspensión
cUn conector de vial para reconstituir el medicamento
dUna aguja segura para inyección
Debe seguir las instrucciones a continuación para reconstituir correctamente Okteva antes de la inyección intramuscular profunda en el glúteo.
Para una reconstitución adecuada de Okteva, son fundamentales 3 requisitos.
No cumplir con estos requisitos puede ser la causa de una administración incorrecta del medicamento.
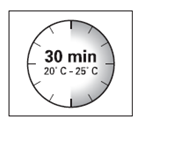
- El kit de inyección debe alcanzar la temperatura ambiente.Debe sacar el kit de inyección de la nevera y dejarlo durante al menos 30 minutos a temperatura ambiente, pero no más de 24 horas.
- Después de agregar el disolvente, debe dejar el vial durante 5 minutos para asegurarse de que el polvo esté completamente disuelto.
- Después de la disolución, debe agitar el vial con fuerza moderadaen un plano horizontal durante al menos 30 segundos para formar una suspensión homogénea.La suspensión de Okteva debe prepararse inmediatamenteantes de la administración.
Okteva solo debe administrarse por personal médico capacitado.
Paso 1
- Sacar el kit de inyección de Okteva de la nevera donde se ha estado conservando.
ATENCIÓN: Es muy importante comenzar el proceso de reconstitución solo cuando el kit de inyección haya alcanzado la temperatura ambiente.
Debe dejar el kit en temperatura ambiente durante al menos 30 minutos antes de la reconstitución, pero no más de 24
horas.
Nota: El kit de inyección se puede volver a colocar en la nevera si es necesario.
Paso 2
- Retirar la tapa de plástico del vial y limpiar el tapón de goma del vial con un algodón empapado en alcohol.
- Retirar la cubierta de la envoltura del conector de vial, sacar el conector de vial de la envoltura, sosteniéndolo entre el conector blanco de Luer y el borde. NO TOCARlos extremos del conector en ningún punto.
- Colocar el vial en una superficie plana. Colocar el conector de vial en el vial y presionarlo hasta que encaje con un "clic" audible.
- Limpie el extremo del conector de vial con un algodón empapado en alcohol.
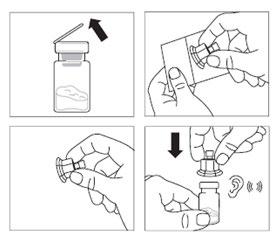
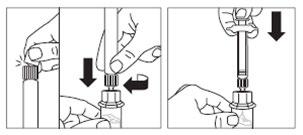
Paso 3
- Retirar la cubierta de la punta de la jeringa precargada con disolvente y enroscar la jeringa en el conector de vial.
- Empujar lentamente el émbolo hacia abajo para que todo el disolvente entre en el vial.
Paso 4
ATENCIÓN: Es muy importante dejar el vial
durante 5 minutos,para asegurarse de que el polvo esté completamente disuelto.
Nota: El émbolo puede ser empujado hacia arriba nuevamente debido a una ligera presión en el vial. En este punto, debe
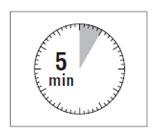
preparar al paciente para la inyección.
Paso 5
- Después del tiempo suficiente para la disolución, debe verificar que el émbolo esté completamente empujado hacia abajo en la jeringa.
ATENCIÓN:Sosteniendo el émbolo empujado hacia abajo con fuerza moderada, agite la jeringa en un plano horizontaldurante al menos30 segundos para formar una suspensión homogénea(una suspensión lechosa homogénea). Si parte del polvo no se ha disuelto,repita el agitado moderado durante otros30 segundos.
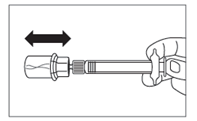
Paso 6
- Vuelva a invertir la jeringa con el vial hacia abajo y, tirando lentamente del émbolo, extraer todo el contenido del vial en la jeringa.
- Desenrosque la jeringa del conector de vial.
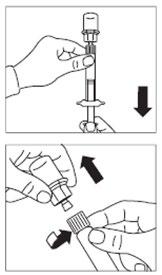
Paso 7
- Preparar el lugar de la inyección limpiándolo con un algodón empapado en alcohol.
- Enroscar la aguja segura para inyección en la jeringa.
- Si no se puede administrar la inyección de inmediato, agite suavemente la jeringa para obtener una suspensión lechosa homogénea justo antes de la administración.
- Retirar la cubierta protectora de la aguja con un movimiento hacia arriba.
- Golpee suavemente la jeringa con los dedos para hacer que las burbujas de aire visibles se muevan hacia arriba y, a continuación, elimínelas de la jeringa. Debe pasar inmediatamenteal paso 8. Cualquier retraso puede causar la formación de un sedimento.

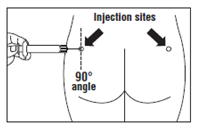
Paso 8
- Okteva debe administrarse
exclusivamente por inyección intramuscular profunda en el glúteo,NUNCA por vía intravenosa.
- Introduzca toda la aguja en el glúteo izquierdo o derecho en un ángulo de 90 ° con respecto a la superficie de la piel.
- Tire lentamente del émbolo de la jeringa para asegurarse de que la aguja no esté en un vaso sanguíneo (cambie la posición de la aguja si está en un vaso sanguíneo).
- Tire lentamente del émbolo con presión constante hasta que la jeringa esté vacía. Retire la aguja del lugar de la inyección y active la cubierta protectora de la aguja (siguiendo las instrucciones del paso 9).
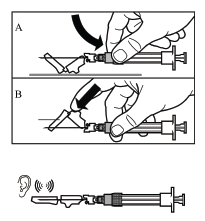
Paso 9
- Active la cubierta protectora de la aguja utilizando uno de los siguientes métodos:
- presione la parte plegable de la cubierta contra una superficie dura (dibujo A)
- o presione la parte plegable de la cubierta con el dedo (dibujo B).
- El funcionamiento correcto se confirmará con un "clic" audible.
- Nota: Debe registrar el lugar de la inyección en la tarjeta del paciente, cambiándolo cada mes.
- La jeringa debe desecharse de inmediato (en un contenedor adecuado para objetos punzocortantes).
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorMerckle GmbH Pharmathen International S.A. PLIVA Hrvatska d.o.o. (PLIVA Croatia Ltd.)
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a OktevaForma farmacéutica: Polvo, 10 mgPrincipio activo: OctreotidaForma farmacéutica: Polvo, 20 mgPrincipio activo: OctreotidaForma farmacéutica: Polvo, 30 mgPrincipio activo: OctreotidaRequiere receta
Alternativas a Okteva en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Okteva en Spain
Alternativa a Okteva en Ukraine
Médicos online para Okteva
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Okteva – sujeta a valoración médica y normativa local.






