Cómo usar Paclitaxel Kabi
Hoja de instrucciones del paquete: información para el usuario
Paclitaxel Kabi, 6 mg/ml, concentrado para solución para infusión
Paclitaxel
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
Si tiene alguna duda, debe consultar a su médico o enfermera.
Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Paclitaxel Kabi y para qué se utiliza
- 2. Información importante antes de tomar Paclitaxel Kabi
- 3. Cómo tomar Paclitaxel Kabi
- 4. Posibles efectos adversos
- 5. Cómo conservar Paclitaxel Kabi
- 6. Contenido del paquete y otra información
1. Qué es Paclitaxel Kabi y para qué se utiliza
Paclitaxel Kabi pertenece a un grupo de medicamentos contra el cáncer llamados "táxanos". Estos medicamentos inhiben el crecimiento de las células cancerosas.
Paclitaxel Kabi se utiliza para tratar los siguientes tipos de cáncer:
Cáncer de ovario:
como medicamento de primera línea (después de una operación, en combinación con un medicamento que contiene platino, cisplatino);
cuando otros tratamientos han fallado.
Cáncer de mama:
como medicamento de primera línea para tratar la enfermedad avanzada o que se ha extendido a otras partes del cuerpo (metástasis). Paclitaxel Kabi se administra en combinación con antraciclina (por ejemplo, doxorubicina) o con trastuzumab (en pacientes que no pueden recibir tratamiento con antraciclina y que tienen receptores HER-2 en la superficie de las células cancerosas, véase la hoja de instrucciones del paciente para trastuzumab);
como terapia adyuvante después del tratamiento con antraciclina y ciclofosfamida (AC);
como medicamento de segunda línea para tratar a pacientes que no han respondido al tratamiento estándar con antraciclina o en aquellos en los que el tratamiento con antraciclina no es adecuado.
Cáncer de pulmón de células no pequeñas avanzado:
en tratamiento combinado con cisplatino en pacientes que no son candidatos para la cirugía y/o radioterapia.
Sarcoma de Kaposi en pacientes con SIDA:
en pacientes que no han respondido a otros tratamientos (por ejemplo, antraciclina liposomal).
2. Información importante antes de tomar Paclitaxel Kabi
Cuándo no tomar Paclitaxel Kabi:
si el paciente es alérgico a paclitaxel o a alguno de los demás componentes de este medicamento (enumerados en el punto 6), especialmente a macrogol glicerol ricinoleato (aceite de ricino polioxietilado);
durante la lactancia;
en pacientes con recuento de glóbulos blancos reducido (recuento de granulocitos neutrofílicos <1,5 x 10^9/l o <1,0 x 10^9/l en pacientes con sarcoma de Kaposi - debe consultar a un médico). El médico realizará un análisis de sangre para verificar si el paciente tiene suficientes glóbulos blancos;
en caso de infección grave y descontrolada, solo en pacientes que reciben Paclitaxel Kabi para tratar el sarcoma de Kaposi.
Si el paciente presenta alguna de las condiciones anteriores, debe informar a su médico antes de comenzar el tratamiento con Paclitaxel Kabi.
No se recomienda el uso de Paclitaxel Kabi en niños (menores de 18 años).
Advertencias y precauciones
Antes de comenzar el tratamiento con Paclitaxel Kabi, debe discutirlo con su médico.
Para minimizar las reacciones alérgicas, antes de recibir Paclitaxel Kabi, el paciente recibirá otros medicamentos.
Si el paciente experimenta reacciones alérgicas (como dificultad para respirar, sensación de asfixia, presión en el pecho, caída de la presión arterial, mareo, sensación de vacío en la cabeza, reacciones cutáneas como erupciones o hinchazón).
Si el paciente experimenta fiebre, escalofríos intensos, dolor de garganta o úlceras en la boca (síntomas de supresión de la médula ósea).
Si el paciente experimenta entumecimiento, sensación de pinchazos o debilidad en las manos y los pies (síntomas de neuropatía periférica), puede ser necesario reducir la dosis de Paclitaxel Kabi.
Si el paciente experimenta trastornos hepáticos graves, no se recomienda el uso de Paclitaxel Kabi.
Si el paciente experimenta trastornos del ritmo cardíaco.
Si durante el tratamiento con Paclitaxel Kabi o poco después, el paciente experimenta diarrea grave o persistente, acompañada de fiebre y dolor abdominal; la causa puede ser una inflamación del intestino grueso (colitis pseudomembranosa).
Si el paciente ha recibido previamente radioterapia en el pecho (ya que esto puede aumentar el riesgo de neumonitis).
Si el paciente experimenta dolor o enrojecimiento en la boca (síntomas de estomatitis) y está siendo tratado para el sarcoma de Kaposi, puede ser necesario reducir la dosis.
Si el paciente experimenta alguno de los eventos anteriores, debe informar inmediatamente a su médico.
Paclitaxel Kabi debe administrarse solo por vía intravenosa. La administración de Paclitaxel Kabi por vía arterial puede causar inflamación de las arterias, lo que puede provocar dolor, hinchazón, enrojecimiento y ardor.
Paclitaxel Kabi y otros medicamentos
Si el paciente está tomando paclitaxel junto con alguno de los siguientes medicamentos, debe discutirlo con su médico:
medicamentos antibióticos (por ejemplo, eritromicina, rifampicina; si el paciente no está seguro de si el medicamento que está tomando es un antibiótico, debe preguntar a su médico, enfermera o farmacéutico), incluidos los medicamentos utilizados para tratar infecciones fúngicas (por ejemplo, ketconazol);
medicamentos utilizados para estabilizar el estado de ánimo, a veces llamados medicamentos antidepresivos (por ejemplo, fluoxetina);
medicamentos utilizados para tratar convulsiones (por ejemplo, carbamazepina, fenitoína);
medicamentos utilizados para reducir los niveles de grasas en la sangre (por ejemplo, gemfibrozilo);
medicamentos utilizados para tratar la acidez estomacal o las úlceras estomacales (por ejemplo, cimetidina);
medicamentos utilizados para tratar el VIH y el SIDA (por ejemplo, ritonavir, saquinavir, indinavir, nelfinavir, efavirenz, nevirapina);
un medicamento llamado clopidogrel, utilizado para prevenir la formación de coágulos sanguíneos.
La cantidad de alcohol en este medicamento puede afectar la acción de otros medicamentos. Si el paciente está tomando otros medicamentos, debe consultar a su médico o farmacéutico.
Embarazo, lactancia y fertilidad Si el paciente está embarazada o cree que puede estar embarazada, debe informar a su médico antes de comenzar el tratamiento con Paclitaxel Kabi.
Si existe la posibilidad de quedar embarazada durante el tratamiento, debe utilizar métodos anticonceptivos efectivos y seguros. No se recomienda el uso de Paclitaxel Kabi durante el embarazo, a menos que sea absolutamente necesario.
Los pacientes varones y mujeres en edad reproductiva, así como sus parejas, deben utilizar métodos anticonceptivos durante al menos 6 meses después de finalizar el tratamiento con paclitaxel. Los varones deben consultar a su médico antes del tratamiento sobre la conservación de esperma, debido al riesgo de infertilidad irreversible.
Si el paciente está lactando, debe informar a su médico.No se sabe si paclitaxel se excreta en la leche materna. Debido al posible efecto nocivo del medicamento en el lactante, debe interrumpir la lactancia durante el tratamiento con Paclitaxel Kabi. No debe reanudar la lactancia hasta que su médico lo indique.
Conducción de vehículos y uso de máquinas
No hay razón por la que el paciente no pueda conducir vehículos entre los ciclos de tratamiento. Sin embargo, debe recordar que Paclitaxel Kabi contiene una cantidad de alcohol y no se recomienda conducir vehículos inmediatamente después de recibir el medicamento debido a su posible efecto en el sistema nervioso central. Como en cualquier caso, no debe conducir vehículos ni operar máquinas si experimenta mareos o sensación de vacío en la cabeza.
La cantidad de alcohol en este medicamento puede afectar la capacidad para conducir vehículos y operar máquinas, ya que puede afectar la evaluación de la situación y la velocidad de reacción.
Paclitaxel Kabi contiene macrogol glicerol ricinoleato y alcohol
El medicamento contiene macrogol glicerol ricinoleato, que puede causar reacciones alérgicas graves.
Debe informar a su médico si es alérgico a este componente del medicamento Paclitaxel Kabi.
Este medicamento contiene 393 mg de alcohol (etanol) por ml, lo que equivale a 39,3% v/v. La cantidad de alcohol en una dosis de 52,5 ml de este medicamento es equivalente a 515,8 ml de cerveza o 206,3 ml de vino.
Si el paciente tiene epilepsia o problemas hepáticos, debe consultar a su médico o farmacéutico antes de tomar el medicamento.
Si el paciente es adicto al alcohol, debe consultar a su médico o farmacéutico antes de tomar este medicamento.
3. Cómo tomar Paclitaxel Kabi
Para minimizar las reacciones alérgicas, antes de comenzar el tratamiento con Paclitaxel Kabi, el paciente recibirá otros medicamentos. Estos medicamentos pueden administrarse en forma de tabletas o infusión intravenosa, o en ambas formas.
Paclitaxel Kabi se administra por infusión intravenosa en una vena, a través de un filtro incluido en el kit. Paclitaxel Kabi es administrado por personal médico capacitado.
El personal médico capacitado preparará la solución para infusión antes de la administración. La dosis del medicamento dependerá también de los resultados de los análisis de sangre del paciente. Dependiendo del tipo y la gravedad del cáncer, Paclitaxel Kabi se utiliza como monoterapia o en combinación con otro medicamento contra el cáncer.
Paclitaxel Kabi siempre debe administrarse en una vena durante 3 o 24 horas. Por lo general, el medicamento se administra cada 2 o 3 semanas, a menos que el médico lo indique de otra manera. El médico informará al paciente sobre la cantidad de ciclos de tratamiento con Paclitaxel Kabi que el paciente debe recibir.
Si el paciente tiene alguna duda adicional sobre la administración de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Paclitaxel Kabi puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe informar inmediatamente a su médico si experimenta alguno de los siguientes síntomas de reacción
alérgica,incluyendo uno o más de los siguientes síntomas:
olas de calor;
reacciones cutáneas;
picazón;
presión en el pecho;
dificultad para respirar o falta de aliento;
hinchazón.
Todos estos síntomas pueden ser indicativos de reacciones adversas graves.
Debe informar inmediatamente a su médico si experimenta:
fiebre, escalofríos intensos, dolor de garganta o úlceras en la boca(síntomas de supresión de la médula ósea);
entumecimiento o debilidad en las manos y los pies(síntomas de neuropatía periférica);
diarrea grave o persistente, acompañada de fiebre y dolor abdominal.
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 pacientes):
reacciones alérgicas leves, como olas de calor, erupciones, picazón;
infecciones: principalmente de las vías respiratorias superiores y del tracto urinario;
dolor de garganta o úlceras en la boca, dolor o enrojecimiento en la boca, diarrea, malestar general (náuseas, vómitos);
pérdida de cabello (en la mayoría de los casos, la pérdida de cabello comenzó antes de un mes después del inicio del tratamiento con paclitaxel. En la mayoría de estos pacientes, se produjo una pérdida de cabello visible (más del 50%)).
dolor muscular, calambres, dolor articular;
- entumecimiento, picazón o debilidad en las manos y los pies (síntomas de neuropatía periférica); pueden persistir más de 6 meses después de finalizar el tratamiento con paclitaxel;
- análisis de sangre pueden indicar: recuento reducido de plaquetas, lo que puede provocar sangrado y mayor tendencia a formar moretones, recuento reducido de glóbulos blancos o rojos, y presión arterial baja.
Frecuentes (pueden ocurrir con menos frecuencia que en 1 de cada 10 pacientes):
cambios transitorios y leves en las uñas y trastornos de la piel, reacciones en el lugar de la inyección (hinchazón, dolor, enrojecimiento de la piel);
análisis de sangre pueden indicar: frecuencia cardíaca reducida, aumento significativo de la actividad de las enzimas hepáticas (fosfatasa alcalina y transaminasa aspartato).
Poco frecuentes (pueden ocurrir con menos frecuencia que en 1 de cada 100 pacientes):
choque séptico (shock causado por infección);
palpitaciones, trastornos del ritmo cardíaco (bloqueo auriculoventricular, cardiomiopatía), taquicardia, infarto de miocardio, insuficiencia respiratoria;
fatiga, sudoración, mareo, reacciones alérgicas graves, flebitis, hinchazón de la cara, los labios, la boca, la lengua o la garganta;
dolor de espalda, dolor en el pecho, dolor en las manos y los pies, escalofríos, dolor abdominal;
análisis de sangre pueden indicar: aumento significativo de la bilirrubina (ictericia), presión arterial alta, coágulo sanguíneo.
Raros (pueden ocurrir con menos frecuencia que en 1 de cada 1000 pacientes):
recuento reducido de glóbulos blancos con fiebre y mayor riesgo de infección (fiebre neutropénica);
trastornos del sistema nervioso, incluyendo debilidad muscular en los brazos y las piernas (neuropatía motora);
insuficiencia cardíaca;
dificultad para respirar, embolia pulmonar, fibrosis pulmonar, neumonitis intersticial, disnea, derrame pleural;
obstrucción intestinal, perforación intestinal, colitis isquémica, pancreatitis;
picazón, erupciones, enrojecimiento de la piel (eritema);
infección sanguínea (sepsis), peritonitis, neumonitis;
fiebre, deshidratación, debilidad, hinchazón y malestar general;
reacciones alérgicas graves que ponen en peligro la vida (anafilaxia);
análisis de sangre pueden indicar: aumento de la creatinina en sangre, lo que indica trastornos renales.
Muy raros (pueden ocurrir con menos frecuencia que en 1 de cada 10 000 pacientes):
ritmo cardíaco irregular y rápido (fibrilación auricular, taquicardia supraventricular);
trastornos sanguíneos graves (leucemia aguda, síndrome mielodisplásico);
trastornos del nervio óptico y/o visión (opacidades en la córnea);
pérdida de audición o trastornos del oído (otoxicidad), tinnitus, mareo de origen vestibular;
tos;
coágulo sanguíneo en los vasos sanguíneos del abdomen y los intestinos (trombosis mesentérica), colitis, a veces con diarrea grave y persistente (colitis pseudomembranosa, colitis neutropénica), ascitis, esofagitis, estreñimiento;
reacciones alérgicas graves, incluyendo fiebre, enrojecimiento de la piel, dolor articular y/o inflamación ocular (síndrome de Stevens-Johnson), descamación de la piel (exfoliación cutánea), enrojecimiento con manchas rojas irregulares (eritema polimorfo), inflamación de la piel con ampollas y descamación (dermatitis exfoliativa), urticaria, separación de las uñas del lecho ungueal (pacientes en tratamiento deben utilizar protector solar en las manos y los pies);
pérdida de apetito (anorexia);
reacciones alérgicas graves que ponen en peligro la vida (anafilaxia);
trastornos hepáticos (necrosis hepática, encefalopatía hepática, en ambos casos se han reportado casos de muerte);
confusión;
convulsiones, daño nervioso en el cerebro (neuropatía autonómica que afecta las funciones involuntarias del cuerpo, lo que puede causar obstrucción intestinal y caída de la presión arterial), convulsiones, trastornos cerebrales (encefalopatía), mareo, dolor de cabeza, dificultad para coordinar los movimientos (ataxia).
Frecuencia no conocida (no puede determinarse a partir de los datos disponibles):
síndrome de lisis tumoral (síndrome de descomposición de la tumor);
acumulación de líquido en la mácula (edema macular), percepción de fenómenos luminosos como destellos (fotopsia), depósitos en el cuerpo vítreo (opacidades vítreas);
flebitis;
esclerosis de la piel, los vasos sanguíneos y los órganos internos (esclerodermia);
lupus eritematoso sistémico (eritema en forma de mariposa);
trastornos de la coagulación, se han reportado casos de coagulación intravascular diseminada (CID, por sus siglas en inglés); es una enfermedad grave que causa sangrado o coágulos excesivos, o ambos, al mismo tiempo;
enrojecimiento y hinchazón en la superficie interna de las manos y los pies, que pueden causar descamación de la piel.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 34 00
Fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos es importante, ya que permite recopilar más información sobre la seguridad de este medicamento.
5. Cómo conservar Paclitaxel Kabi
Conservar el medicamento en un lugar donde no pueda ser visto ni alcanzado por los niños.
No conservar a temperaturas superiores a 25°C.
Conservar las ampollas en el embalaje exterior para protegerlas de la luz.
No utilizar este medicamento después de la fecha de caducidad que se indica en el etiquetado y el embalaje: VENC.
La fecha de caducidad es el último día del mes indicado.
No utilizar este medicamento si se observan signos de turbidez o precipitado. Los medicamentos no deben tirarse por el desagüe ni a los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Paclitaxel Kabi?
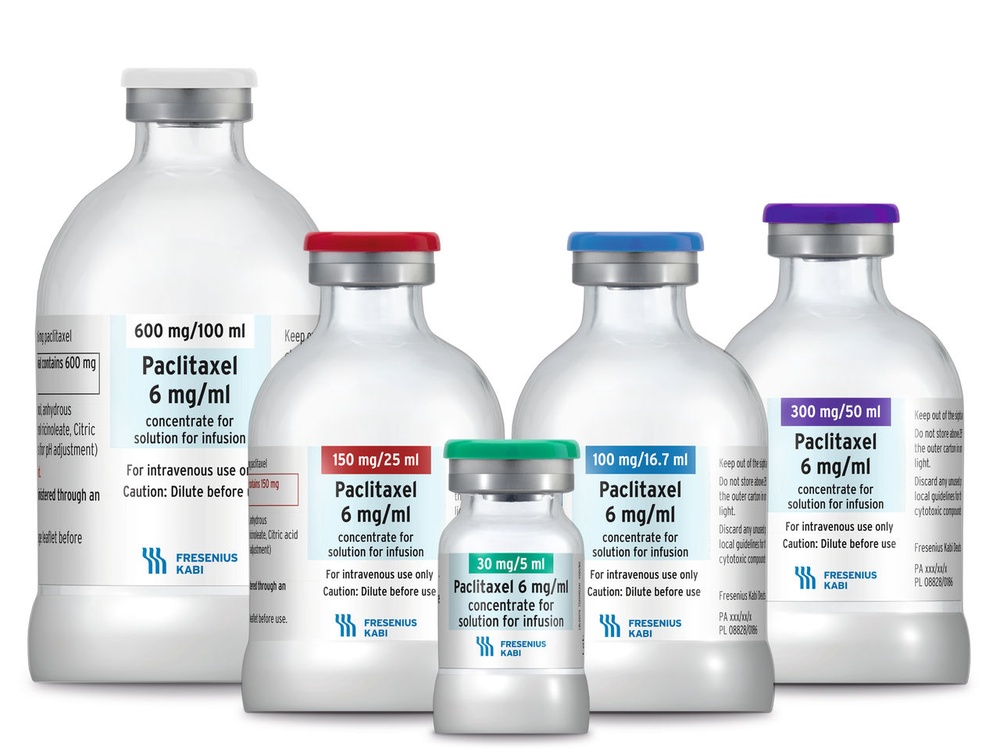
El principio activo es paclitaxel. Cada ml contiene 6 mg de paclitaxel.
Cada ampolla de 5 ml contiene 30 mg de paclitaxel.
Cada ampolla de 16,7 ml contiene 100 mg de paclitaxel.
Cada ampolla de 25 ml contiene 150 mg de paclitaxel.
Cada ampolla de 50 ml contiene 300 mg de paclitaxel.
Cada ampolla de 100 ml contiene 600 mg de paclitaxel.
Los demás componentes son: etanol anhidro, macrogol glicerol ricinoleato y ácido cítrico anhidro (para ajustar el pH).
Cómo se presenta Paclitaxel Kabi y qué contiene el embalaje?
Concentrado para solución para infusión.
Paclitaxel Kabi es una solución clara y ligeramente amarillenta.
El medicamento se presenta en ampollas de vidrio con tapón de goma clorobutilada recubierta de teflón.
Tamaños del embalaje:
Los embalajes contienen 1 o 5 ampollas de vidrio.
No todos los tamaños del embalaje pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización:
Fresenius Kabi España, S.A.
Calle de Albacete, 3
28027 Madrid
Fabricante:
Fresenius Kabi Deutschland GmbH
Pfingstweide 53
61169 Friedberg
Alemania
Corden Pharma Latina S.p.A.
Via Murillo No. 7
04013 Sermoneta (LT)
Italia
Para obtener más información, debe consultar al titular de la autorización de comercialización:
Fresenius Kabi España, S.A.
Calle de Albacete, 3
28027 Madrid
Teléfono: +34 91 388 88 00
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
| Austria | Paclitaxel Kabi 6 mg/ml Konzentrat zur Herstellung einer Infusionslösung |
| Bélgica | Paclitaxel Fresenius Kabi |
| Bulgaria | Paclitaxel Kabi 6 mg/ml Концентрат за инфузионен разтвор |
| República Checa | Paclitaxel Kabi |
| Dinamarca | Paclitaxel Fresenius Kabi 6 mg/ koncentrat til infusionsvaeske, opløsning |
| Estonia | Paclitaxel Kabi 6 mg/ml infusioonilahuse kontsentraat |
| Finlandia | Paclitaxel Fresenius Kabi 6 mg/ml infuusiokonsentraatti, liuosta varten |
| Francia | Paclitaxel Kabi 6 mg/ml solution à diluer pour perfusion |
| Alemania | Paclitaxel Kabi 6 mg/ml Konzentrat zur Herstellung einer Infusionslösung |
Fecha de la última revisión de la hoja de instrucciones:28/06/2021
-----------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente a profesionales sanitarios:
Preparación:
Al igual que con otros medicamentos contra el cáncer, debe tener cuidado al preparar paclitaxel para su administración. El diluido debe prepararse por personal capacitado en un área designada y en condiciones asépticas. Debe utilizarse equipo de protección personal adecuado. Debe seguir las precauciones para evitar el contacto del medicamento con la piel y las mucosas. En caso de contacto con la piel, el área debe lavarse con jabón y agua. En caso de contacto con las mucosas, debe enjuagarse con agua. Se han observado sensaciones de picazón, ardor y enrojecimiento en el lugar de contacto. En caso de inhalación del vapor del medicamento, se han observado dificultad para respirar, dolor en el pecho, ardor en la garganta y náuseas.
Si se almacenan las ampollas cerradas en el refrigerador, puede precipitarse un sedimento que se redispersa después de un ligero agitado o sin agitado después de alcanzar la temperatura ambiente. Esto no afecta la calidad del medicamento. Si la solución permanece turbia o el sedimento no se redispersa, la ampolla debe desecharse.
En caso de múltiples penetraciones de la aguja y extracción del medicamento, las ampollas mantienen la estabilidad microbiológica, química y física durante 28 días a 25°C. El usuario es responsable de otras condiciones y del tiempo de almacenamiento del medicamento.
No debe utilizarse el dispositivo Chemo-Dispensing Pin o dispositivos similares con punzón para extraer dosis de la ampolla, ya que pueden dañar el tapón y provocar la pérdida de esterilidad.
Preparación de la solución para infusión:
Antes de la administración de paclitaxel por infusión intravenosa, debe diluirse en condiciones asépticas en una solución de glucosa al 5%, solución de cloruro de sodio al 0,9%, solución de glucosa al 5% en solución de Ringer o solución de glucosa al 5% con cloruro de sodio al 0,9%, para obtener una concentración de 0,3 a 1,2 mg/ml.
La solución preparada para infusión es químicamente y físicamente estable durante 24 horas a 25°C cuando se diluye en solución de glucosa al 5%, solución de cloruro de sodio al 0,9%, solución de glucosa al 5% en solución de Ringer y solución de glucosa al 5% con cloruro de sodio al 0,9%. Desde el punto de vista microbiológico, el medicamento debe administrarse inmediatamente. Si no se administra de inmediato, la persona que administra el medicamento es responsable del tiempo y las condiciones de almacenamiento antes de la administración. En este caso, la solución no debe almacenarse durante más de 24 horas a una temperatura entre 2°C y 8°C, a menos que la reconstitución y la dilución se hayan realizado en condiciones asépticas controladas y validadas.
Después de la preparación, las soluciones están destinadas a un solo uso.
Después de la preparación, las soluciones pueden ser turbias, lo que se debe a las propiedades de los excipientes y no puede eliminarse mediante filtración. Paclitaxel debe administrarse por infusión intravenosa a través de un conjunto de infusión con filtro interno con membrana microporosa de ≤0,22 μm. En los estudios de prueba, no se observó una pérdida significativa de la actividad del medicamento después de la administración de la solución a través de un conjunto de infusión intravenosa con filtro interno.
Raramente se han notificado casos de precipitación de un sedimento durante la infusión de paclitaxel, generalmente al final de la infusión de 24 horas. Aunque la causa de la precipitación del sedimento no se ha explicado, probablemente esté relacionada con la saturación de la solución diluida. Para reducir el riesgo de precipitación del sedimento, paclitaxel debe administrarse lo antes posible después de la dilución y debe evitarse el agitado o las sacudidas bruscas de la solución. Los conjuntos de infusión deben enjuagarse cuidadosamente antes de su uso. El aspecto de la solución debe verificarse regularmente durante la infusión intravenosa y, en caso de precipitación del sedimento, debe interrumpirse la infusión.
Para reducir el riesgo de exposición del paciente al DEHP (di-(2-etilhexilo) ftalato), que puede migrar de las bolsas de PVC, los conjuntos de infusión y otros dispositivos médicos, la solución diluida de paclitaxel debe almacenarse en botellas de materiales diferentes a PVC (vidrio, polipropileno) o en bolsas de plástico (polipropileno, poliolefina) y administrarse a través de conjuntos de infusión recubiertos de polietileno. El uso de conjuntos con filtro (por ejemplo, IVEX-2) con entrada o tubo de salida corto realizado en PVC no causa una migración significativa de DEHP.
Instrucciones de seguridad para la preparación de la solución para infusión
- 1. Todas las operaciones deben realizarse en un área designada/área de seguridad. Se requiere el uso de guantes y bata de protección. En caso de que no haya un área de seguridad separada, debe utilizarse mascarilla y gafas de protección.
- 2. Las mujeres embarazadas o que puedan estar embarazadas no deben preparar este medicamento.
- 3. Los contenedores abiertos, como ampollas y botellas, y las agujas y jeringas usadas, así como los restos del medicamento, deben considerarse como residuos peligrosos y eliminarse de acuerdo con las regulaciones locales para el manejo de RESIDUOS PELIGROSOS.
- 4. En caso de derrame de la solución, debe seguir las siguientes instrucciones: - debe usar ropa de protección - el vidrio roto debe recogerse y colocarse en un contenedor para RESIDUOS PELIGROSOS - las superficies contaminadas deben enjuagarse adecuadamente con grandes cantidades de agua fría - las superficies enjuagadas deben secarse y los materiales utilizados para el secado deben eliminarse de acuerdo con las recomendaciones para el manejo de RESIDUOS PELIGROSOS.
- 5. En caso de contacto de paclitaxel con la piel, el área afectada debe enjuagarse con grandes cantidades de agua, luego lavarse con agua y jabón. En caso de contacto con las mucosas, debe enjuagarse con agua de inmediato. En caso de cualquier sensación de malestar, debe consultar a un médico.
- 6. En caso de que paclitaxel entre en contacto con los ojos, debe enjuagarse con grandes cantidades de agua fría. Debe consultar a un oftalmólogo de inmediato.
Eliminación de residuos
Todos los restos del medicamento no utilizados y los residuos deben eliminarse de acuerdo con las regulaciones locales para medicamentos citotóxicos.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorCorden Pharma Latina S.p.A Fresenius Kabi Deutschland GmbH Pharmavalid Limited Microbiological Laboratory Wessling GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Paclitaxel KabiForma farmacéutica: Concentrado, 6 mg/mlPrincipio activo: PaclitaxelFabricante: Ebewe Arzneimittel Ges.m.b.H.Requiere recetaForma farmacéutica: Concentrado, 6 mg/mlPrincipio activo: PaclitaxelNo requiere recetaForma farmacéutica: Concentrado, 10 mg/mlPrincipio activo: CabazitaxelRequiere receta
Alternativas a Paclitaxel Kabi en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Paclitaxel Kabi en España
Alternativa a Paclitaxel Kabi en Ucrania
Médicos online para Paclitaxel Kabi
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Paclitaxel Kabi – sujeta a valoración médica y normativa local.