

Феіба Нф

Запитайте лікаря про рецепт на Феіба Нф

Інструкція із застосування Феіба Нф
Упаковка з інструкцією для користувача
FEIBA NF, 500 од., порошок і розчинник для приготування розчину для ін'єкцій
Комплекс факторів згортання крові проти інгібітора фактору VIII
Перш ніж використовувати препарат, уважно ознайомтеся з вмістом інструкції, оскільки вона містить важливу інформацію для пацієнта.
- Збережіть цю інструкцію, щоб у разі потреби знову її прочитати.
- У разі виникнення будь-яких сумнівів зверніться до лікаря, фармацевта або медсестри.
- Цей препарат призначений конкретній особі. Не передавайте його іншим. Препарат може нашкодити іншій особі, навіть якщо симптоми її захворювання такі самі.
- Якщо в пацієнта виникнуть будь-які побічні ефекти, включаючи будь-які побічні ефекти, не перераховані в цій інструкції, повідомте про це лікаря, фармацевта або медсестру. Див. пункт 4.
Зміст інструкції
- 1. Що таке препарат FEIBA NF і для чого він використовується
- 2. Важлива інформація перед використанням препарату FEIBA NF
- 3. Як використовувати препарат FEIBA NF
- 4. Можливі побічні ефекти
- 5. Як зберігати препарат FEIBA NF
- 6. Зміст упаковки і інші відомості
1. Що таке препарат FEIBA NF і для чого він використовується
FEIBA NF - це препарат, отриманий з людської плазми крові, який дозволяє згортанню крові у разі дефіциту або відсутності деяких факторів згортання.
Препарат FEIBA NF використовується для лікування кровотеч і профілактики кровотеч у пацієнтів з гемофілією А і гемофілією Б, ускладнених наявністю інгібіторів факторів згортання крові.
Крім того, препарат FEIBA NF може бути використаний для лікування і профілактики кровотеч у осіб, які не страждають на гемофілію, але мають набуті інгібітори факторів VIII, IX і XI.
Є окремі повідомлення про використання FEIBA NF у лікуванні пацієнтів з набутими інгібіторами факторів X і XIII.
Препарат FEIBA NF також використовується в поєднанні з концентратом фактору VIII під час тривалого лікування, спрямованого на повне і тривале усунення інгібіторів фактору VIII, щоб дозволити регулярне лікування концентратом фактору VIII, як у пацієнтів без інгібіторів.
2. Важлива інформація перед використанням препарату FEIBA NF
Повідомте лікаря, якщо в пацієнта є будь-яка алергія.
Повідомте лікаря, якщо пацієнт дотримується низькосодової дієти.
Коли не використовувати препарат FEIBA NF
У ситуаціях, перелічених нижче, препарат FEIBA NF повинен бути використаний лише тоді, коли не можна очікувати результатів лікування за допомогою інших відповідних концентратів факторів згортання крові, наприклад, через дуже високий титр інгібітора і загрозливу для життя кровотечу або ризик кровотечі (після травми, після операції).
- якщо в пацієнта виявлена алергія (гіперчутливість) на комплекс факторів згортання крові проти інгібітора фактору VIII або на будь-який інший складник препарату FEIBA NF.
- якщо спостерігається поширений згортання крові в судинах (DIC, коагулопатія з витрачанням, стан, який загрожує життю, пов'язаний з масивним згортанням крові з утворенням кров'яних згустків у судинах. Це призводить до загального витрачання факторів згортання крові.): якщо результати лабораторних досліджень і (або) клінічні симптоми вказують на ушкодження печінки, існує підвищений ризик DIC через затримку деградації активних факторів згортання крові;
- у разі захворювання коронарних судин серця, гострої тромбози і (або) емболії: препарат FEIBA NF повинен бути використаний лише в епізодах кровотеч, які загрожують життю.
Остережності та попередження
Перш ніж використовувати FEIBA NF, слід зв'язатися з лікарем, оскільки, як і в разі інших препаратів плазми крові, які вводяться внутрішньовенно, можливе виникнення алергічних реакцій. Пацієнт повинен бути здатний розпізнавати ранні симптоми алергічної реакції, такі як:
- червоність
- висипка на шкірі
- свербляча висипка (кропивниця)
- свербіння
- набряк губ і язика
- свистячий дихання
- чуття стиснення в грудній клітці
- загальна слабкість
- головокружіння
- наглий спад артеріального тиску, щоб якнайшвидше розпізнати алергічну реакцію.
Інші симптоми алергічної реакції на препарати плазми крові включають кому та безпокій.
У разі виникнення одного або декількох з цих симптомів слід негайно припинити використання препарату і звернутися до лікаря. Перелічені симптоми можуть бути ранніми ознаками анафілактичного шоку.
Важкі симптоми гіперчутливості вимагають негайного надання першої допомоги.
У разі пацієнтів з підозрою на гіперчутливість до препарату або будь-якого з його складників лікар вирішить про повторне введення препарату FEIBA NF лише після ретельного розгляду ризику та очікуваних вигод і (або) коли не можна очікувати результатів лікування за допомогою іншої профілактичної терапії чи альтернативних лікарських засобів.
- якщо в пацієнта виникнуть значні зміни артеріального тиску або частоти серцевих скорочень, труднощі з диханням, кашель або біль у грудній клітці. Слід негайно припинити вливання і звернутися до лікаря. Лікар проведе відповідні діагностичні та терапевтичні заходи.
- у пацієнтів з гемофілією та наявністю інгібітора або набутими інгібіторами факторів згортання крові. Під час лікування препаратом FEIBA NF у цих пацієнтів може виникнути підвищена схильність до кровотеч і одночасно підвищений ризик тромбозу.
Під час лікування препаратом FEIBA NF спостерігалися тромботичні ускладнення, включаючи поширений згортання крові в судинах (DIC), тромбоз глибоких вен, легенева емболія, інфаркт міокарда та інсульт. Деякі тромботичні ускладнення спостерігалися при застосуванні великих доз препарату FEIBA NF. Одночасне застосування рекомбінантного фактору VIIа може підвищувати ризик виникнення тромботичних ускладнень.
Відомості про мікроангіопатичну тромботичну хворобу були отримані під час клінічного дослідження емісізумабу, у якому пацієнти отримували препарат FEIBA NF як частина схеми лікування кровотеч.
У разі препаратів, виготовлених з людської крові або плазми крові, проводяться певні заходи з профілактики інфекцій, які передаються пацієнтам. До цих заходів належить ретельний відбір донорів крові та плазми крові, щоб переконатися, що ті, хто належить до групи ризику передачі інфекцій, виключаються, а також перевірка окремих проб наданої крові та пулів зібраної плазми крові на наявність вірусів/інфекцій. Виробники цих препаратів на етапі обробки крові та плазми крові включають також стадії, які направлені на інактивацію або видалення вірусів. Незважаючи на такі заходи, при введенні препаратів, виготовлених з людської крові або плазми крові, не можна повністю виключити можливість передачі інфекції. Це стосується також невідомих або недавно виявлених вірусів чи інших видів інфекцій.
Проводимі заходи вважаються ефективними щодо вірусів з оболонкою, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту типу Б і вірус гепатиту типу С, а також вірус гепатиту типу А без оболонки. Проводимі заходи можуть мати обмежену цінність щодо вірусів без оболонки, таких як парвовірус В19. Інфекція парвовірусом В19 може бути серйозною у вагітних жінок (інфекція плода) та осіб з дефіцитом імунітету або підвищеною еритропоезом (наприклад, гемолітична анемія).
У пацієнтів, які регулярно або багаторазово отримують фактор VIII, отриманий з людської плазми крові, слід розглянути можливість застосування відповідних вакцин (проти вірусного гепатиту типу А і Б).
Після введення великих доз препарату FEIBA NF може спостерігатися тимчасовий зростання пасивно перенесених антитіл до поверхневого антигену вірусу гепатиту типу Б, що може привести до хибно позитивних результатів серологічних тестів.
Препарат містить ізогемаглютинини, антитіла до червоних кров'яних клітин, які пасивно перенесені можуть викликати плутані результати серологічних тестів.
Натурально рекомендується, щоб під час кожного введення препарату FEIBA NF пацієнту записувати назву та номер серії препарату для збереження інформації про використані серії.
FEIBA NF та інші препарати
Повідомте лікаря про всі препарати, які ви зараз приймаєте, навіть ті, що доступні без рецепта.
Не проводилися відповідні та добре контрольовані дослідження щодо комбінованої терапії або послідовного застосування FEIBA NF та рекомбінантного фактору VIIа, препаратів, які гальмують фібриноліз, або емісізумабу. Слід розглянути можливість виникнення тромботичних ускладнень у разі одночасного застосування системних препаратів, які гальмують фібриноліз, таких як, наприклад, кислота транексамова та кислота амінокапронова, у поєднанні з FEIBA NF.
Отже, препарати, які гальмують фібриноліз, не повинні застосовуватися протягом приблизно 6-12 годин після введення FEIBA NF.
Відносно доступних даних клінічних досліджень in vitro та спостережень, у разі одночасного застосування рекомбінантного фактору VIIа не можна виключити можливість потенційної взаємодії препаратів, яка може привести до тромботичного ускладнення.
Якщо лікування препаратом FEIBA NF розглядається після того, як пацієнт отримував емісізумаб, пацієнта слід ретельно спостерігати лікарем, який веде лікування.
Як і в разі всіх лікарських препаратів факторів згортання крові, не слід змішувати препарат FEIBA NF з іншими препаратами перед введенням; це може негативно вплинути на ефективність та безпеку застосування препарату.
Рекомендується, щоб перед і після введення препарату FEIBA NF вхід до судини промивався ізотонічним розчином хлору натрію.
Вагітність, годування грудьми та вплив на фертильність
Лікар вирішить, чи можна застосовувати FEIBA NF під час вагітності чи годування грудьми. У зв'язку з підвищеним ризиком тромбозу під час вагітності препарат FEIBA NF повинен застосовуватися лише під ретельним медичним контролем і лише тоді, коли це явно показано.
Відповідність для керування транспортними засобами та обслуговування машин
Не спостерігалося жодного впливу на здатність керувати транспортними засобами та обслуговувати машини.
FEIBA NF містить натрій
Препарат містить 80 мг натрію (основного компонента кухонної солі) в кожній флаконі. Це відповідає 4% максимальної рекомендованої добової дози натрію в дієті для дорослих.
3. Як застосовувати препарат FEIBA NF
Ліофілізований порошок FEIBA NF розчиняється у доданому розчиннику та вводиться внутрішньовенно.
Препарат FEIBA NF слід застосовувати строго за рекомендацією лікаря. У разі сумнівів зверніться до лікаря або фармацевта.
Лікар встановлює відповідну дозу та частоту введення індивідуально для кожного пацієнта, враховуючи тяжкість порушення згортання крові, місце та ступінь кровотечі, а також загальний стан пацієнта та його реакцію на препарат. Не слід самостійно змінювати встановлену лікарем дозування препарату чи припиняти його введення.
Якщо пацієнт відчуває, що препарат діє надто сильно або надто слабко, слід звернутися до лікаря або фармацевта.
Перед введенням слід нагріти препарат до кімнатної температури або температури тіла, якщо це необхідно.
Препарат FEIBA NF слід підготувати лише безпосередньо перед введенням.
Підготовлений розчин слід використовувати негайно (препарат не містить консервантів).
Негайно перемішайте рухом обертання до розчинення порошку. Слід переконатися, що препарат FEIBA NF повністю розчинився, інакше через фільтр пристрою пройде менше одиниць FEIBA.
Не слід застосовувати розчин, який є мутним або містить осад. Не використовувати розчин з раніше відкритих флаконів.
Використовуйте лише доданий розчинник (стерильну воду для ін'єкцій) та набір для приготування розчину.
Якщо ви використовуєте інший набір для приготування та введення, ніж той, який доданий до упаковки FEIBA NF, слід переконатися, що ви використовуєте відповідний фільтр з розміром порів не менше 149 мкм.
Не застосовуйте, якщо система підтримання стерильності або упаковка препарату пошкоджені чи псуються.
Запишіть введення препарату на доданій самоклейкій етикетці.
Всі невикористані залишки препарату чи його відходи слід видалити у відповідності з місцевими правилами.
Введення за допомогою голок:
Приготування розчину для ін'єкцій
Слід дотримуватися правил асептики під час усієї процедури.
- 1. Нагріть закриту флакон з розчинником (стерильну воду для ін'єкцій) до кімнатної температури, якщо це необхідно, наприклад, використовуючи для нагрівання водяну лазню протягом декількох хвилин (макс. 37°C).
- 2. Видаліть захисні ковпачки з флаконів з порошком і розчинником та дезінфікуйте гумовими пробками обидва флакони.
- 3. Прокрутіть і потягніть, щоб видалити захисний ковпачок з одного кінця доданої двосторонньої голки (рис. А) та вставьте відкриту голку в пробку флакону з розчинником (рис. Б).
- 4. Видаліть захисний ковпачок з другого кінця двосторонньої голки, звернувши увагу на те, щоб не торкнутися відкритої частини.
- 5. Переверніть флакон з розчинником догори дном над флаконом з порошком та вставьте вільний кінець двосторонньої голки в гумову пробку флакону з порошком (рис. Д). Розчинник буде всмоктаний у флакон з порошком на принципі вакууму.
- 6. Від'єднайте обидва флакони, витягуючи голку з флакону з порошком (рис. Е). Негайно потрясіть або поверніть флакон з порошком, щоб прискорити процес розчинення.
Введення/інфузія:
Слід дотримуватися правил асептики під час усієї процедури.
- 1. Зніміть захисний ковпачок з доданої голки з фільтром, прокрутив його, та насадіть голку на стерильний одноразовий шприц. Витягніть розчин у шприц (рис. Г).
- 2. Від'єднайте голку з фільтром від шприца та після встановлення доданого інфузійного набору з голкою-бабочкою (або одноразовою голкою для ін'єкцій) введіть розчин повільно внутрішньовенно. Для контролю швидкості введення можна використовувати шприцевий насос.
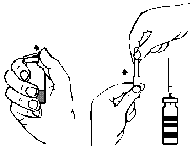
рис. А рис. Б рис. В рис. Г рис. Д рис. Е рис. Ж
Введення за допомогою BAXJECT II Hi-Flow
Приготування розчину для ін'єкцій
Слід дотримуватися правил асептики під час усієї процедури.
- 1. Допроведіть флакон з розчинником (стерильну воду для ін'єкцій) до кімнатної температури, якщо це необхідно, наприклад, використовуючи для нагрівання водяну лазню протягом декількох хвилин (макс. 37°C).
- 2. Видаліть захисні ковпачки з флаконів з порошком і розчинником та дезінфікуйте гумовими пробками обидва флакони. Помістіть флакони на плоскій поверхні.
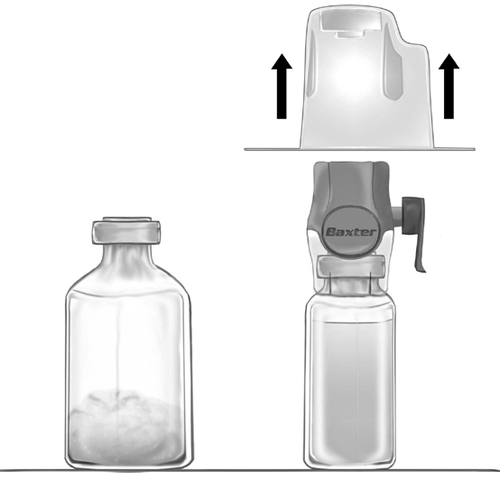
- 3. Відкрийте упаковку пристрою BAXJECT II Hi-Flow, відірвавши паперовий ковпачок, не торкаючись внутрішньої частини (рис. а). Не виймайте пристрій з упаковки.
- 4. Переверніть упаковку догори дном та проколіть прозорий пластиковий наконечник через пробку флакону з розчинником (рис. б). Тримаючи упаковку за краю, зніміть її з пристрою BAXJECT II Hi-Flow (рис. в). Не видаліть синюю пробку з пристрою BAXJECT II Hi-Flow.
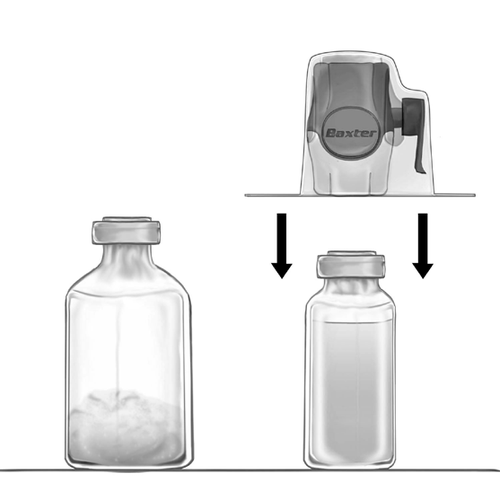
- 5. BAXJECT II Hi-Flow, поєднаний з флаконом з розчинником, переверніть так, щоб флакон з розчинником знаходився над пристроєм. Проколіть білий пластиковий наконечник через пробку флакону з порошком FEIBA NF. Під впливом вакууму розчинник буде всмоктаний у флакон з порошком FEIBA NF (рис. д).
- 6. Перемішайте ніжно, рухом обертання, але без потрясіння, до повного розчинення продукту. Слід переконатися, що FEIBA NF повністю розчинився – інакше речовина не пройде через фільтр пристрою.
рис. а
рис. б
рис. в

Введення/інфузія
Слід дотримуватися правил асептики під час усієї процедури
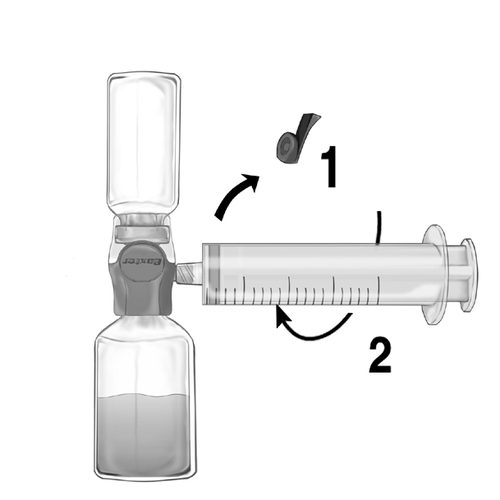
- 1. Видаліть синюю пробку з пристрою BAXJECT II Hi-Flow. Тісно поєднайте шприц з BAXJECT II Hi-Flow (НЕ НАБИРАЙТЕ ПОВІТРЯ ДО ШПРИЦА) Для забезпечення герметичного з'єднання між шприцем та пристроєм BAXJECT II Hi-Flow особливо рекомендується використовувати шприц з кінцем типу луер (закріпляючи шприц, слід повернути його за годинниковою стрілкою до моменту зупинки) (рис. е).
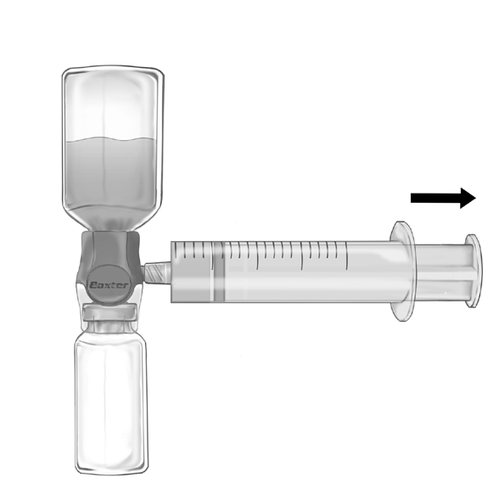
- 2. Переверніть набір так, щоб розчин знаходився зверху. Витягніть розчин у шприц, ПОВІЛЬНО тягнувши поршень назад та переконавшись, що з'єднання між шприцем та пристроєм BAXJECT II Hi-Flow є герметичним, а шприц закріплений протягом усього часу витягування розчину (рис. ф).
- 3. Від'єднайте шприц.
- 4. Якщо в шприці з'явився спінений розчин, слід чекати до моменту зникнення піни. Розчин слід вводити повільно внутрішньовенно, використовуючи інфузійний набір (або одноразову голку для ін'єкцій). Для контролю швидкості введення можна використовувати шприцевий насос.
рис. д
рис. е
рис. ф

Не слід перевищувати швидкість 2 одиниць FEIBA на кг маси тіла на хвилину.
У разі прийняття більшої дози, ніж рекомендовано:
Слід негайно повідомити лікаря. Передозування FEIBA NF може підвищити ризик побічних ефектів, таких як стани тромбозу (утворення тромбів, які переміщуються в судинах), коагулопатія «з витрачанням» (порушення згортання крові DIC) або інфаркт міокарда.
4. Можливі побічні ефекти
Як і будь-який препарат, цей препарат може викликати побічні ефекти, хоча не в усіх вони виникнуть.
Якщо погіршиться будь-який з побічних ефектів або виникнуть будь-які побічні ефекти, не перераховані в цій інструкції, повідомте про це лікаря або фармацевта.
Наступні частоти були використані для оцінки побічних ефектів:
Часто: може стосуватися більше 1 з 10 осіб
Нечасто: може стосуватися до 1 з 10 осіб
Рідко: може стосуватися до 1 з 100 осіб
Дуже рідко: може стосуватися 1 з 1000 осіб
Невідомо: частота не може бути визначена на підставі доступних даних
У клінічних дослідженнях наступні побічні ефекти були зареєстровані як часті:
Гіперчутливість,
Головний біль,
Головокружіння,
Гіпотонія,
Висипка
Позитивний результат антитіл до поверхневого антигену вірусу гепатиту типу Б.
У дослідженнях, проведених після реєстрації препарату, наступні побічні ефекти були зареєстровані з частотою невідомою:
Порушення крові та імунної системи: поширений згортання крові в судинах (DIC); зростання титру інгібітора
Порушення імунної системи: алергічні реакції, свербляча висипка на шкірі (кропивниця)
Порушення нервової системи: відчуття оніміння кінцівок (анестезія), порушення або слабке відчуття (парестезія), інсульт (інсульт, емболія), сонливість, порушення смаку
Порушення серцево-судинної системи: інфаркт міокарда (інфаркт міокарда), палпітація серця (тахікардія)
Порушення судин:утворення тромбів, які переміщуються в судинах (тромботичні події), зростання артеріального тиску (гіпертонія), раптове почервоніння
Порушення дихальної системи, грудної клітки та середостіння: емболія легеневої артерії (легенева емболія), звуження дихальних шляхів (бронхоспазм), свистячий дихання, кашель, задихання
Порушення травної системи: блювота, діарея, дискомфорт у черевній порожнині, нудота
Порушення шкіри та підшкірної клітини: відчуття оніміння обличчя, набряк обличчя, язика та губ (ангіоневротичний набряк), свербляча висипка на шкірі (кропивниця), свербіння (свербіж)
Загальні порушення та порушення в місці введення: біль у місці введення, загальне погане самопочуття, відчуття жару, озноб, гарячка, біль у грудній клітці, дискомфорт у грудній клітці
Діагностичні дослідження:зниження артеріального тиску
Швидке внутрішньовенне введення може викликати колючий біль та оніміння обличчя та кінцівок, а також зниження артеріального тиску.
Інфаркти міокарда виникали після введення доз, які перевищують максимальну добову дозу, та (або) після тривалого застосування та (або) у разі наявності факторів ризику, які сприяють тромботичним ускладненням.
Звітність про побічні ефекти
Якщо виникнуть будь-які побічні ефекти, включаючи будь-які побічні ефекти, не перераховані в цій інструкції, повідомте про це лікаря або фармацевта. Побічні ефекти можна повідомляти безпосередньо до Департаменту моніторингу небажаних дій лікарських засобів Міністерства охорони здоров'я України
вул. Євгена Коновальця, 3
01601, м. Київ
Телефон: +38 (044) 279-16-16
Факс: +38 (044) 279-16-17
Електронна пошта: [[email protected]](mailto:[email protected])
Веб-сайт: https://dlr.gov.ua/
Побічні ефекти також можна повідомляти відповідальній особі.
Звітність про побічні ефекти дозволить зібрати більше інформації про безпеку використання препарату.
5. Як зберігати препарат FEIBA NF
Зберігайте в місці, недоступному для дітей.
Не зберігайте при температурі вище 25°C. Не заморожуйте.
Зберігайте препарат у оригінальній упаковці для захисту від світла.
Не слід застосовувати препарат FEIBA NF після закінчення терміну придатності, вказаного на упаковці.
Термін придатності вказується останнім днем місяця.
Лікарських препаратів не слід викидати у каналізацію чи домашні контейнери для відходів. Слід запитати у фармацевта, що робити з препаратами, яких вже не потрібно. Таке поводження допоможе захистити навколишнє середовище.
6. Зміст упаковки та інші відомості
Що містить FEIBA NF
Порошок
- Активною речовиною є фактор VIII з активністю, що оминає інгібітор. 1 флакон містить 500 од. фактору VIII з активністю, що оминає інгібітор, у 200-600 мг білка людської плазми крові.
- FEIBA NF також містить фактори II, IX та X переважно у вигляді неактивованих, а також активований фактор VII. Антиген коагуляційного фактору VIII (F VIII C:Ag) та фактори системи калікреїн-кінін присутні лише у слідових кількостях або взагалі відсутні.
- Інші складники препарату: хлорид натрію та цитрат натрію
Розчинник
- Вода для ін'єкцій
Як виглядає FEIBA NF та що містить упаковка
Препарат випускається у вигляді ліофілізованого порошку або тонкої твердої речовини білуватого або блакитнуватого кольору.
Порошок і розчинник поставляються у скляних флаконах, закритих гумовими пробками.
рН розчину після реконституції становить від 6,8 до 7,6.
Розмір упаковки: 1 набір
Зміст упаковки (з голками):
1 флакон з 500 од. FEIBA NF, закритий гумовою пробкою
1 флакон з 20 мл води для ін'єкцій, закритий гумовою пробкою
1 двостороння голка
1 голка з повітряним фільтром
1 одноразовий шприц
1 голка для ін'єкцій
1 голка з фільтром
1 голка-бабочка (інфузійний набір з голкою-бабочкою)
Зміст упаковки (з BAXJECT II Hi-Flow):
1 флакон з 500 од. FEIBA NF, закритий гумовою пробкою
1 флакон з 20 мл води для ін'єкцій, закритий гумовою пробкою
1 BAXJECT II Hi-Flow - безголковий переносний пристрій для перенесення до шприца та змішування лікарських засобів, які містяться у двох флаконах
1 одноразовий шприц
1 голка для ін'єкцій
1 голка-бабочка (інфузійний набір з голкою-бабочкою)
Відповідальна особа та виробник:
Відповідальна особа:
Takeda Pharma Sp. з о.о.
вул. Правда, 68
00-838 Варшава
Виробник:
Baxter AG, Industriestrasse 67, A-1220 Відень, Австрія
Takeda Manufacturing Austria AG, Industriestrasse 67, 1221 Відень, Австрія
Дата останньої актуалізації інструкції:
-----------------------------------------------------------------------------------------------------------------
Інформація, призначена лише для фахового медичного персоналу:
Лікування повинно бути розпочато та контролюватися лікарем, який має досвід лікування гемофілії.
Дозування
Дозування та тривалість лікування залежать від тяжкості порушення згортання крові, місця та ступеня кровотечі, а також від клінічного стану пацієнта.
Доза, а також частота введення повинні бути завжди спрямовані на клінічну ефективність у даному випадку.
Загалом рекомендується доза 50-100 од. FEIBA на кг маси тіла, однак не слід перевищувати одноразову дозу 100 од./кг маси тіла, а також максимальну добову дозу 200 од./кг маси тіла, якщо тільки тяжкість кровотечі не вимагає та не виправдовує використання більших доз.
З огляду на специфічні фактори, властиві даному пацієнту, відповідь на комплекс факторів з активністю, що оминає інгібітор фактору VIII, може бути різною, а у випадку кровотечі у пацієнта, у якого відповідь на один з факторів є недостатньою, слід розглянути можливість використання іншого фактору.
Діти та підлітки
Досвід застосування у дітей віком до 6 років обмежений; схема дозування така сама, як і для дорослих, слід коригувати з урахуванням клінічного стану дитини.
- 1)
Кровотечі самостійно
Кровотечі в суглоби, м'язи та м'які тканини
У разі малих або помірних кровотеч рекомендована доза 50-75 од./кг маси тіла у 12-годинних інтервалах. Лікування слід проводити до моменту досягнення явних ознак клінічної поліпшення, таких як зникнення болю, зменшення набряку або відновлення рухливості суглоба.
У разі великих кровотеч у м'язах та м'яких тканинах, таких як кровотечі в позаочеревну порожнину, рекомендована доза 100 од./кг маси тіла у 12-годинних інтервалах.
Кровотечі з слизових оболонок
Рекомендується доза 50 од./кг маси тіла кожні 6 годин з ретельним спостереженням за пацієнтом (спостереження за поверхнею кровотечі, повторні визначення гематокриту у пацієнта). Якщо кровотеча не зупиняється, дозу можна збільшити до 100 од./кг маси тіла. Не слід перевищувати максимальну добову дозу 200 од./кг маси тіла.
Інші важкі кровотечі
У важких кровотечах, таких як кровотеча в центральну нервову систему, рекомендована доза 100 од./кг маси тіла у 12-годинних інтервалах. У окремих випадках можна вводити FEIBA NF у 6-годинних інтервалах до моменту досягнення явної клінічної поліпшення. Не слід перевищувати максимальну добову дозу 200 од./кг маси тіла!
- 2)
Хірургічні операції
Вводити 50-100 од./кг маси тіла у 6-годинних інтервалах, звертаючи увагу на те, щоб не перевищувати максимальну добову дозу.
- 3)
Профілактика
- Лікування профілактики кровотеч у пацієнтів з високим титром інгібітора та частими кровотечами, у яких індукція стану імунологічної толерантності (ITI) не вдалася або не розглядається: Рекомендується доза 70-100 од./кг маси тіла кожні інші дні. Якщо кровотеча у пацієнта не зупиняється, дозу можна збільшити до 100 од./кг маси тіла, вводячи її щоденно, або поступово зменшувати.
- Лікування профілактики кровотеч у пацієнтів з високим титром інгібіторів під час індукції стану імунологічної толерантності (ITI): Препарат FEIBA NF можна вводити одночасно з концентратом фактору VIII у дозах 50-100 од./кг маси тіла двічі на добу, поки титр інгібітора фактору VIII не знизиться до <2 БЮ.*< li>
Моніторинг
З огляду на складний механізм дії, немає доступного способу безпосереднього моніторингу активних речовин. Дослідження системи згортання крові, такі як час згортання крові (WBCT), тромбоеластограма (TEG, r-індекс) та аПТТ, зазвичай показують незначні зміни та можуть не відображати клінічну поліпшення. З цього приводу ці дослідження мають дуже обмежену цінність у моніторингу лікування препаратом FEIBA NF.
Спосіб введення
Препарат FEIBA NF слід вводити повільно внутрішньовенно (не швидше 2 од./кг маси тіла на хвилину).
FEIBA NF слід підготувати безпосередньо перед введенням.
Розчин слід використовувати негайно (препарат не містить консервантів).
Не слід застосовувати розчин, який є мутним або містить осад.
Невикористані залишки розчину слід видалити у відповідності з обіговією.
Моніторинг лікування
Не слід перевищувати одноразові дози, які становлять 100 од./кг маси тіла, а також добову дозу 200 од./кг маси тіла. Пацієнтів, які отримують більше 100 од./кг маси тіла, слід спостерігати щодо виникнення DIC та (або) гострої коронарної хвороби. Великі дози FEIBA NF слід вводити лише протягом часу, необхідного для зупинки кровотечі.
У разі виникнення значних змін артеріального тиску, частоти серцевих скорочень, порушень дихання, кашлю або болю у грудній клітці слід негайно припинити введення препарату та провести відповідні діагностичні та терапевтичні заходи.
Результати лабораторних досліджень, які вказують на DIC, включають зниження вмісту фібриногену, зниження кількості тромбоцитів та наявність продуктів деградації фібрину/фібриногену (FDP).
Дальші ознаки виникнення DIC включають значне подовження часу тромбіна, протромбіна або аПТТ. У пацієнтів, які страждають на гемофілію, ускладнену наявністю інгібітора, або у пацієнтів з набутими інгібіторами факторів VIII, IX, X і XI, аПТТ може бути подовжено у зв'язку з самим порушенням згортання крові.
Введення препарату FEIBA NF пацієнтам з інгібіторами може привести до початкового анамнестичного зростання рівня інгібітора. Під впливом подальшого введення FEIBA NF рівень інгібітора може зменшуватися з часом. Клінічні дані та література свідчать про те, що ефективність FEIBA NF не зменшується.
Під час введення FEIBA NF у пацієнтів, які страждають на гемофілію, ускладнену наявністю інгібітора, або у пацієнтів з набутими інгібіторами факторів згортання крові, може виникнути одночасно схильність до кровотеч та підвищений ризик тромбозу.
Лабораторні дослідження та клінічна ефективність
Результати лабораторних досліджень in vitro для оцінки ефективності лікування, такі як аПТТ, час згортання крові та тромбоеластограма (TEG), можуть не відображати клінічну поліпшення. З цього приводу спроби відновлення нормальних значень цих параметрів шляхом збільшення доз FEIBA NF можуть бути невірними та слід їх уникати через можливість виникнення DIC, викликаного передозуванням.
Значення кількості тромбоцитів
У разі недостатньої відповіді на лікування препаратом FEIBA NF рекомендується визначення кількості тромбоцитів, оскільки достатня кількість функціонально активних тромбоцитів необхідна для ефективності препарату FEIBA NF.
Додаткові відомості щодо пристрою Baxject II Hi-Flow:
- Пристрій піддається стерилізації гамма-опроміненням.
- Призначений лише для одноразового використання.
- Не містить латексу.

Не слід застосовувати у разі пошкодження упаковки.
BAXJECT і FEIBA є зареєстрованими торговими марками Baxalta Incorporated.
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- Виробник
- ІмпортерTakeda Manufacturing Austria AG
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Феіба НфФорма випуску: Порошок, 1000 МО (1000 МО FEIBA), 50 МО/млДіючі речовини: factor VIII inhibitor bypassing activityВиробник: Takeda Manufacturing Austria AGПотрібен рецептФорма випуску: Порошок, 500 МО (500 МО FEIBA), 50 МО/млДіючі речовини: factor VIII inhibitor bypassing activityВиробник: Takeda Manufacturing Austria AGПотрібен рецептФорма випуску: Порошок, 2500 МО (2500 МО FEIBA), 50 МО/млДіючі речовини: factor VIII inhibitor bypassing activityВиробник: Takeda Manufacturing Austria AGПотрібен рецепт
Аналоги Феіба Нф в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Феіба Нф у Іспанія
Лікарі онлайн щодо Феіба Нф
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Феіба Нф – за рішенням лікаря та згідно з місцевими правилами.














