

Феіба Нф

Запитайте лікаря про рецепт на Феіба Нф

Інструкція із застосування Феіба Нф
Упаковка інструкції: інформація для користувача
FEIBA NF, 2500 од. (50 од./мл), порошок і розчинник для приготування розчину для
в/в введення
Комплекс факторів згортання крові проти інгібітора фактора VIII
Перш ніж використовувати препарат, уважно ознайомтеся з вмістом інструкції, оскільки вона містить важливу інформацію для пацієнта.
- Збережіть цю інструкцію, щоб у разі необхідності знову її прочитати.
- У разі будь-яких сумнівів зверніться до лікаря, фармацевта або медсестри.
- Цей препарат призначений для конкретної особи. Не передавайте його іншим. Препарат може нашкодити іншій особі, навіть якщо симптоми її хвороби такі самі.
- Якщо в пацієнта з'являються будь-які побічні ефекти, включаючи будь-які побічні ефекти, не перелічені в цій інструкції, повідомте про це лікаря, фармацевта або медсестру. Див. пункт 4.
Зміст інструкції
- 1. Що таке препарат FEIBA NF і для чого він використовується
- 2. Важлива інформація перед використанням препарату FEIBA NF
- 3. Як використовувати препарат FEIBA NF
- 4. Можливі побічні ефекти
- 5. Як зберігати препарат FEIBA NF
- 6. Зміст упаковки і інші відомості
1. Що таке препарат FEIBA NF і для чого він використовується
FEIBA NF - це препарат, отриманий з людської плазми, який дозволяє згортанню крові
у разі дефіциту або відсутності деяких факторів згортання.
Препарат FEIBA NF використовується для лікування кровотеч і профілактики кровотеч у пацієнтів
з гемофілією А, ускладненою наявністю інгібітора фактора VIII, і з гемофілією Б, ускладненою наявністю
інгібітора фактора IX.
Крім того, препарат FEIBA NF може бути використаний для лікування і профілактики кровотеч у осіб
не хворих на гемофілію, але які мають набуті інгібітори факторів VIII, IX і XI.
Препарат FEIBA NF також використовується в поєднанні з концентратом фактора VIII під час
тривалого лікування, спрямованого на повну і тривалу елімінацію інгібіторів фактора VIII, щоб
umożliнити регулярне лікування концентратом фактора VIII, як у пацієнтів без інгібіторів.
У окремих випадках препарат FEIBA NF був використаний у пацієнтів з інгібітором фактора
вон Віллебранда.
2. Важлива інформація перед використанням препарату FEIBA NF
Повідомте лікаря, якщо у пацієнта є будь-яка алергія.
Повідомте лікаря, якщо пацієнт дотримується низькосодової дієти.
Коли не використовувати препарат FEIBA NF
У наступних ситуаціях не слід використовувати препарат FEIBA NF, якщо є можливість
використання іншого лікування:
- якщо пацієнт має підвищену чутливість до комплексу факторів згортання крові проти інгібітора фактора VIII або будь-якого іншого компонента цього препарату (перелічених у пункті 6).
- якщо у пацієнта є розсіяне внутрішньосудинне згортання крові (DIC, коагулопатія з витрачанням, стан, який загрожує життю, пов'язаний з масивним згортанням крові з утворенням кров'яних згустків у судинах. Це призводить до загального витрачання факторів згортання).
- якщо пацієнт має гостру тромбоз або емболію (у тому числі інфаркт міокарда).
Див. пункт «Попередження та застереження».
Попередження та застереження
Перш ніж почати приймати препарат FEIBA NF, обговоріть це з лікарем.
Цей препарат може спричинити появу реакцій підвищеної чутливості типу алергічної, які
включають кропив'янку, ангіоневротичний набряк, симптоми з боку травної системи, бронхоспазм і гіпотонію; ці реакції можуть бути важкими і системними (наприклад, анафілактична реакція
з кропив'янкою і ангіоневротичним набряком, бронхоспазм і шок). Згідно повідомлень, також були інші реакції, пов'язані з інфузією, такі як озноби, гарячка і гіпертонія.
У разі появи перших ознак або симптомів, пов'язаних з інфузією / реакцією підвищеної чутливості (див. пункт 4), слід припинити введення цього препарату і розпочати відповідний медичний догляд.
У разі пацієнтів з підозрою на підвищену чутливість до препарату або будь-якого з його компонентів,
лікар вирішить про повторне введення препарату FEIBA NF тільки після ретельного розгляду ризику
і очікуваних вигод і (або) коли не можна очікувати результатів лікування за допомогою іншої
терапії профілактики або альтернативних засобів лікування.
Під час лікування препаратом FEIBA NF спостерігалися порушення згортання крові, включаючи розсіяне внутрішньосудинне згортання крові (DIC), венозний тромбоз, пульмональна емболія, інфаркт міокарда
і інсульт.
У разі появи перших ознак або симптомів порушень згортання крові (див. пункт 4) слід негайно припинити інфузію і розпочати відповідне діагностичне та терапевтичне лікування.
Деякі порушення згортання крові спостерігалися при застосуванні великих доз препарату FEIBA NF або у пацієнтів з іншими факторами ризику, які сприяють порушенням згортання крові, включаючи DIC, прогресивну атеросклероз, травматичну травму
або сепсис. Одночасне застосування рекомбінантного фактора VIIа може збільшувати ризик виникнення порушень згортання крові. У пацієнтів з вродженою або набутою гемофілією завжди слід враховувати можливість появи таких факторів ризику.
Препарат слід застосовувати з особливою обережністю у пацієнтів з ризиком DIC, артеріальної або венозної тромбози.
Випадки мікроангіопатичної тромбози були зареєстровані в клінічному дослідженні емісізумабу, в якому
пацієнти отримували препарат FEIBA NF як частина схеми лікування кровотечі.
У пацієнтів з гемофілією та наявністю інгібітора або набутими інгібіторами факторів згортання крові,
під час лікування препаратом FEIBA NF може спостерігатися підвищена схильність до кровотеч
і одночасно підвищений ризик тромбозу.
У наступних ситуаціях застосування FEIBA NF допускається лише тоді, коли очікується відсутність реакції на лікування відповідним концентратом фактора згортання крові, наприклад, у разі наявності високого титру інгібітора та загрозливої кровотечі або ризику кровотечі
(наприклад, після травми або операції):
- Розсіяне внутрішньосудинне згортання крові (DIC).
- Ушкодження печінки: через повільне видалення активних факторів згортання крові у пацієнтів з порушеною функцією печінки спостерігається підвищений ризик DIC.
- Хвороба коронарних артерій, гостра тромбоз і (або) емболія. Див. пункт «Коли не використовувати препарат FEIBA NF».
У разі препаратів, виготовлених з людської крові або плазми, приймаються певні заходи з профілактики інфекцій, які передаються пацієнтам. До цих заходів належить ретельний відбір донорів крові та плазми, щоб переконатися, що ті, хто належить до групи ризику передачі інфекцій, виключаються, а також перевірка окремих проб наданої крові та пулів зібраної плазми на наявність вірусів/інфекцій. Виробники цих продуктів під час обробки крові та плазми включають етапи, спрямовані на інактивацію або видалення вірусів. Незважаючи на такі заходи, при введенні препаратів, виготовлених з людської крові або плазми, не можна повністю виключити можливість передачі інфекції. Це стосується також невідомих або недавно виявлених вірусів або інших типів інфекцій.
Прийняті заходи вважаються ефективними щодо вірусів з оболонкою, таких як вірус ВІЛ (що викликає СНІД), вірус гепатиту Б і вірус гепатиту С, а також безоболонкового вірусу гепатиту А. Прийняті заходи можуть мати обмежену цінність щодо безоболонкових вірусів, таких як парвовірус В19. Інфекція парвовірусом В19 може бути серйозною у жінок під час вагітності (інфекція плода) та у осіб з імунодефіцитом або підвищеною еритропоезом (наприклад, гемолітична анемія).
У пацієнтів, які регулярно або багаторазово отримують фактор VIII, отриманий з людської плазми, слід розглянути можливість застосування відповідних вакцин (проти вірусного гепатиту А і Б).
Після введення великих доз препарату FEIBA NF може спостерігатися тимчасове підвищення пасивно переданих антитіл до поверхневого антигену вірусу гепатиту Б, що може призвести до хибно позитивних результатів серологічних тестів.
Препарат містить ізогемаглютинини, антитіла до червоних кров'яних клітин, які пасивно передані можуть впливати на результати серологічних тестів на наявність антитіл до червоних кров'яних клітин, таких як тест антиглобулінного фактору (тест Кумбса).
Під час кожного введення препарату FEIBA NF пацієнту слід чітко записати назву
і номер серії препарату для збереження інформації про використані серії.
FEIBA NF і інші препарати
Повідомте лікаря про всі препарати, які ви зараз приймаєте або приймали нещодавно, навіть ті, що доступні без рецепта.
Не проводилися відповідні та добре контрольовані дослідження щодо комбінованого або послідовного застосування FEIBA NF та рекомбінантного фактора VIIа, препаратів, що гальмують фібриноліз, або емісізумабу (див. «Попередження та застереження»).
Слід розглянути можливість появи інцидентів згортання крові при одночасному застосуванні системних препаратів, що гальмують фібриноліз, таких як кислота транексамова та амінокапронова кислота, у поєднанні з FEIBA NF. Тому препарати, що гальмують фібриноліз, не повинні застосовуватися протягом приблизно 6-12 годин після введення FEIBA NF.
Відносно доступних даних досліджень in vitroта клінічних спостережень, у разі одночасного застосування рекомбінантного фактора VIIа не можна виключити можливість потенційної взаємодії препаратів, яка може призвести до інциденту згортання крові.
Якщо лікування препаратом FEIBA NF розглядається після того, як пацієнт приймав емісізумаб, пацієнт повинен бути під суворим наглядом лікаря.
Як і у разі всіх препаратів факторів згортання крові, не слід змішувати препарат FEIBA NF з іншими препаратами перед введенням; це може негативно вплинути на ефективність та безпеку препарату.
Рекомендується, щоб перед і після введення препарату FEIBA NF в/в шлях промивався ізотонічним розчином натрію хлору.
Вагітність, годування грудьми та вплив на фертильність
Лікар вирішить, чи можна застосовувати FEIBA NF під час вагітності або годування грудьми. У зв'язку з підвищеним ризиком тромбозу під час вагітності препарат FEIBA NF повинен застосовуватися лише під суворим медичним наглядом і лише тоді, коли це явно показано.
Відносно ризику інфекції парвовірусом В19 див. «Попередження та застереження».
Вплив на здатність керувати транспортними засобами та працювати з механізмами
Не спостерігалося жодного впливу на здатність керувати транспортними засобами та працювати з механізмами.
FEIBA NF містить натрій
Препарат містить 200 мг натрію (основного компонента кухонної солі) в кожній флаконі. Це відповідає 10% максимальної рекомендованої добової дози натрію в дієті для дорослих.
3. Як застосовувати препарат FEIBA NF
Ліофілізований порошок FEIBA NF розчиняється у доданому розчиннику та вводиться в/в.
Цей препарат слід завжди застосовувати згідно з рекомендаціями лікаря. У разі сумнівів зверніться до лікаря або фармацевта.
Лікування слід розпочинати та проводити під наглядом лікаря, який має досвід лікування порушень згортання крові.
Лікар визначає відповідну дозу та частоту введення індивідуально для кожного пацієнта, враховуючи тяжкість порушення згортання крові, місце та ступінь кровотечі, а також загальний стан пацієнта та його реакцію на препарат. Не слід самостійно змінювати дозування препарату, встановлене лікарем, або припиняти його введення.
Якщо пацієнт відчуває, що препарат діє надто сильно або надто слабко, слід зв'язатися з лікарем або фармацевтом.
Перед введенням препарат слід нагріти до кімнатної температури або температури тіла, якщо це необхідно.
Препарат FEIBA NF слід підготувати лише безпосередньо перед введенням.
Приготовлений розчин слід використовувати негайно (препарат не містить консервантів).
Негайно змішайте рухом обертання до повного розчинення порошку. Слід переконатися, що препарат FEIBA NF повністю розчинився, в іншому випадку через фільтр апарату пройде менше одиниць FEIBA.
Не слід застосовувати розчин, який є мутним або містить осад. Не використовувати розчин з раніше відкритих флаконів.
Слід застосовувати лише доданий розчинник (стерильну воду для в/в введення) та комплект для приготування розчину.
Якщо застосовується інший комплект для приготування та введення, ніж той, який доданий до упаковки FEIBA NF, слід переконатися, що використовується відповідний фільтр з розміром порів не менше 149 мкм.
Не слід застосовувати, якщо безігловий пристрій для перенесення, система підтримання його стерильності або упаковка препарату пошкоджені або псуються.
Слід записати введення препарату на доданій самоклейкій етикетці.
Всі невикористані залишки препарату або його відходи слід видалити згідно з місцевими правилами.
Приготування розчину для в/в введення
Слід дотримуватися правил асептики протягом усієї процедури.
- 1. Допровідте флакон з розчинником (стерильною водою для в/в введення) до кімнатної температури, якщо це необхідно, наприклад, використовуючи для нагрівання водяну баню протягом декількох хвилин (макс. 37°C).
- 2. Видаліть захисні ковпачки з флаконів з порошком і розчинником та дезінфікуйте гумовими пробками обидва флакони. Помістіть флакони на пласку поверхню.
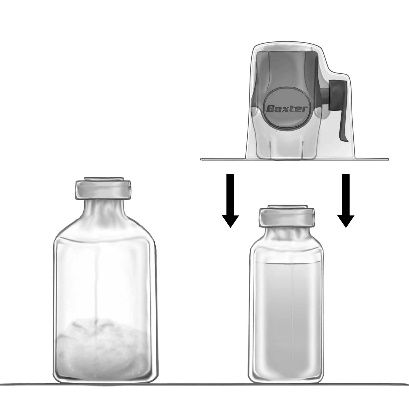
- 3. Відкрийте упаковку пристрою BAXJECT II Hi-Flow, відірвавши паперовий ковпачок, не торкаючись внутрішньої частини (Рис. а). Не виймайте пристрій з упаковки.
- 4. Переверніть упаковку догори дном та проколіть прозорий пластиковий наконечник через пробку флакона з розчинником (Рис. б). Тримаючи упаковку за краю, зніміть її з пристрою BAXJECT II Hi-Flow (Рис. в). Не видаліть синюю пробку з пристрою BAXJECT II Hi-Flow.
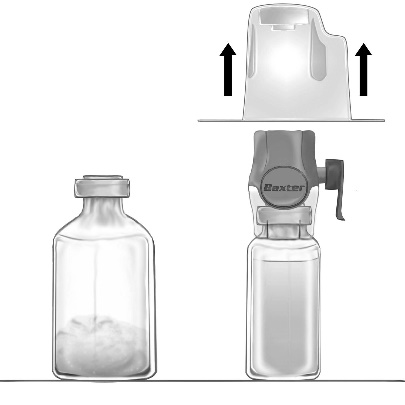
- 5. Пристрій BAXJECT II Hi-Flow, з'єднаний з флаконом з розчинником, переверніть так, щоб флакон з розчинником знаходився над пристроєм. Проколіть фіолетовий пластиковий наконечник через пробку флакона з порошком FEIBA NF. Під дією вакууму розчинник буде втягуватися до флакона з порошком FEIBA NF (Рис. г).
- 6. Мішайте повільно, рухом обертання, але без встрясання, до повного розчинення продукту. Слід переконатися, що FEIBA NF повністю розчинився – в іншому випадку речовина не пройде через фільтр пристрою.
Рис. а
Рис. б
Рис. в

В/в введення/інфузія
Слід дотримуватися правил асептики протягом усієї процедури
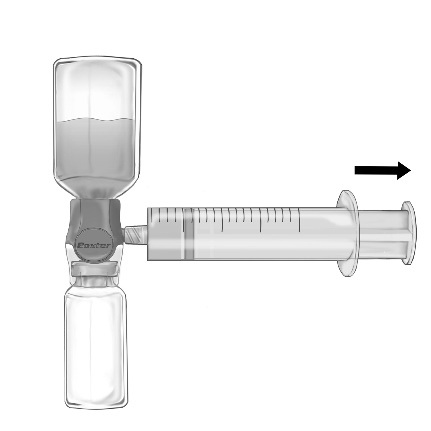
- 1. Видаліть синюю пробку з пристрою BAXJECT II Hi-Flow. Тісно з'єднайте шприц з пристроєм BAXJECT II Hi-Flow (НЕ НАБИРАЙТЕ ПОВІТРЯ ДО ШПРИЦА) Для забезпечення герметичного з'єднання між шприцем та пристроєм BAXJECT II Hi-Flow особливо рекомендується використовувати шприц з кінцем типу луер (закручуючи шприц, слід повернути його за годинниковою стрілкою до моменту зупинки) (Рис. д).
- 2. Переверніть комплект так, щоб розчин знаходився зверху. Повільно потягніть поршень назад та переконайтеся, що з'єднання між шприцем та пристроєм BAXJECT II Hi-Flow є герметичним, а шприц утримується протягом усього часу набору розчину (Рис. е).
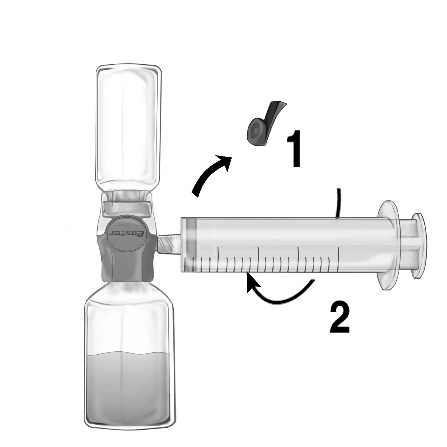
- 3. Від'єднайте шприц.
- 4. Якщо в шприці з'явився пінний розчин, слід зачекати до моменту зникнення піни. Розчин слід повільно вводити в/в, використовуючи інфузійний комплект (або голку для в/в введення одноразового використання). Для контролю швидкості введення можна використовувати шприц-інфузійну помпу.
Рис. г
Рис. д
Рис. е

Не слід перевищувати швидкість 2 одиниць FEIBA на кг маси тіла на хвилину.
Прийом більшої, ніж рекомендована, дози препарату FEIBA NF
Слід негайно повідомити лікаря. Передозування FEIBA NF може збільшити ризик
побічних ефектів, таких як стани згортання крові (утворення кров'яних згустків, які переміщаються в судинах), коагулопатія «з витрачанням» (порушення згортання крові DIC) або інфаркт міокарда.
4. Можливі побічні ефекти
Як і будь-який препарат, цей препарат може спричиняти побічні ефекти, хоча не в усіх вони виникнуть.
Слід негайно звернутися до лікаряу разі появи одного або декількох з наступних симптомів:
- реакції підвищеної чутливості: висип, свербіжний висип (кропив'янка), свербіння, набряк губ і язика, свистячий дихання, відчуття тиску в грудній клітці, симптоми з боку травної системи, головокружіння, раптове падіння артеріального тиску, озноби, гарячка, гіпертонія, кома
- розсіяне внутрішньосудинне згортання крові (DIC): самопідтримуючі синяки, кровотечі, сильне, одночасне кровотеча (наприклад, з ран, місць після уколів, слизових оболонок, родових шляхів), ниркова недостатність, спричинена їхньою ішемією (наприклад, безмоч або олігурія; легенева недостатність - задишка, кашель, кровохаркання; церебральна недостатність - порушення орієнтації та проблеми з концентрацією, судоми, порушення свідомості, кома)
- венозний тромбоз: біль і набряк кінцівки, зазвичай односторонній, підвищення температури кінцівки, стан підгострого або гарячки
- пульмональна емболія: істотна зміна артеріального тиску або частоти серцевих скорочень, труднощі з диханням, кашель або біль у грудній клітці
- інфаркт міокарда: біль у грудній клітці, який може променіювати до лівого плеча або руки, до підборіддя, епігастрію або спини; задишка, тахікардія, головокружіння, оmdlіння, слабкість, тривога, страх
- інсульт: раптовий, сильний головний біль, порушення зору, одностороннє опущення кута губ, труднощі з ковтанням і мовленням, порушення координації рухів і рівноваги, сонливість, дезорієнтація, втата свідомості
Часті побічні ефекти (можуть спостерігатися у до 1 з 10 осіб):
- Повышена чутливість
- Головний біль, головокружіння
- Гіпотонія
- Висип
- Позитивний результат антитіл до поверхневого антигену вірусу гепатиту Б, підвищення рівня Д-димерів фібрину
Побічні ефекти з невідомою частотою (не можна визначити на основі доступних даних):
- Розсіяне внутрішньосудинне згортання крові (DIC), підвищення титру інгібітора
- Анафілактична реакція (швидко розвивається і загрожує життю реакція підвищеної чутливості), свербіжний висип шкіри на всьому тілі (кропив'янка)
- Чувство оніміння кінцівок (гіпестезія), неправильне або слабке відчуття (парестезії), інсульт (ішемічний інсульт, емболічний інсульт), сонливість, порушення смаку
- Інфаркт міокарда (інфаркт міокарда),tachykardія (тахікардія)
- Утворення тромбів (венозний тромбоз, артеріальний тромбоз), які переміщаються в судинах (закріплення згортання крові), підвищення артеріального тиску (гіпертонія), раптове червоніння
- Пульмональна емболія (пульмональна емболія), звуження дихальних шляхів (бронхоспазм), свистячий дихання, кашель, задишка
- Вомітування, діарея, дискомфорт у черевній порожнині, нудота
- Чувство оніміння обличчя, набряк обличчя, язика і губ (ангіоневротичний набряк), свербіжний висип на всьому тілі (кропив'янка), свербіння (свербіж)
- Біль у місці введення, загальне погане самопочуття, відчуття жару, озноби, гарячка, біль у грудній клітці, дискомфорт у грудній клітці
- Спадіння артеріального тиску
Симптоми реакції підвищеної чутливості після введення препаратів, отриманих з людської плазми, включають також кому та тривогу.
Звітність про побічні ефекти
Якщо виникнуть будь-які побічні ефекти, включаючи будь-які побічні ефекти, не перелічені в цій інструкції, повідомте про це лікаря, фармацевта або медсестру. Побічні ефекти можна повідомляти безпосередньо до Департаменту моніторингу побічних ефектів лікарських засобів Державної служби лікарських засобів України
вул. Хмельницького, 55
01001 м. Київ
Тел.: +38 (044) 279-16-16
Факс: +38 (044) 279-16-16
Адреса електронної пошти: [[email protected]](mailto:[email protected])
Веб-сайт: http://www.dszu.gov.ua
Побічні ефекти також можна повідомляти відповідальному суб'єкту.
Звітність про побічні ефекти дозволить зібрати більше інформації про безпеку застосування препарату.
5. Як зберігати препарат FEIBA NF
Препарат слід зберігати в місці, недоступному для дітей.
Не зберігайте при температурі вище 25°C. Не заморожуйте.
Зберігайте препарат у зовнішній упаковці для захисту від світла.
Не застосовуйте цей препарат після закінчення терміну придатності, вказаного на упаковці.
Термін придатності вказується останнім днем вказаного місяця.
Лікарських засобів не слід викидати до каналізації чи домашніх контейнерів для відходів. Слід запитати фармацевта, як видалити лікарські засоби, які вже не використовуються. Таке поводження допоможе захистити навколишнє середовище.
6. Зміст упаковки і інші відомості
Що містить FEIBA NF
Порошок
- Активною речовиною є комплекс факторів згортання крові проти інгібітора фактора VIII. Після реконституції у 50 мл доданого до упаковки розчинника (вода для в/в введення) 1 мл містить приблизно 50 одиниць комплексу факторів згортання крові проти інгібітора фактора VIII. 1 флакон містить 2500 одиниць фактора VIII з активністю, що оминає інгібітор, у 1000-3000 мг білка людської плазми.
- FEIBA NF також містить фактори II, IX та X переважно у вигляді неактивованих, а також активований фактор VII. Антиген коагуляційного фактора VIII (F VIII C:Ag) присутній у концентрації до 0,1 одиниці на 1 одиницю FEIBA. Фактори системи калікреїн-кінін присутні лише у слідових кількостях або взагалі не присутні.
- Інші складові частини препарату: хлорид натрію та цитрат натрію.
Розчинник
- Вода для в/в введення
Як виглядає FEIBA NF і що містить упаковка
Препарат випускається у вигляді ліофілізованого порошку або тонкої твердої речовини білого або блакитно-зеленого кольору.
Порошок і розчинник поставляються у скляних флаконах, закритих гумовими пробками.
рН розчину після реконституції становить між 6,8 і 7,6.
Розмір упаковки: 1 комплект
Зміст упаковки:
1 флакон з 2500 одиниць FEIBA NF, закритий гумовою пробкою
1 флакон з 50 мл води для в/в введення, закритий гумовою пробкою
1 BAXJECT II Hi-Flow - безігловий пристрій для перенесення, призначений для перенесення до шприца
і змішування лікарських засобів, що містяться у двох флаконах
1 шприц одноразового використання
1 голка для в/в введення
1 голка-бабочка (інфузійний комплект з голкою-бабочкою)
Відповідальний суб'єкт і виробник
Відповідальний суб'єкт:
Takeda Pharma Sp. z o.o.
вул. Правда, 68
00-838 Варшава
Тел: +48 22 306 24 47
[email protected]
Виробник:
Takeda Manufacturing Austria AG
Промислова вулиця, 67
1221 Відень, Австрія
Дата останньої актуалізації інструкції:
-----------------------------------------------------------------------------------------------------------------
Інформація, призначена лише для фахового медичного персоналу:
Лікування слід розпочинати та проводити під наглядом лікаря, який має досвід лікування гемофілії.
Дозування
Дозування та тривалість лікування залежать від тяжкості порушення згортання крові, місця
і ступеня кровотечі, а також від стану пацієнта.
Доза, а також частота введення повинні бути завжди спрямовані на клінічну ефективність
у кожному конкретному випадку.
Загалом рекомендується доза 50-100 одиниць FEIBA на кг маси тіла (мц.), однак не слід перевищувати одноразову дозу 100 одиниць/кг мц., ані максимальну добову дозу 200 одиниць/кг мц., якщо тільки тяжкість кровотечі не вимагає та не виправдовує використання більших доз.
У зв'язку з факторами, специфічними для конкретного пацієнта, реакція на комплекс факторів з активністю, що оминає інгібітор фактора VIII, може бути різною, а у разі певної кровотечі у пацієнта, у якого реакція на один з факторів є недостатньою, слід розглянути можливість використання іншого фактора.
Діти та підлітки
Досвід застосування у дітей віком до 6 років обмежений; схема дозування, така ж, як для дорослих, повинна бути адаптована до стану дитини.
- 1)
Кровотечі
Кровотечі у суглоби, м'язи та м'які тканини
У разі малих або середніх кровотеч рекомендована доза 50-75 одиниць/кг мц.
з інтервалом 12 годин. Лікування слід проводити до моменту появи явних клінічних ознак
поліпшення, таких як зникнення болю, зменшення набряку або відновлення рухливості суглоба.
У разі великих кровотеч у м'язи та м'які тканини, таких як кровотечі у черевну порожнину, рекомендовані дози 100 одиниць/кг мц. з інтервалом 12 годин.
Кровотечі з слизових оболонок
Рекомендується доза 50 одиниць/кг мц. кожні 6 годин з одночасним ретельним спостереженням за пацієнтом (спостереження за поверхнею кровотечі, повторні визначення гематокриту у пацієнта). Якщо кровотеча не зупиняється, дозу можна збільшити до 100 одиниць/кг мц. Не слід перевищувати максимальну добову дозу 200 одиниць/кг мц.
Інші важкі кровотечі
У важких кровотечах, таких як кровотеча у центральну нервову систему, рекомендована доза 100 одиниць/кг мц. з інтервалом 12 годин. У окремих випадках можна вводити FEIBA NF з інтервалом 6 годин до моменту появи явних клінічних ознак поліпшення. Не слід перевищувати максимальну добову дозу 200 одиниць/кг мц.!
- 2)
Хірургічні операції
Вводити 50-100 одиниць/кг мц. з інтервалом 6 годин, звертаючи увагу на те, щоб не перевищувати максимальну добову дозу.
- 3)
Профілактика
Існують обмежені клінічні дані щодо застосування FEIBA NF для профілактики кровотеч у пацієнтів з гемофілією.
- Профілактичне лікування кровотеч у пацієнтів з високим титром інгібітора та частими кровотечами, у яких індукція стану імунологічної толерантності (ITI) не вдалася або не розглядається: Рекомендується доза 70-100 одиниць/кг мц. кожні інші дні. Якщо кровотеча у пацієнта не зупиняється, дозу можна збільшити до 100 одиниць/кг мц., введених щоденно, або поступово її зменшувати.
- Профілактичне лікування кровотеч у пацієнтів з високим титром інгібіторів під час індукції стану імунологічної толерантності (ITI): Препарат FEIBA NF можна вводити одночасно з концентратами фактора VIII у дозах 50-100 одиниць/кг мц. двічі на добу, до моменту зниження титру інгібітора фактора VIII до <2 Б.*< li>
*1 одиниця Бетесди визначається як кількість антитіла, яке знижує на 50% активність фактора VIII
у свіжій нормальній людській плазмі після 2 годин інкубації при 37°C.
Спосіб введення
Див. також пункт «FEIBA NF і інші препарати» та пункт 3 інструкції.
Препарат FEIBA NF слід вводити повільно в/в (не швидше ніж 2 одиниці/кг мц. на хвилину).
FEIBA NF слід підготувати лише безпосередньо перед введенням.
Розчин слід використовувати негайно (не містить консервантів).
Не слід застосовувати розчин, який є мутним або містить осад.
Не слід застосовувати, якщо безігловий пристрій для перенесення, система підтримання його стерильності або упаковка препарату пошкоджені або псуються.
Невикористані залишки розчину слід видалити згідно з прийнятою процедурою.
Моніторинг лікування
У зв'язку з складним механізмом дії не існує жодного способу безпосереднього моніторингу активних речовин.
Результати лабораторних досліджень in vitroдля оцінки ефективності лікування, такі як аПТТ, час згортання крові та тромбоеластограма (TEG), можуть не відображати клінічне поліпшення. Через це спроби відновлення нормальних значень цих параметрів шляхом збільшення доз FEIBA NF можуть бути невірними і слід їх уникати через можливість появи DIC, спричиненого передозуванням.
У разі недостатньої реакції на лікування препаратом FEIBA NF рекомендується визначення кількості тромбоцитів, оскільки достатня кількість функціонально активних тромбоцитів необхідна для ефективності препарату FEIBA NF.
Не слід перевищувати одноразові дози у 100 одиниць/кг мц. та добову дозу 200 одиниць/кг мц. Пацієнти, які отримують більше ніж 100 одиниць/кг мц., повинні бути під наглядом щодо появи DIC та (або) гострої коронарної хвороби. Великі дози FEIBA NF слід вводити лише протягом часу, необхідного для зупинки кровотечі.
У разі появи істотних змін артеріального тиску, частоти серцевих скорочень, порушень дихання,
болю у грудній клітці та кашлю слід негайно припинити введення препарату та застосувати відповідне діагностичне та терапевтичне лікування.
Результатами лабораторних досліджень, які свідчать про DIC, є: зниження вмісту фібриногену, зниження кількості тромбоцитів та наявність продуктів розпаду фібрину/фібриногену (FDP).
Введення препарату FEIBA NF пацієнтам з інгібіторами може спричинити спочатку анамнестичний
підвищення рівня інгібітора. Під впливом подальшого введення FEIBA NF рівень інгібітора може знижуватися з часом. Клінічні дані та літературні дані свідчать про те, що ефективність FEIBA NF не знижується.
Під час введення FEIBA NF у пацієнтів, які страждають на гемофілію, ускладнену наявністю інгібітора або набутими інгібіторами факторів згортання крові, може спостерігатися одночасно схильність до кровотеч та підвищений ризик тромбозу.
Див. також пункт «Попередження та застереження».
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- Виробник
- ІмпортерTakeda Manufacturing Austria AG
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Феіба НфФорма випуску: Порошок, 500 МО = 500 МО FEIBAДіючі речовини: factor VIII inhibitor bypassing activityВиробник: Takeda Manufacturing Austria AGПотрібен рецептФорма випуску: Порошок, 1000 МО (1000 МО FEIBA), 50 МО/млДіючі речовини: factor VIII inhibitor bypassing activityВиробник: Takeda Manufacturing Austria AGПотрібен рецептФорма випуску: Порошок, 500 МО (500 МО FEIBA), 50 МО/млДіючі речовини: factor VIII inhibitor bypassing activityВиробник: Takeda Manufacturing Austria AGПотрібен рецепт
Аналоги Феіба Нф в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Феіба Нф у Іспанія
Лікарі онлайн щодо Феіба Нф
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Феіба Нф – за рішенням лікаря та згідно з місцевими правилами.














