

Смофкабивен екстра Нитроген Еф

Спросите врача о рецепте на Смофкабивен екстра Нитроген Еф

Инструкция по применению Смофкабивен екстра Нитроген Еф
Инструкция, прилагаемая к упаковке: информация для пользователя
SmofKabiven extra Nitrogen EF, эмульсия для инфузии
Прежде чем использовать лекарство, необходимо внимательно ознакомиться с содержанием инструкции, поскольку она содержит
важную информацию для пациента.
- Необходимо сохранить эту инструкцию, чтобы в случае необходимости можно было ее повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу, фармацевту или медсестре.
- Если у пациента出现 любые нежелательные реакции, включая любые нежелательные реакции, не указанные в этой инструкции, необходимо сообщить об этом врачу, фармацевту или медсестре. См. пункт 4.
Содержание инструкции
- 1. Что такое SmofKabiven extra Nitrogen EF и для чего он используется
- 2. Важные сведения перед использованием SmofKabiven extra Nitrogen EF
- 3. Как использовать SmofKabiven extra Nitrogen EF
- 4. Возможные нежелательные реакции
- 5. Как хранить SmofKabiven extra Nitrogen EF
- 6. Содержание упаковки и другие сведения
1. Что такое SmofKabiven extra Nitrogen EF и для чего он используется
SmofKabiven extra Nitrogen EF - это эмульсия для инфузии, вводимая пациенту через капельницу (инфузию в вену). Упаковка лекарства представляет собой пластиковый мешок, содержащий аминокислоты (необходимые для создания белков), глюкозу (углеводы) и жиры (липиды). Лекарство может быть использовано у взрослых пациентов и детей в возрасте 2 лет и старше.
Медицинский персонал вводит SmofKabiven extra Nitrogen EF, если другие методы питания недостаточны или невозможны.
2. Важные сведения перед использованием SmofKabiven extra Nitrogen EF
Не использовать SmofKabiven extra Nitrogen EF, если у пациента:
- аллергия на активные вещества или любой другой компонент этого лекарства (перечисленные в пункте 6);
- аллергия на рыбный белок или яйца;
- аллергия на арахис или сою (SmofKabiven extra Nitrogen EF содержит соевое масло);
- слишком высокая концентрация жиров в крови (гиперлипидемия);
- тяжелые нарушения функции печени;
- проблемы с свертываемостью крови (нарушения свертываемости);
- нарушения обмена аминокислот;
- тяжелая болезнь почек, не поддающаяся диализу;
- острая шоковая реакция;
- не контролируемая, повышенная концентрация глюкозы в крови (гипергликемия);
- жидкость в легких (острый отек легких);
- слишком много жидкости в организме (перегидратация);
- не леченная сердечная недостаточность;
- нарушение свертываемости крови (гемофагоцитарный синдром);
- не стабильное общее состояние, например, тяжелая травма, не компенсированный диабет, острый инфаркт миокарда, инсульт, тромбоз, метаболический ацидоз (нарушение, характеризующееся слишком большим количеством веществ с кислым характером в крови), тяжелая инфекция (тяжелая сепсис), кома, дефицит жидкости (гипотонический обезвоживание).
Не использовать SmofKabiven extra Nitrogen EF у новорожденных и детей в возрасте до 2 лет.
Предостережения и меры предосторожности
Прежде чем начать использовать SmofKabiven extra Nitrogen EF, необходимо обсудить это с врачом, если у пациента:
- болезнь почек;
- диабет;
- панкреатит;
- болезнь печени;
- гипотиреоз (нарушения щитовидной железы);
- сепсис (тяжелая инфекция).
Если во время инфузии出现 лихорадка, сыпь, отек, затруднение дыхания, озноб, потливость, тошнота или рвота, необходимо немедленно сообщить об этом медицинскому персоналу, поскольку эти симптомы могут быть вызваны аллергической реакцией или введением слишком большой дозы лекарства.
Врач может рекомендовать регулярное исследование крови для определения функциональных проб печени и других показателей.
Дети и подростки
SmofKabiven extra Nitrogen EF не предназначен для введения новорожденным или детям в возрасте до 2 лет. SmofKabiven extra Nitrogen EF можно вводить детям в возрасте от 2 до 16/18 лет.
SmofKabiven extra Nitrogen EF и другие лекарства
Необходимо сообщить врачу о всех лекарствах, которые пациент принимает в настоящее время или принимал ранее, а также о лекарствах, которые пациент планирует принимать, включая те, которые отпускаются без рецепта.
Беременность и грудное вскармливание
Нет данных о использовании SmofKabiven extra Nitrogen EF во время беременности или в период грудного вскармливания. SmofKabiven extra Nitrogen EF вводится беременным женщинам или в период грудного вскармливания только в том случае, если врач считает это необходимым. SmofKabiven extra Nitrogen EF во время беременности и в период грудного вскармливания может быть введен по назначению врача.
Вождение транспортных средств и эксплуатация механизмов
Не применимо, поскольку это лекарство используется в больнице.
3. Как использовать SmofKabiven extra Nitrogen EF
Это лекарство должно использоваться всегда в соответствии с рекомендациями врача. В случае сомнений необходимо обратиться к врачу.
Врач выбирает индивидуальную дозу в зависимости от веса и клинического состояния пациента. SmofKabiven extra Nitrogen EF вводится только медицинским персоналом.
Использование большей, чем рекомендованная, дозы SmofKabiven extra Nitrogen EF
Мало вероятно, что пациент получит слишком большую дозу SmofKabiven extra Nitrogen EF, поскольку это лекарство вводится медицинским персоналом.
4. Возможные нежелательные реакции
Как и любой лекарственный препарат, это лекарство может вызывать нежелательные реакции, хотя они не возникают у каждого пациента.
Часто встречающиеся нежелательные реакции(могут возникать не чаще чем у 1 из 10 пациентов):
незначительное повышение температуры тела.
Нечасто встречающиеся нежелательные реакции(могут возникать не чаще чем у 1 из 100 пациентов): высокая концентрация ферментов печени в крови, отсутствие аппетита, тошнота, рвота, озноб, головокружение и головная боль.
Редко встречающиеся нежелательные реакции(могут возникать не чаще чем у 1 из 1000 пациентов): низкое или высокое артериальное давление, затруднение дыхания, учащенное сердцебиение (тахикардия).
Реакции гиперчувствительности (которые могут проявляться такими симптомами, как отек, лихорадка, снижение артериального давления, сыпь на коже, пузырьки, покраснение, головная боль). Чувство жара и холода. Бледность. Легкая цианоз губ и кожи (связанная с недостатком кислорода в крови). Боль в шее, спине, костях, груди и пояснице.
Сообщение о нежелательных реакциях
Если возникают любые нежелательные реакции, включая любые нежелательные реакции, не указанные в этой инструкции, необходимо сообщить об этом врачу, фармацевту или медсестре. Нежелательные реакции можно сообщать直接 в Департамент мониторинга нежелательных реакций лекарственных средств Управления по регистрации лекарственных средств, медицинских изделий и биоцидных продуктов
ул. Аллея Ерозолимских, 181С, 02-222 Варшава
тел.: +48 22 49 21 301, факс: +48 22 49 21 309
веб-сайт: https://smz.ezdrowie.gov.pl
Нежелательные реакции можно также сообщать в организацию, ответственной за лекарственный препарат.
Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности использования лекарства.
5. Как хранить SmofKabiven extra Nitrogen EF
Лекарство должно храниться в месте, недоступном для детей.
Не хранить при температуре выше 25°C. Не замораживать. Хранить в наружном мешке.
Не использовать это лекарство после истечения срока годности, указанного на мешке и картонной коробке.
Срок годности указывает последний день месяца.
6. Содержание упаковки и другие сведения
Что содержит SmofKabiven extra Nitrogen EF
Активными веществами лекарства являются:
г на 1000 мл
аланин
9,2
аргинин
7,9
глицин
7,2
гистидин
2,0
изолейцин
3,3
лейцин
4,8
лизин (в виде ацетата)
4,3
метионин
2,8
фенилаланин
3,3
пролин
7,3
серин
4,3
таурин
0,65
треонин
2,9
триптофан
1,3
тирозин
0,26
валин
4,1
глюкоза (в виде моногидрата)
85
очищенное соевое масло
8,7
триглицериды насыщенных жирных кислот со средней длиной цепи
8,7
очищенное оливковое масло
7,2
рыбий жир, богатый омега-3 кислотами
4,3
Другие компоненты (вспомогательные вещества) - глицерин, очищенные фосфолипиды из яичного желтка, все-рак-α-тokoферол, гидроксид натрия (для установления pH), олеинат натрия, уксусная кислота (для установления pH), соляная кислота (для установления pH) и вода для инъекций.
Как выглядит SmofKabiven extra Nitrogen EF и что содержит упаковка
Растворы глюкозы и аминокислот прозрачны, бесцветны или слегка желтоватые, без твердых частиц. Жировая эмульсия белая и однородная.
Варианты упаковки:
1 × 506 мл, 6 × 506 мл
1 × 1012 мл, 4 × 1012 мл
1 × 1518 мл, 4 × 1518 мл
1 × 2025 мл, 4 × 2025 мл
1 × 2531 мл, 3 × 2531 мл
Не все варианты упаковки могут находиться в обращении.
Ответственное лицо и производитель
Fresenius Kabi AB
Рапсгатан, 7
751 74 Уппсала
Швеция
Для получения более подробной информации необходимо обратиться к представителю ответственного лица:
Fresenius Kabi Polska Sp. z o.o.
ул. Аллея Ерозолимских, 134
02-305 Варшава
тел.: +48 22 345 67 89
Дата последнего обновления инструкции:09.06.2023 г.
---------------------------------------------------------------------------------------------------------------------------
Информация, предназначенная только для медицинского персонала:
Предостережения и меры предосторожности при использовании
Чтобы избежать опасностей, связанных с инфузией со скоростью, превышающей рекомендуемую, рекомендуется проводить ее непрерывно и под контролем, при возможности с использованием объемного насоса.
Поскольку использование центральной вены для инфузии связано с повышенным риском инфекции, при установке и обслуживании катетера рекомендуется соблюдать правила асептического поведения, чтобы избежать любой инфекции.
Рекомендуется контролировать концентрацию глюкозы и электролитов в сыворотке, осмолярность, а также баланс жидкости и кислотно-щелочное равновесие, а также проводить ферментативные пробы печени.
В случае возникновения любых признаков или симптомов анафилактической реакции (таких как лихорадка, озноб, сыпь или одышка) необходимо немедленно прекратить инфузию.
Не следует вводить SmofKabiven extra Nitrogen EF одновременно с кровью в том же инфузионном наборе, поскольку это может привести к псевдоагглютинации.
Способ введения
Внутривенное введение, инфузия в центральную вену.
Чтобы обеспечить полное парентеральное питание, необходимо добавлять к SmofKabiven extra Nitrogen EF микроэлементы, электролиты и витамины в соответствии с потребностями пациента.
Дозировка
Взрослые пациенты
Рекомендуемая дозировка
Диапазон доз составляет от 13 до 31 мл SmofKabiven extra Nitrogen EF/кг массы тела/день, что обеспечивает введение от 0,14 до 0,32 г азота/кг массы тела/день (от 0,85 до 2,0 г аминокислот/кг массы тела/день) и от 12 до 28 ккал/кг массы тела/день общей энергии (от 8 до 19 ккал/кг массы тела/день не белковой энергии).
Скорость инфузии
Максимальная скорость инфузии глюкозы обычно составляет 0,25 г/кг массы тела/час, аминокислот - 0,1 г/кг массы тела/час, жиров - 0,15 г/кг массы тела/час.
Скорость инфузии не должна превышать 1,5 мл/кг массы тела/час (что соответствует 0,13 г глюкозы, 0,10 г аминокислот и 0,04 г жиров/кг массы тела/час). Рекомендуемый thời間 инфузии составляет от 14 до 24 часов.
Гемодиализное парентеральное питание (IDPN, англ. intradialytic parenteral nutrition)
У клинически стабильных взрослых пациентов, подвергающихся хроническому заместительному лечению почек, максимальная скорость инфузии при гемодиализном парентеральном питании (IDPN) составляет 3,0 мл/кг массы тела/час (что соответствует 0,20 г/кг массы тела/час аминокислот, 0,25 г/кг массы тела/час глюкозы и 0,09 г/кг массы тела/час жиров). Объем инфузии при IDPN должен зависеть от разницы между пероральным приемом пищи и рекомендуемым потреблением питательных веществ, неизбежных потерь питательных веществ, вызванных лечением почек, а также от индивидуальной метаболической толерантности пациента. Время инфузии при IDPN обычно составляет от 3 до 5 часов, в зависимости от потребностей пациента и запланированного времени сеанса лечения почек. Максимальная рекомендуемая суточная доза остается неизменной
Максимальная суточная доза
Максимальная суточная доза зависит от клинического состояния пациента и может меняться даже из дня в день. Рекомендуемая максимальная суточная доза составляет 31 мл/кг массы тела/день.
Дети и подростки
Дети в возрасте 2-11 лет
Рекомендуемая дозировка
Доза до 31 мл/кг массы тела/день должна регулярно корректироваться в соответствии с потребностями пациента в детском возрасте, которые различаются намного больше, чем у взрослых пациентов.
Скорость инфузии
Рекомендуемая максимальная скорость инфузии составляет 1,8 мл/кг массы тела/час (что соответствует 0,12 г аминокислот/кг массы тела/час, 0,15 г глюкозы/кг массы тела/час и 0,05 г жиров/кг массы тела/час).
За исключением особых случаев, требующих тщательного мониторинга, при использовании рекомендуемой максимальной скорости инфузии время инфузии не должно превышать 17 часов.
Рекомендуемый время инфузии составляет от 12 до 24 часов.
Максимальная суточная доза
Максимальная суточная доза переменна в зависимости от клинического состояния пациента и может меняться даже из дня в день. Рекомендуемая максимальная суточная доза составляет 31 мл/кг массы тела/день.
Подростки в возрасте 12-16/18 лет
У подростков SmofKabiven extra Nitrogen EF можно дозировать как у взрослых пациентов.
Особые меры предосторожности при удалении и подготовке лекарства к использованию
Не использовать, если упаковка повреждена.
Использовать только в том случае, если растворы аминокислот и глюкозы прозрачны, бесцветны или слегка желтоватые, а жировая эмульсия белая и однородная .Содержимое трех отдельных камер необходимо смешать перед использованием, а также перед возможным добавлением других веществ через специальный порт.
После удаления защитных средств необходимо несколько раз перевернуть мешок, чтобы тщательно смешать все компоненты лекарства и получить однородную смесь, в которой не должны быть видны признаки разделения фаз.
Только для одноразового использования. Все неиспользованные остатки лекарства, оставшиеся после инфузии, необходимо уничтожить.
Совместимость
Данные о совместимости доступны для лекарств Dipeptiven, Addamel N/Supliven, Glycophos, Addiphos, Vitalipid N Adult/Infant и Soluvit N в определенных количествах и при определенной концентрации электролитов.
При добавлении электролитов необходимо учитывать их количества, уже присутствующие в мешке, для удовлетворения клинических потребностей пациента. Доступные данные подтверждают возможность добавления указанных выше лекарств в активированный мешок в соответствии с таблицей ниже:
Диапазон совместимости: стабильность в течение 7 дней, т.е. 6 дней при хранении при температуре 2-8 °C, а затем 24 часа при температуре 20-25 °C.
| Единица | Максимальная общая содержание | |||||
| Объем мешка SmofKabiven extra Nitrogen EF | мл | 506 | 1012 | 1518 | 2025 | 2531 |
| Добавка | Объем | |||||
| Dipeptiven | мл |
|
|
|
|
|
| Supliven/Addamel N | мл |
|
|
|
|
|
| Soluvit N | флакон(и) |
|
|
|
|
|
| Vitalipid N Adult/Infant | мл |
|
|
|
|
|
| Лимиты электролитов1 | Концентрация | |||||
| Натрий | ммоль/л | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 |
| Калий | ммоль/л | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 |
| Кальций | ммоль/л | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 |
| Магний | ммоль/л | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 |
| Неорганический фосфат (Addiphos) или органический фосфат (Glycophos) | ммоль/л | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 |
| Цинк | ммоль/л | ≤ 0,2 | ≤ 0,2 | ≤ 0,2 | ≤ 0,2 | ≤ 0,2 |
| Селен | мкмоль/л | ≤ 2 | ≤ 2 | ≤ 2 | ≤ 2 | ≤ 2 |
Примечание: эта таблица предназначена для демонстрации совместимости. Она не является рекомендацией по дозировке.
Прежде чем назначать вышеуказанные лекарства, необходимо ознакомиться с утвержденными инструкциями.
Информация о совместимости с другими добавками, а также сроки хранения различных смесей будут доступны по запросу.
Все добавки необходимо смешивать с лекарством в асептических условиях.
Срок годности после смешивания содержимого камер мешка
Показана физическая и химическая стабильность смешанного содержимого трехкамерного мешка в течение 48 часов при температуре 20-25 °C. С микробиологической точки зрения лекарство должно быть использовано немедленно.
В противном случае, за срок хранения во время использования и за условия хранения перед использованием отвечает пользователь. Этот срок не должен превышать 24 часа при температуре 2-8 °C, если смешивание не было проведено в контролируемых и валидированных асептических условиях.
Срок годности после смешивания с дополнительными веществами
Показана физико-химическая стабильность смешанного содержимого трехкамерного мешка с дополнительными веществами в течение до 7 дней, т.е. 6 дней при температуре 2-8 °C, а затем 24 часа при температуре 20-25 °C, включая время инфузии. С микробиологической точки зрения лекарство должно быть использовано немедленно после добавления других компонентов. В противном случае, за срок хранения во время использования и за условия хранения перед использованием отвечает пользователь. Этот срок не должен превышать 24 часа при температуре 2-8 °C, если смешивание не было проведено в контролируемых и валидированных асептических условиях.
SmofKabiven extra Nitrogen EF Инструкция по подготовке мешка к использованию
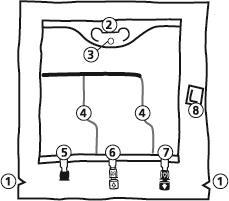
- 1. Разрез в наружном мешке
- 2. Ручка мешка
- 3. Отверстие для подвешивания мешка
- 4. Сварные швы, разделяющие отдельные камеры мешка
- 5. Слепой порт (используется только в производстве)
- 6. Порт для введения дополнительных веществ
- 7. Порт для инфузии
- 8. Поглотитель кислорода
| |
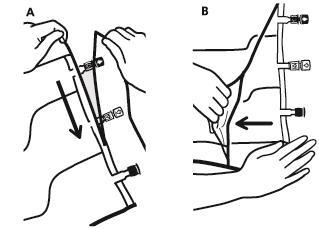 | |
- Чтобы удалить наружный мешок, необходимо положить его горизонтально и, начиная с разреза, находящегося возле портов, разорвать вдоль верхнего края (А).
- Затем разорвать наружный мешок вдоль длинного края, снять его и выбросить вместе с поглотителем кислорода (Б).
2. Смешивание
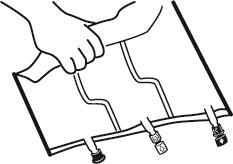
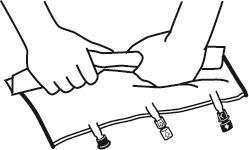
- Положить мешок на плоскую поверхность.
- Начиная с стороны ручки, плотно скрутить мешок в направлении портов, сначала правой рукой, а затем, оказывая постоянное давление, левой рукой, пока не разорвутся сварные швы. Они открываются под действием давления жидкости. Сварные швы можно также открыть до удаления наружного мешка. Примечание:жидкость смешивается легко, хотя сварной шов остается целым.
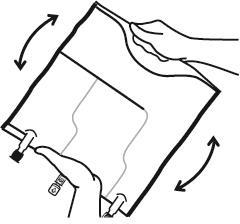
- Смешать содержимое трех камер, переворачивая мешок три раза, что должно обеспечить тщательное смешивание компонентов.
| |
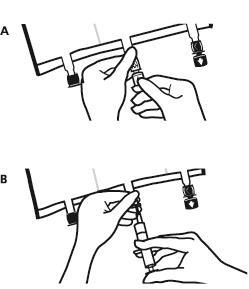 | |
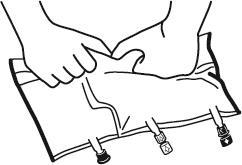
- Снова положить мешок на плоскую, ровную поверхность. Прямо перед введением дополнительных веществ необходимо оторвать помеченную стрелкой пробку одноразового использования, защищающую белый порт для введения дополнительных веществ (А).
Примечание:мембрана порта для введения дополнительных веществ стерильна.
- Удерживать основание порта для введения дополнительных веществ. Ввести иглу, ввести дополнительные вещества (с известной совместимостью) через центр места для инъекции (Б).
- Тщательно смешать содержимое мешка после добавления каждого компонента, переворачивая мешок три раза после каждого добавления. Использовать шприцы с иглами диаметром 18-23 Г и длиной не более 40 мм.
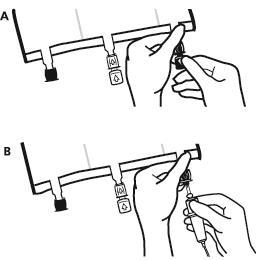
- Прямо перед подключением инфузионного набора необходимо оторвать пробку одноразового использования, защищающую синий порт для инфузии (А). Примечание:мембрана порта для инфузии стерильна.
- Использовать инфузионные наборы без воздушного клапана или закрыть воздушный клапан.
- Удерживать основание порта для инфузии.
- Ввести иглу инфузионного набора в порт для инфузии. Чтобы обеспечить хорошее крепление иглы, необходимо ввести всю ее длину. Примечание:внутренняя поверхность порта для инфузии стерильна.
4. Подвешивание мешка
- Подвесить мешок, используя отверстие, находящееся под ручкой.
- Страна регистрации
- Активное вещество
- Требуется рецептДа
- Производитель
- ИмпортерFresenius Kabi AB
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Смофкабивен екстра Нитроген ЕфФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецептФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецептФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецепт
Аналоги Смофкабивен екстра Нитроген Еф в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Смофкабивен екстра Нитроген Еф в Hiszpania
Аналог Смофкабивен екстра Нитроген Еф в Ukraina
Врачи онлайн по Смофкабивен екстра Нитроген Еф
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Смофкабивен екстра Нитроген Еф – по решению врача и с учетом местных правил.














