
Педиавен Г25

Спросите врача о рецепте на Педиавен Г25

Инструкция по применению Педиавен Г25
Инструкция, прилагаемая к упаковке: информация для пользователя
Pediaven G25, раствор для инфузии
комбинированный продукт
Прежде чем использовать лекарство, необходимо внимательно ознакомиться с содержанием инструкции, поскольку она содержит важную информацию для пациента.
Необходимо сохранить эту инструкцию, чтобы в случае необходимости можно было ее повторно прочитать.
В случае любых сомнений необходимо обратиться к врачу или медсестре.
Если у пациента появляются любые нежелательные симптомы, включая любые нежелательные симптомы, не указанные в этой инструкции, необходимо сообщить об этом врачу или медсестре. См. пункт 4.
Содержание инструкции
- 1. Что такое Pediaven G25 и для чего он используется
- 2. Важные сведения перед использованием лекарства Pediaven G25
- 3. Как использовать Pediaven G25
- 4. Возможные нежелательные реакции
- 5. Как хранить Pediaven G25
- 6. Содержание упаковки и другие сведения
1. Что такое Pediaven G25 и для чего он используется
Pediaven G25 является питательной смесью, содержащей раствор аминокислот (необходимых для создания белков) и глюкозы (углеводов) с солями (электролитами и микроэлементами) в пластиковом мешке, содержащем две камеры, каждая по 500 мл.
Этот препарат является раствором, предназначенным для введения через капельницу в вену (внутривенная инфузия).
Он может быть использован у младенцев, детей и подростков, которые не могут получать питание через рот.
2. Важные сведения перед использованием лекарства Pediaven G25
Когда не использовать лекарство Pediaven G25:
если у пациента есть аллергия на активные вещества или любой из других компонентов этого лекарства (перечисленных в пункте 6);
если у пациента есть врожденные нарушения метаболизма аминокислот (если организм использует определенные аминокислоты неправильно);
если у пациента есть тяжелая болезнь печени или почек без возможности диализа;
если у пациента есть тяжелая гипергликемия (высокий уровень сахара в крови) и это состояние не контролируется;
если концентрация в крови пациента (в сыворотке) одной из солей (электролитов), содержащейся в этом лекарстве, повышена;
если пациент находится в нестабильном состоянии, например, после серьезной травмы или в случае неконтролируемой диабета, метаболического ацидоза (проблемы, вызванные очень большим количеством кислых веществ в крови), серьезной инфекции (септический шок), острого шока или комы;
если пациент находится в состоянии тяжелого недоедания и существует риск развития «синдрома шокового питания».
Другие общие ситуации, когда не следует использовать лекарство Pediaven G25:
если у пациента есть жидкость в легких (острый отек легких);
если у пациента есть слишком много жидкости в организме (перегидратация);
если у пациента есть нелеченая сердечная недостаточность;
если у пациента есть недостаточное количество жидкости в организме (гипотоническое обезвоживание).
Не следует вводить лекарство Pediaven G25, если любая из вышеописанных ситуаций относится к пациенту.
В случае сомнений необходимо проконсультироваться с врачом или медсестрой перед введением пациенту лекарства Pediaven G25.
Предостережения и меры предосторожности
Важные сведения перед началом приема пациентом лекарства Pediaven G25:
Pediaven G25 следует использовать с большой осторожностью, когда требуется ограничение приема жидкости, например, при некоторых сердечных, легочных или почечных заболеваниях.
Необходимо сообщить врачу, если во время лечения у пациента появляются любые нежелательные реакции, такие как озноб, потливость, лихорадка, головная боль, сыпь или проблемы с дыханием. Инфузию необходимо прервать.
При использовании у детей в возрасте до 2 лет раствор (в мешке и наборе для введения) следует защищать от света до момента окончания введения. Воздействие на лекарство Pediaven G25 света, особенно после добавления микроэлементов и (или) витаминов, приводит к образованию перекисей и других продуктов распада, что можно ограничить, обеспечив защиту от света.
Повышенная концентрация магния в крови
Количество магния, содержащееся в лекарстве Pediaven G25, может привести к повышению концентрации магния в крови.
Это может проявляться следующим образом: слабость, замедленные рефлексы, тошнота, рвота, пониженная концентрация кальция в крови, проблемы с дыханием, низкое кровяное давление и нерегулярный сердечный ритм. Эти симптомы могут быть трудно обнаруживаемыми, и поэтому врач может контролировать параметры крови пациента, в частности, если у него есть риск повышенной концентрации магния в крови, особенно нарушения функции почек. Если концентрация магния в крови повышена, инфузия будет прервана или уменьшена.
Врач будет контролировать состояние пациента на протяжении всего периода лечения и может изменить вводимую дозу или порекомендовать введение дополнительных лекарств, если это необходимо (главным образом витаминов, жиров или электролитов).
Pediaven G25 и другие лекарства
Необходимо сообщить врачу о всех лекарствах, которые пациент принимает в настоящее время или принимал недавно, включая лекарства, отпускаемые без рецепта.
3. Как использовать Pediaven G25
Дозировка
Pediaven G25 следует всегда использовать в соответствии с рекомендациями врача. Врач решит, какая доза и продолжительность лечения необходимы, в зависимости от возраста пациента, веса, метаболических и энергетических потребностей, клинического состояния и способности к метаболизму питания через рот и кишечник (питание через желудочно-кишечный тракт).
Если питание осуществляется исключительно через вену (внутривенное введение), врач может порекомендовать одновременное введение витаминов и жиров. Если к лекарству добавлены витамины, мешок следует защищать от света.
Способ введения
Pediaven G25 вводится исключительно медицинским персоналом и только через вену, в центральную вену (в большую вену).
При использовании у детей в возрасте до 2 лет раствор (в мешке и наборе для введения) следует защищать от света до момента окончания введения (см. пункт 2).
Использование большей, чем рекомендованная, дозы лекарства Pediaven G25
Pediaven G25 следует всегда использовать в соответствии с рекомендациями врача. В случае сомнений, что пациент принял большую, чем рекомендованная, дозу лекарства, необходимо немедленно сообщить об этом врачу.
Пропуск введения лекарства Pediaven G25
Pediaven G25 следует всегда использовать в соответствии с рекомендациями врача. Необходимо немедленно сообщить врачу, если пациент не получил инфузию лекарства Pediaven G25. Не следует использовать двойную дозу для компенсации пропущенной дозы и не следует превышать рекомендованную скорость инфузии.
В случае любых дальнейших сомнений, связанных с использованием этого лекарства, необходимо обратиться к врачу.
4. Возможные нежелательные реакции
Как и любой лекарственный препарат, это лекарство может вызывать нежелательные реакции, хотя они не появляются у каждого пациента.
Необходимо немедленно связаться с врачом, который прервет инфузию, если у пациента появляются описанные ниже симптомы:
необычные признаки или симптомы аллергической реакции, такие как потливость, лихорадка, озноб, головная боль, сыпь или проблемы с дыханием.
Могут出现 нежелательные реакции, связанные с парентеральным питанием (питанием через вену), особенно в начале лечения, которые включают:
повышение концентрации сахара в крови (гипергликемия);
нарушения желудочно-кишечного тракта (тошнота, рвота);
чрезмерное поступление аминокислот может привести к метаболическому ацидозу (нарушению баланса кислых и щелочных веществ в организме). Может появиться гиперазотемия (слишком большое количество азотных соединений в крови), особенно если у пациента есть проблемы с почками, печенью или дыханием;
временное нарушение функции печени;
аллергические реакции на определенные аминокислоты.
Неправильное использование (передозировка или слишком быстрая инфузия) может привести к появлению симптомов гипергликемии и гиперволемии (повышение объема крови в венах).
Сообщение о нежелательных реакциях
Если появляются любые нежелательные реакции, включая любые нежелательные реакции, не указанные в инструкции, необходимо сообщить об этом врачу или фармацевту. Нежелательные реакции можно сообщать напрямую в Департамент мониторинга нежелательных реакций лекарственных средств Управления регистрации лекарственных средств, медицинских изделий и биоцидных продуктов
Ал. Ерозолимских 181С
02-222 Варшава
тел.: +48 22 49 21 301
факс: +48 22 49 21 309
электронная почта: [email protected]
Нежелательные реакции также можно сообщать в компанию, ответственную за лекарственный препарат.
Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности использования лекарства.
5. Как хранить Pediaven G25
Лекарство должно храниться в месте, недоступном для детей.
Не использовать это лекарство после истечения срока годности, указанного на этикетке после: EXP. Срок годности указывает последний день указанного месяца.
Хранить при температуре ниже 25°C. Не замораживать. Хранить в наружном мешке. Использовать сразу после смешивания содержимого двух камер.
При использовании у детей в возрасте до 2 лет раствор (в мешке и наборе для введения) следует защищать от света до момента окончания введения (см. пункт 2).
Срок годности лекарства после смешивания с дополнительными веществами
После смешивания двух камер можно добавить другие компоненты через порт, предназначенный для введения дополнительных веществ. Лекарство должно быть использовано сразу после добавления других компонентов.
Не использовать это лекарство, если упаковка повреждена или видны признаки порчи.
Лекарства не следует выбрасывать в канализацию или домашние контейнеры для мусора. Необходимо спросить у фармацевта, как утилизировать лекарства, которые больше не используются. Такое поведение поможет защитить окружающую среду.
6. Содержание упаковки и другие сведения
Что содержит Pediaven G25
Активными веществами лекарства являются:
| Активные вещества | Раствор аминокислот 500 мл | Раствор глюкозы 500 мл | Раствор после смешивания, готовый к использованию 1000 мл |
| аланин | 2,41 г | 2,41 г | |
| аргинин | 1,57 г | 1,57 г | |
| аспарагиновая кислота | 1,57 г | 1,57 г | |
| ацетилцистеин (что соответствует цистеину) | 0,51 г (0,38 г) | 0,51 г (0,38 г) | |
| глютаминовая кислота | 2,72 г | 2,72 г | |
| глицин | 0,80 г | 0,80 г | |
| гистидин | 0,80 г | 0,80 г | |
| изолейцин | 1,19 г | 1,19 г | |
| лейцин | 2,68 г | 2,68 г | |
| лизин моногидрат (что соответствует лизину безводному) | 2,4 г (2,14 г) | 2,4 г (2,14 г) | |
| метионин | 0,50 г | 0,50 г | |
| фенилаланин | 1,03 г | 1,03 г | |
| пролин | 2,14 г | 2,14 г | |
| серин | 1,45 г | 1,45 г | |
| таурин | 0,11 г | 0,11 г | |
| треонин | 1,38 г | 1,38 г | |
| триптофан | 0,54 г | 0,54 г | |
| тирозин | 0,19 г | 0,19 г | |
| валин | 1,38 г | 1,38 г | |
| дипотассий фосфат | 1,74 г | 1,74 г | |
| селен диоксид | 0,11 мг | 0,11 мг | |
| глюкоза моногидрат (что соответствует глюкозе безводной) | 275,0 г (250,0 г) | 275,0 г (250,0 г) | |
| кальций глюконат | 3,59 г | 3,59 г | |
| магний млечан двугидрат | 1,43 г | 1,43 г | |
| натрий хлорид | 2,34 г | 2,34 г | |
| калий хлорид | 1,49 г | 1,49 г | |
| цинк ацетат дигидрат | 13,43 мг | 13,43 мг | |
| медь сульфат пентагидрат | 2,00 мг | 2,00 мг | |
| натрий фторид | 2,21 мг | 2,21 мг | |
| марганец хлорид тетрагидрат | 0,72 мг | 0,72 мг | |
| калий йодид | 0,13 мг | 0,13 мг | |
| хром хлорид гексагидрат | 0,21 мг | 0,21 мг |
| железо сульфат гептагидрат | 4,98 мг | 4,98 мг | |
| кобальт хлорид гексагидрат | 1,21 мг | 1,21 мг | |
| молибдат аммония тетрагидрат | 0,18 мг | 0,18 мг |
Другими компонентами (вспомогательными веществами) являются: уксусная кислота (для установления pH), соляная кислота (для установления pH), вода для инъекций.
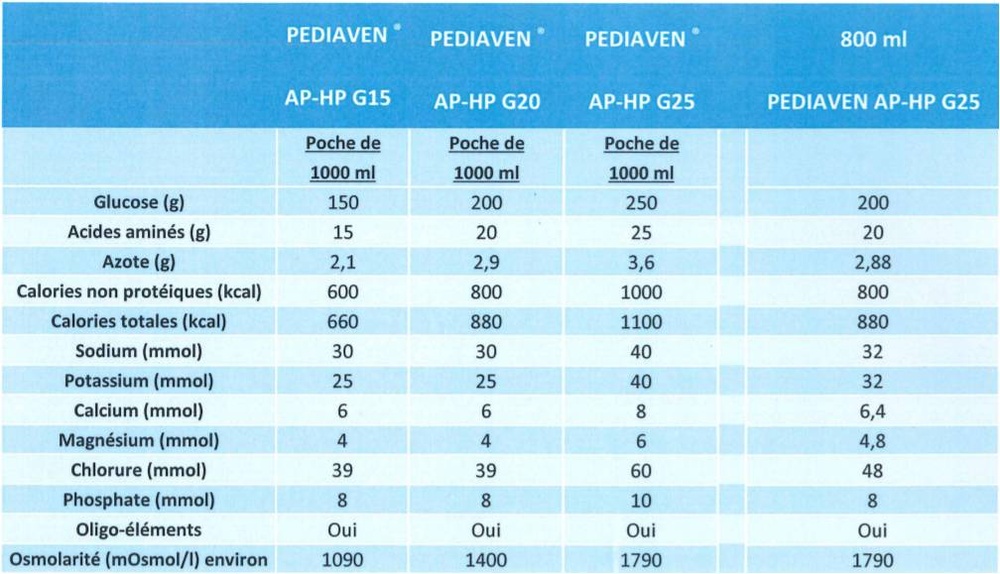
Осмоларность раствора: 1790 мОсм/л
pH раствора: 4,8 – 5,5
Питательная ценность в 1000 мл
глюкоза
аминокислоты
общий азот
общая энергия
энергия, не связанная с белком
250 г
25 г
3,56 г
1100 ккал
1000 ккал
Как выглядит Pediaven G25 и что содержит упаковка
Это лекарство представляет собой раствор для инфузии, прозрачный, бесцветный или слегка желтоватый, свободный от твердых частиц. Он доступен в двукамерном мешке (каждая камера содержит по 500 мл раствора).
Размер упаковки: 4 мешка × 1000 мл.
Ответственное лицо и производитель
Ответственное лицо
Fresenius Kabi Polska Sp. z o.o.
Ал. Ерозолимских 134
02-305 Варшава
Производитель
Fresenius Kabi Austria GmbH
Хафнерштрассе 36
8055 Грац
Австрия
Для получения более подробной информации необходимо обратиться к ответственному лицу:
Fresenius Kabi Polska Sp. z o.o.
Ал. Ерозолимских 134
02-305 Варшава
тел.: +48 22 345 67 89
Этот лекарственный препарат разрешен к обращению в странах-членах Европейского экономического пространства под следующими названиями:
Австрия
Pediaven G25%
Бельгия
Kidiamix G25%
Эстония
Pediaven G25
Франция
Kidiaven G25%
Испания
Pediaven G25
Голландия
Kidiamix G25%
Литва
Pediaven G25%
Латвия
Pediaven G25%
Польша
Pediaven G25
Португалия
Pediaven G25
Италия
Kidiamix G25%
Дата последней актуализации инструкции:21.01.2020 г.
--------------------------------------------------------------------------------------------------------------------------------
Информация, предназначенная исключительно для медицинского персонала:
Предостережения и меры предосторожности при использовании
Pediaven G25, раствор для инфузии, является гипертоническим раствором.
Поскольку использование центральной вены для инфузии связано с риском инфекции, необходимо тщательно соблюдать правила асептического поведения, чтобы избежать любой инфекции, особенно при установке катетера.
Чтобы избежать риска, связанного с введением инфузии со скоростью, превышающей рекомендуемую, важно проводить инфузию с регулярной и контролируемой скоростью.
Необходимо контролировать осмоларность и концентрацию глюкозы в сыворотке, а также водно-электролитный баланс, кислотно-щелочной баланс и функцию печени.
В случае появления любых признаков или симптомов анафилактической реакции (особенно лихорадки, озноба, потливости, сыпи или затруднения дыхания) необходимо немедленно прервать инфузию.
Лекарство Pediaven G25 не следует вводить в периферическую вену из-за высокой осмоларности.
Во время инфузии необходима клиническая и лабораторная наблюдение, особенно на начальном этапе. Наблюдение должно быть усилено в следующих случаях:
тяжелая печеночная недостаточность,
тяжелая почечная недостаточность,
метаболический ацидоз (нарушение, вызванное очень большим количеством кислых веществ в крови),
диабет или непереносимость глюкозы.
Экстравазация
Как и в случае со всеми лекарствами, вводимыми через вену, во время инфузии этого лекарства может появиться экстравазация (см. пункт 4. Возможные нежелательные реакции).
Необходимо регулярно проверять место установки катетера, чтобы обнаружить признаки экстравазации.
В случае появления экстравазации необходимо немедленно прервать инфузию, оставив, однако, установленный катетер или канюлю, чтобы обеспечить возможность немедленного лечения пациента, и удалить оставшуюся после экстравазации жидкость перед удалением катетера или канюлы.
Методы лечения после экстравазации могут включать нефармакологическое, фармакологическое и (или) хирургическое вмешательство. В случае значительной экстравазации необходимо проконсультироваться с хирургом.
Не следует повторно вводить инфузию в ту же центральную вену.
Способ введения
Внутривенная инфузия, в центральную вену.
Чтобы обеспечить полное парентеральное питание, рекомендуется одновременное введение витаминов (максимальное количество, которое можно добавить к лекарству, см. Характеристика лекарственного препарата) и жиров (введение только через Y-коннектор, не直接 в мешок), если это не противопоказано.
Однако Pediaven G25 уже содержит микроэлементы. В некоторых случаях, в зависимости от потребностей пациента, фармакологические растворы или растворы для парентерального питания можно добавлять в мешок, но только после проверки их совместимости (см. пункт «Фармацевтическая совместимость»).
При использовании у детей в возрасте до 2 лет раствор (в мешке и наборе для введения) следует защищать от света до момента окончания введения.
Скорость инфузии
Дозу необходимо устанавливать индивидуально, в зависимости от возраста пациента, веса, метаболических и энергетических потребностей, клинического состояния пациента.
Врач будет проводить регулярную клиническую и биологическую оценку состояния питания и метаболического состояния пациента, особенно если парентеральное питание продолжается более 14 дней.
Общие рекомендации по дозировке: потребность в глюкозе у детей составляет в среднем 10-15 г/кг/день со скоростью инфузии 1–1,2 г/кг/час, а потребность в азоте составляет в среднем 200-300 мг/кг/день.
Скорость инфузии не должна превышать:
у младенцев (1 месяц жизни – 2 года): 6 мл/кг/час (что соответствует 1,4 г глюкозы/кг/час),
у детей (2–11 лет): 5 мл/кг/час (что соответствует 1,2 г глюкозы/кг/час),
у подростков (11–18 лет): 2 мл/кг/час (что соответствует 0,5 г глюкозы/кг/час).
Особые меры предосторожности при подготовке лекарства к использованию
Перед использованием необходимо удалить наружный мешок и проверить, что внутренний мешок не поврежден (герметичен). Не использовать, если упаковка повреждена.
Использовать только в том случае, если растворы аминокислот и глюкозы прозрачны, бесцветны или слегка желтоватые, свободны от твердых частиц. Содержимое двух отдельных камер необходимо смешать перед использованием, а также перед возможным добавлением других веществ через порт, предназначенный для этого.
Воздействие света на растворы для парентерального питания, особенно после добавления микроэлементов и (или) витаминов, может привести к образованию перекисей и других продуктов распада. При использовании у детей в возрасте до 2 лет лекарство Pediaven G25 следует защищать от света до момента окончания введения.
Смешивание двух камер перед использованием
- 1. Удалить наружный мешок и положить мешок на твердую поверхность.
- 2. Аккуратно скатать мешок, начиная с верха (от стороны ручки), прижимая до момента разрыва вертикальной сварки. Перевернуть мешок несколько раз, что должно обеспечить тщательное смешивание компонентов смеси.
Использовать только один раз. Неиспользованную смесь необходимо удалить.
Необходимо тщательно соблюдать валидированные асептические условия при обращении с лекарством и катетером, а также с инфузией.
Срок годности лекарства после смешивания
Показана химическая и физическая стабильность двукамерного мешка после смешивания в течение 24 часов при температуре 25°C. С микробиологической точки зрения, лекарство должно быть использовано немедленно. Если лекарство не используется немедленно, срок хранения во время использования и условия хранения перед использованием ответственность лежит на пользователе.
Фармацевтическая совместимость
К лекарству Pediaven G25 можно добавлять или вводить через одну и ту же линию инфузии только те фармакологические растворы или растворы для парентерального питания, совместимость которых установлена.
Информация о объеме дополнительных веществ и их совместимости с лекарством Pediaven G25 содержится в Характеристике лекарственного препарата, пункт 6.6 «Особые меры предосторожности при утилизации и подготовке лекарственного препарата к использованию». Существует риск выпадения солей кальция.
Все добавки необходимо смешивать с лекарством в асептических условиях.
Особые меры предосторожности при утилизации и подготовке лекарственного препарата к использованию
При использовании у детей в возрасте до 2 лет необходимо защищать от света до момента окончания введения. Воздействие света на лекарство Pediaven G25, особенно после добавления микроэлементов и (или) витаминов, приводит к образованию перекисей и других продуктов распада, что можно ограничить, обеспечив защиту от света.
- Страна регистрации
- Активное вещество
- Требуется рецептНет
- Производитель
- ИмпортерFresenius Kabi Austria GmbH
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Педиавен Г25Форма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецептФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецептФорма выпуска: Раствор, -Активное вещество: combinationsНе требуется рецепт
Аналоги Педиавен Г25 в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Педиавен Г25 в Испания
Аналог Педиавен Г25 в Украина
Врачи онлайн по Педиавен Г25
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Педиавен Г25 – по решению врача и с учетом местных правил.














