

Фангди

Спросите врача о рецепте на Фангди

Инструкция по применению Фангди
ЛИСТОК-ВКЛАДЫШ К ОБОРУДОВАНИЮ: ИНФОРМАЦИЯ ДЛЯ
ПОТРЕБИТЕЛЯ
FANHDI
1000 МЕ ФVIII + 1200 МЕ VWF
Порошок и растворитель для приготовления раствора для инъекций и инфузий
Комплекс человеческого фактора свёртывания крови VIII и человеческого фактора Виллебранда
Необходимо тщательно ознакомиться с содержанием листка-вкладыша перед применением препарата, поскольку он содержит важную информацию для пациента.
- Необходимо сохранить этот листок-вкладыш, чтобы в случае необходимости можно было его повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу или фармацевту.
- Этот препарат предназначен для применения у конкретного пациента. Не следует его передавать другим. Препарат может нанести вред другому человеку, даже если симптомы его заболевания такие же.
- Если у пациента出现ят любые нежелательные симптомы, включая все нежелательные симптомы, не перечисленные в этом листке-вкладыше, необходимо сообщить об этом врачу или фармацевту. См. пункт 4.
Содержание листка-вкладыша:
- 1. Что такое препарат FANHDI и для чего он используется
- 2. Важная информация перед применением препарата FANHDI
- 3. Как применять препарат FANHDI
- 4. Возможные нежелательные реакции
- 5. Как хранить препарат FANHDI
- 6. Содержание упаковки и другие сведения
1. ЧТО ТАКОЕ ПРЕПАРАТ FANHDI И ДЛЯ ЧЕГО ОН ИСПОЛЬЗУЕТСЯ
FANHDI выпускается в виде порошка и растворителя для приготовления раствора для инъекций и инфузий в флаконах, содержащих номинально 1000 МЕ человеческого фактора свёртывания крови VIII (FVIII) и 1200 МЕ человеческого фактора Виллебранда (VWF). После растворения в соответствующем количестве растворителя (воде для инъекций) продукт содержит 100 МЕ/мл FVIII и 120 МЕ/мл VWF. Фармакотерапевтическая группа: антигеморрагические препараты, комбинация фактора свёртывания крови VIII и фактора Виллебранда. FANHDI используется для профилактики и лечения кровотечений у пациентов с гемофилией А (врождённым дефицитом фактора свёртывания крови VIII).
- 1.3.1. СПС, маркировка и листок-вкладыш
Применение FANHDI также показано для профилактики и лечения кровотечений (в том числе во время хирургических операций) у пациентов с болезнью Виллебранда (VWD), когда лечение десмопрессином (DDAVP) неэффективно или противопоказано. Продукт может быть использован для лечения приобретённого дефицита человеческого фактора свёртывания крови VIII.
2. ВАЖНАЯ ИНФОРМАЦИЯ ПЕРЕД ПРИМЕНЕНИЕМ ПРЕПАРАТА FANHDI
Когда не применять препарат Fanhdi
- Когда у пациента наблюдается аллергия (чувствительность) к комплексу фактора свёртывания крови VIII и фактора Виллебранда или к любому из других компонентов этого препарата (перечисленных в пункте 6).
Необходимо обратиться к врачу, когда требуется совет или дополнительная информация.
Предостережения и меры предосторожности
- В редких случаях могут возникать анафилактические реакции (внезапные сильные аллергические реакции). Аллергия к FANHDI может проявляться в виде сыпи, общей крапивницы, чувства сдавления в груди, головокружения, также при стоянии. В случае возникновения этих симптомов необходимо прекратить введение препарата и сообщить об этом врачу.
- Чтобы определить дозу FANHDI, обеспечивающую достижение и поддержание соответствующего уровня фактора VIII, врач может назначить проведение серии исследований.
- Если кровотечение не останавливается, несмотря на введение FANHDI, необходимо сообщить об этом врачу. Это может быть вызвано образованием ингибитора фактора VIII, что требует подтверждения в исследованиях. Ингибиторы фактора VIII - это антитела, которые блокируют действие введённого фактора VIII. В результате снижается эффективность фактора VIII в предотвращении кровотечений.
- Если ранее уже произошло образование ингибитора фактора VIII, а затем лечение было изменено на другой продукт, содержащий фактор VIII, существует более высокий риск повторения этого осложнения.
- Во время лечения болезни Виллебранда с известными клиническими или лабораторными факторами риска возникновения тромбов существует опасность образования тромбозов. Поэтому необходимо проведение соответствующих исследований для раннего обнаружения симптомов, вызванных тромбозами, и применение рекомендованного лечения тромбозных осложнений.
- При болезни Виллебранда, в частности типа 3, могут образовываться нейтрализующие антитела (ингибиторы) фактора Виллебранда. Ингибиторы фактора Виллебранда - это находящиеся в крови антитела, которые могут блокировать введённый фактор. В тех случаях, когда при лечении не достигается ожидаемого уровня активности фактора Виллебранда в сыворотке или не удаётся остановить кровотечение, несмотря на применение соответствующих доз, необходимо провести исследования для обнаружения наличия ингибитора фактора Виллебранда. У пациентов с высоким уровнем ингибитора лечение фактором Виллебранда может быть неэффективным.
- 1.3.1. СПС, маркировка и листок-вкладыш
Если для введения FANHDI необходимо использовать центральный венозный доступ, врач должен учитывать возможность возникновения местной инфекции, бактериемии (инфекции крови бактериального характера) и образования тромба в вене в месте введения катетера.
- В процессе производства продуктов, полученных из человеческой крови или плазмы, применяются следующие меры, направленные на обеспечение безопасности от передачи инфекционных агентов:
- тщательный отбор доноров для исключения носителей инфекционных агентов,
- исследование каждой донорской крови и плазмы на наличие вирусов,
- применение процедур инактивации/удаления вирусов из крови и плазмы в процессе производства.
Несмотря на это, нельзя полностью исключить передачу инфекционных агентов при применении препаратов, полученных из человеческой крови или плазмы. Это относится также к неизвестным или mới появляющимся вирусам и другим патогенам. Применяемые методы считаются эффективными в отношении вирусов с оболочкой, таких как вирус иммунодефицита человека (ВИЧ), гепатита В (HBV), гепатита С (HCV) и безоболочечного вируса гепатита А. Эффективность этих методов в отношении безоболочечных вирусов, таких как парвовирус В19, может быть ограничена. Инфекция парвовирусом В19 может быть особенно опасна для беременных женщин (инфекция плода) и для людей с пониженным иммунитетом или определёнными формами анемии (например, серповидно-клеточной анемии или гемолитической анемии). У пациентов, получающих регулярные повторные дозы препаратов плазменного происхождения, содержащих фактор VIII, врач, ведущий лечение, может рекомендовать применение соответствующих вакцин (против гепатита А и В). Рекомендуется обязательно записывать фамилию пациента и номер серии продукта при каждом введении препарата FANHDI, чтобы можно было связать пациента с серией препарата. См. также пункт 4.
Дети и подростки
Указанные предостережения и меры предосторожности относятся как к взрослым, так и к детям.
- 1.3.1. СПС, маркировка и листок-вкладыш
FANHDI и другие препараты
Необходимо сообщить врачу о всех препаратах, которые пациент принимает в настоящее время или принимал ранее, а также о препаратах, которые пациент планирует принимать. Взаимодействия комплекса человеческого фактора свёртывания крови VIII и фактора Виллебранда с другими препаратами не известны.
Беременность и грудное вскармливание
Поскольку гемофилия А встречается у женщин редко, нет данных о применении комплекса фактора FVIII/VWF во время беременности и грудного вскармливания. Необходимо обратиться к врачу или фармацевту, прежде чем начать применять любой препарат.
Вождение транспортных средств и эксплуатация механизмов
FANHDI не влияет на способность управлять транспортными средствами и механизмами.
3. КАК ПРИМЕНЯТЬ ПРЕПАРАТ FANHDI
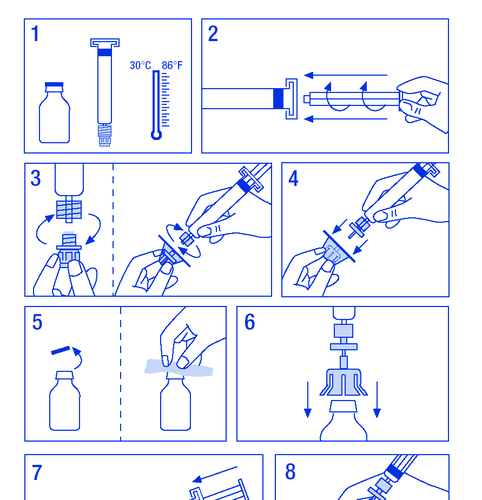
Препарат должен быть введён внутривенно. Скорость введения не должна превышать 10 мл/мин. Необходимо следовать инструкциям врача или медицинского работника из центра лечения гемофилии. В случае возникновения сомнений необходимо обратиться к врачу или фармацевту. Размер применяемой дозы FANHDI зависит от многих факторов, таких как вес тела, клиническое состояние и тип и тяжесть кровотечения. Для достижения соответствующего уровня фактора VIII и фактора Виллебранда в крови врач определяет размер дозы FANHDI и частоту её введения. Врач определяет продолжительность лечения препаратом FANHDI. Не хранить остатки для последующего применения, даже если они будут храниться в холодильнике. Приготовление раствора: Необходимо убедиться, что все действия будут выполняться в условиях, предотвращающих загрязнение.
- 1. Нагреть флаконы до температуры не выше 30 °C (рисунок № 1).
- 2. Закрепить поршень в шприце-ампуле с растворителем (рисунок № 2).
- 3. Вынуть фильтр из упаковки. Снять пластиковую крышку с конца шприца-ампулы и закрепить фильтр (рисунок № 3).
- 1.3.1. СПС, маркировка и листок-вкладыш
- 4. Вынуть соединительный элемент из флакона и соединить шприц-ампулу с фильтром (рисунок № 4).
- 5. Снять пластиковую крышку с флакона и открыть резиновый пробку, продезинфицировать дезинфицирующим средством (рисунок № 5).
- 6. Проколоть пробку в флаконе иглой соединительного элемента (рисунок № 6).
- 7. Ввести весь растворитель в флакон (рисунок № 7).
- 8. Аккуратно встряхнуть флакон до растворения порошка (рисунок № 8). Как и в случае с другими препаратами для внутривенного введения, не использовать, если препарат не растворён или видны частицы.
- 9. На короткое время отсоединить шприц-ампулу с фильтром от флакона, чтобы впустить воздух (рисунок № 9).
- 10. Перевернуть флакон вверх дном и аспирировать раствор в шприц-ампулу (рисунок № 10).
- 11. Подготовить место для инъекции, отсоединить шприц и ввести препарат через зафиксированную иглу-бабочку или другую стерильную иглу. Вводить медленно внутривенно со скоростью 3 мл/мин и никогда не превышать 10 мл/мин, чтобы избежать сосудистых реакций (рисунок № 11).
- 1.3.1. СПС, маркировка и листок-вкладыш
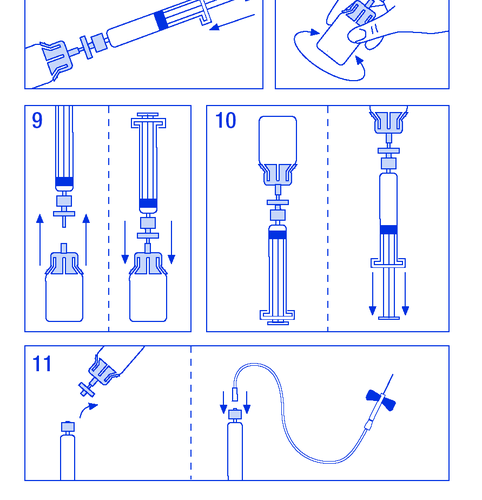
- 1.3.1. СПС, маркировка и листок-вкладыш
Не использовать повторно набор для введения. Все неиспользованные остатки препарата и другие отходы необходимо утилизировать в соответствии с местными правилами.
Применение большей, чем рекомендованная, дозы FANHDI
Не зарегистрировано случаев передозировки комплекса человеческого фактора свёртывания крови VIII и фактора Виллебранда. После значительной передозировки могут возникнуть тромбозные осложнения. Независимо от этого, каждый случай превышения рекомендованной дозы FANHDI необходимо немедленно обсудить с фармацевтом или врачом.
Пропуск применения FANHDI
- Если доза была пропущена, необходимо немедленно ввести следующую дозу и продолжить лечение регулярно в соответствии с рекомендациями врача.
- Не следует применять двойную дозу для компенсации пропущенной дозы.
4. ВОЗМОЖНЫЕ НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
Как и любой препарат, этот препарат может вызывать нежелательные реакции, хотя они не возникают у каждого пациента. Аллергия или аллергические реакции (анафилактический шок, покраснение или ощущение жжения в месте инъекции, озноб, краснота лица, общая крапивница, головная боль, сыпь, снижение артериального давления, вялость, тошнота, беспокойство, тахикардия, ощущение сдавления в груди, головокружение, рвота, потливость) наблюдались редко и только в некоторых случаях привели к развитию тяжёлой анафилактической реакции (включая анафилаксию). В редких случаях наблюдался повышенный уровень температуры тела. В случае анафилактической или аллергической реакции необходимо прекратить введение препарата и немедленно сообщить врачу. Не можно полностью исключить возможность возникновения аллергических реакций после введения этого препарата. Пациенты с гемофилией А могут образовывать нейтрализующие антитела (ингибиторы) против фактора VIII. В случае возникновения таких ингибиторов наблюдается недостаточная клиническая реакция на лечение. В очень редких случаях у пациентов с болезнью Виллебранда, в частности типа 3, могут образовываться нейтрализующие антитела (ингибиторы) фактора Виллебранда. Если возникают такие ингибиторы, наблюдается недостаточная клиническая реакция на лечение. Ингибиторы могут влиять на увеличение риска возникновения аллергических реакций (анафилактического шока). В случае возникновения аллергических реакций необходимо провести исследования на наличие ингибиторов. В таких случаях рекомендуется обратиться в специализированный центр лечения нарушений гемостаза. При применении препарата у пациентов с болезнью Виллебранда с известными клиническими или лабораторными факторами риска возникновения тромбов существует опасность возникновения тромбозных осложнений. Удержание высокого уровня FVIII во время лечения фактором VIII, содержащим фактор Виллебранда, увеличивает риск возникновения тромбозных осложнений. Во время нескольких клинических исследований, проведённых с участием 164 пациентов, было введено в общей сложности 7000 инфузий FANHDI. Полученные результаты из обоих исследований указывают на хорошую переносимость препарата и низкую частоту возникновения нежелательных реакций. Зарегистрировано только 2 случая, в которых наблюдались нежелательные реакции, связанные с применением препарата. В этих случаях было зарегистрировано повышение температуры тела. Таблица нежелательных реакций Ниже приведена таблица категорий систем и органов (SOC и Preferred Term Level) в соответствии с классификацией MedDRA. Частота возникновения оценивалась по следующим критериям:
- очень часто (≥ 1/10)
- часто (≥ 1/100 до <1>
- не очень часто (≥ 1/1000 до <1>
- редко (≥ 1/10 000 до <1>
- очень редко (<1>
- неизвестна (частота не может быть определена на основе доступных данных).
В каждой категории частоты нежелательные реакции перечислены, начиная с наиболее тяжёлых до наиболее лёгких.
| Классификация систем и органов | Нежелательные реакции | Частота возникновения |
| Общие расстройства и состояния в месте введения | Повышенная температура тела. | Редко |
- 1.3.1. СПС, маркировка и листок-вкладыш
Дети и подростки
Частота возникновения, тип и тяжесть нежелательных реакций, ожидаемых у детей, не отличаются от тех, которые возникают у взрослых.
Сообщение о подозреваемых нежелательных реакциях
После разрешения препарата к применению важно сообщать о подозреваемых нежелательных реакциях. Это позволяет непрерывно мониторить соотношение пользы и риска применения препарата. Специалисты медицинского персонала должны сообщать о всех подозреваемых нежелательных реакциях через:
- Департамент мониторинга нежелательных реакций Управления по регистрации препаратов, медицинских изделий и биоцидных продуктов
- Ул. Ал. Ерозольимских, 181С
- 02-222 Варшава
- Тел.: +48 222 49 21 301
- Факс: +48 222 49 21 309
- Эл. почта: [email protected]
Благодаря сообщению о нежелательных реакциях можно собрать больше информации о безопасности применения препарата. Информация о мерах предосторожности от передачи инфекционных агентов см. в пункте 2.
5. КАК ХРАНИТЬ ПРЕПАРАТ FANHDI
Препарат должен храниться в месте, недоступном для детей. Не хранить при температуре выше 30 °C. Не замораживать. Не следует применять препарат после истечения срока годности. Раствор должен быть прозрачным и слегка опалесцирующим. Не использовать растворы, в которых出现ят хлопья или осадок. Не использовать, если в продукте после растворения видны частицы или раствор изменил цвет. После восстановления химическая и физическая стабильность продукта сохраняется в течение 12 часов при температуре 25 °C. С микробиологической точки зрения, продукт должен быть использован немедленно. Если после восстановления продукт не был использован, он может быть хранен не более 24 часов при температуре 2 °C – 8 °C, но только в том случае, если ответственность за это лежит на пользователе, и подготовка раствора была проведена в соответствии с правилами асептики. Препаратов не следует выбрасывать в канализацию. Необходимо спросить у фармацевта, как утилизировать препараты, которые больше не используются. Такое поведение поможет защитить окружающую среду.
Срок годности
3 года. Не следует применять препарат после истечения срока годности, указанного на этикетке.
6. СОДЕРЖАНИЕ УПАКОВКИ И ДРУГИЕ СВЕДЕНИЯ
Что содержит препарат FANHDI
Активное вещество - комплекс человеческого фактора свёртывания крови VIII и фактора Виллебранда. Каждая флакон с порошком содержит 1000 МЕ человеческого фактора свёртывания крови VIII и 1200 МЕ фактора Виллебранда. После растворения в 10 мл воды для инъекций продукт содержит 100 МЕ/мл FVIII и 120 МЕ/мл VWF. Другие компоненты - человеческий альбумин, гистидин и аргинин. Каждая шприц-ампула содержит 10 мл воды для инъекций.
Как выглядит препарат FANHDI и что содержит упаковка
Флакон с белым или светло-жёлтым порошком и шприц-ампула с водой для инъекций. Каждая упаковка FANHDI содержит флакон с 1000 МЕ человеческого фактора свёртывания крови VIII и 1200 МЕ фактора Виллебранда (порошок для инъекций и инфузий) и 1 шприц-ампулу с 10 мл воды для инъекций (растворитель). Набор для приготовления раствора и введения включён в упаковку FANHDI: соединительный элемент для флакона, фильтр и набор для инфузии. Доступные упаковки: FANHDI 250 МЕ FVIII + 300 МЕ VWF, FANHDI 500 МЕ FVIII + 1200 МЕ VWF. Не все упаковки могут находиться в обращении.
- 1.3.1. СПС, маркировка и листок-вкладыш
Ответственное лицо и производитель
Instituto Grifols, S.A. Can Guasc, 2 - Parets del Vallès, 08150 Barcelona, Испания. Для получения более подробной информации необходимо обратиться к местному представителю ответственного лица: Grifols Polska Sp. z o. o., Ул. Гжибовска, 87, 00-844 Варшава, Тел.: +48 22 378 85 61
Дата последнего обновления листка-вкладыша:
…………………………………………………………………………………………………
Информация, предназначенная исключительно для медицинских специалистов:
Дозировка
Дефицит фактора свёртывания крови VIII Дозировка и продолжительность заместительной терапии зависят от степени дефицита фактора VIII, местоположения и тяжести кровотечения, а также клинического состояния пациента. Введённая доза фактора VIII выражается в международных единицах (МЕ) в соответствии с текущими нормами ВОЗ, действующими для препаратов, содержащих человеческий фактор VIII. Активность фактора VIII в сыворотке может быть выражена в процентах (относительно активности в нормальной сыворотке) или в международных единицах (в соответствии с международным стандартом для фактора VIII в сыворотке). Одна международная единица (МЕ) активности фактора VIII соответствует количеству фактора VIII в 1 мл нормальной человеческой сыворотки. Лечение кровотечений Обоснование необходимой дозы фактора VIII основано на эмпирических наблюдениях, согласно которым введение 1 МЕ на кг массы тела увеличивает активность фактора VIII в сыворотке на 1,7% до 2,5% нормальной активности. Дозу рассчитывают на основе следующей формулы:
Необходимое количество единиц = масса тела (кг) х желаемый рост активности фактора VIII (%) (МЕ/дл) х 0,5
- 1.3.1. СПС, маркировка и листок-вкладыш
Размер доз и частота их введения должны быть всегда адаптированы индивидуально для каждого случая в зависимости от реакции пациента на лечение. При лечении кровотечений, в зависимости от их причины и местоположения, необходимо поддерживать в течение рекомендованного периода лечения соответствующий уровень активности фактора VIII (в % от нормы или МЕ/дл). При установлении дозы в зависимости от типа кровотечения и хирургической операции можно использовать следующую таблицу:
| Тяжесть кровотечения/тип хирургической операции | Необходимый уровень фактора VIII (%) (МЕ/дл) | Частота дозирования (часы)/продолжительность лечения (дни) |
| Кровотечение Świeże кровотечение в суставы, мышцы или кровотечение из полости рта. Более тяжёлое кровотечение в суставы, мышцы или гематома. Кровотечения, угрожающие жизни. |
| Повторять каждые 12-24 часа, не менее чем в течение 1 дня, до исчезновения боли, вызванной кровотечением, или заживления раны. Повторять инфузии каждые 12-24 часа в течение 3-4 дней или дольше, до исчезновения боли или нарушения функции. Повторять инфузии каждые 8-24 часа до исчезновения угрозы |
| Хирургические операции Меньшие Включая удаление зуба Более тяжёлые |
| Каждые 24 часа, не менее чем в течение 1 дня, до заживления раны. Повторять инфузии каждые 8-24 часа до достижения адекватного заживления раны, затем продолжить лечение в течение следующих 7 дней, поддерживая активность фактора VIII на уровне от 30% до 60% (МЕ/дл) |
Профилактическое лечение При длительной профилактике кровотечений у пациентов с тяжёлой формой гемофилии А обычно применяется доза от 20 до 40 МЕ на кг массы тела с интервалом 2-3 дня. В некоторых случаях, особенно у пациентов молодого возраста, может возникнуть необходимость сокращения интервала между инъекциями или увеличения дозы. Во время лечения для определения дозы и частоты введения инфузий рекомендуется соответствующее определение уровней фактора VIII в сыворотке. Особенно при проведении крупных хирургических операций необходимо тщательное мониторинг заместительной терапии с помощью исследований системы свёртывания крови (активность фактора VIII в сыворотке). Пациенты могут индивидуально реагировать на лечение фактором VIII, что отражается в различных уровнях восстановления in vivo и в различных периодах полувыведения у отдельных пациентов. Болезнь Виллебранда Обычно принимается, что введение 1 МЕ VWF:RCo на кг массы тела увеличивает уровень VWF:RCo на 2% в кровотоке. Цель лечения - достижение уровня VWF:RCo > 0,6 МЕ/мл (60%) и FVIII:C > 0,4 МЕ/мл (40%) в сыворотке. В большинстве случаев для достижения гемостаза рекомендуется доза 40-80 МЕ/кг массы тела фактора Виллебранда и 20-40 МЕ/кг массы тела фактора FVIII:C. Пациенты с болезнью Виллебранда типа 3, у которых для поддержания соответствующих уровней фактора может быть необходима более высокая доза, могут потребовать введения начальной дозы фактора Виллебранда 80 МЕ/кг массы тела. Подходящую дозу необходимо вводить каждые 12-24 часа. Дозировка и продолжительность лечения зависят от клинического состояния пациента, местоположения и тяжести кровотечения, а также уровня как VWF:RCo, так и FVIII:C. Во время применения препаратов, содержащих фактор VIII с фактором Виллебранда, лечащий врач должен учитывать возможность чрезмерного роста уровня FVIII:C. Для избежания чрезмерного роста уровня FVIII:C после 24-48 часов лечения необходимо рассмотреть возможность снижения дозы или продления интервала между последующими дозами или применение препаратов, содержащих VWF и меньшее количество фактора VIII. Дети и подростки В указанном показании доступны только ограниченные данные клинических исследований у детей моложе 6 лет, и поэтому нет рекомендаций по применению препарата в этой возрастной группе. У детей, как и у взрослых, дозу необходимо подбирать в зависимости от эффективности клинического лечения, основанного на расчёте дозы в зависимости от массы тела.
- Страна регистрации
- Активное вещество
- Требуется рецептДа
- Производитель
- ИмпортерInstituto Grifols, S.A.
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги ФангдиФорма выпуска: Порошок, 50 МЕ/мл; 500 МЕ + 60 МЕ/мл; 600 МЕАктивное вещество: Von Willebrand factor and coagulation factor VIII in combinationПроизводитель: Instituto Grifols S.A.Требуется рецептФорма выпуска: Порошок, 25 МЕ/мл; 250 МЕ + 30 МЕ/мл; 300 МЕАктивное вещество: Von Willebrand factor and coagulation factor VIII in combinationПроизводитель: Instituto Grifols S.A.Требуется рецептФорма выпуска: Порошок, 1000 МЕ + 2400 МЕ/15 млАктивное вещество: Von Willebrand factor and coagulation factor VIII in combinationПроизводитель: CSL Behring GmbHТребуется рецепт
Аналоги Фангди в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Фангди в Украина
Аналог Фангди в Испания
Врачи онлайн по Фангди
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Фангди – по решению врача и с учетом местных правил.














