WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Pergunte a um médico sobre a prescrição de WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Willfact 500UI pó e solvente para solução injetável
Willfact 1000UIpó e solvente para solução injetável
Willfact 2000UIpó e solvente para solução injetável
fator de von Willebrand humano
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Willfact e para que é utilizado
- O que precisa saber antes de começar a usar Willfact
- Como usar Willfact
- Efeitos adversos possíveis
- Conservação de Willfact
- Conteúdo do envase e informações adicionais
1. O que é Willfact e para que é utilizado
Willfact é obtido a partir de plasma humano (a parte líquida do sangue) e é um medicamento que contém o princípio ativo chamado fator de von Willebrand (FVW).
FVW intervém na coagulação do sangue. A falta deste fator, como ocorre na doença de von Willebrand, significa que o sangue não coagula tão rapidamente como deveria, por isso há uma maior tendência a sangrar. A substituição do VWF por Willfact reparará temporariamente os mecanismos de coagulação do sangue.
Willfact está indicado na prevenção e no tratamento de hemorragias quirúrgicas ou de outro tipo em pacientes com a doença de von Willebrand quando o tratamento com desmopressina (DDAVP) sozinho não é eficaz ou está contraindicado.
Willfact pode ser usado em todos os grupos etários.
Willfact não deve ser usado como tratamento da Hemofilia A.
2. O que precisa saber antes de começar a usar Willfact
Não useWillfact
- se é alérgico ao fator de von Willebrand humano ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se padece HemofiliaA.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Willfact.
O tratamento com Willfact deve estar sempre supervisionado por um médicocom experiência no tratamento de distúrbios da hemostasia.
Se apresentar uma hemorragia severa e um exame de sangue indicar que o valor de fator VIII no sangue está baixo, receberá o preparado de FVW além de um preparado de fator VIII nas primeiras 12 horas.
Reações alérgicas
Assim como sucede com todas as proteínas derivadas do sangue ou do plasma humanos que se administram por via intravenosa, podem ocorrer reações de hipersensibilidade em forma de alergia. Durante a injeção, será monitorizado para detectar qualquer sinal precoce de hipersensibilidade. Isso inclui, erupção (borbulhas ou urticária generalizada), opressão no peito, dificuldade respiratória, tensão arterial baixa (hipotensão) e reações alérgicas graves (anafilaxia).
O seu médico o informará dos sinais de alarme de uma reação alérgica.
Em caso de que apareçam sinais ou sintomas de hipersensibilidade, deve interromper o tratamento e solicitar atenção médica imediata.
Segurança face a vírus
Quando os medicamentos são elaborados a partir de sangue ou plasma humanos, são tomadas certas medidas para evitar que se transmitam infecções aos pacientes. Entre elas se incluem:
- Uma cuidadosa seleção dos doadores de sangue e plasma para se assegurar de que se excluem aqueles com risco de ser portadores de infecções,
- Análise de cada doação e dos grupos de plasma para detectar sinais de vírus/infecções,
- Inclusão de passos no processamento do sangue ou do plasma que possam inativar ou eliminar os vírus.
Apesar destas medidas, quando se administram medicamentos preparados a partir de sangue ou plasma humanos, não pode ser excluída totalmente a possibilidade de transmitir a infecção. Isso também se aplica a qualquer vírus desconhecido ou emergente ou a outros tipos de infecções.
As medidas adotadas são consideradas eficazes para os vírus com envoltura, como o vírus da imunodeficiência humana (VIH-SIDA), o vírus da hepatite B e o vírus da hepatite C.
As medidas adotadas podem ter um valor limitado contra os vírus não envueltos, como o vírus da hepatite A e o parvovirus B19. A infecção por parvovirus B19 pode ser grave para as mulheres grávidas (já que existe risco de infecção do feto) e para as pessoas cujo sistema imunológico está deprimido ou que padecem alguns tipos de anemia (por exemplo, anemia falciforme ou anemia hemolítica).
Vacinas
O seu médico pode recomendar que considere a vacinação contra a hepatite A e B se receber regularmente/repetidamente fator von Willebrand derivado de plasma humano.
Registo do número do lote
Recomenda-se encarecidamente que cada vez que receber uma dose de Willfact, se anote o nome e o número do lote do medicamento para manter um registo dos lotes utilizados.
Risco de trombose
Os coágulos de sangue (trombose) também podem obstruir os vasos sanguíneos. Existe o risco especialmente se a sua história clínica anterior ou os resultados das análises indicam que tem certos fatores de risco. Neste caso, será vigilado estreitamente para detectar qualquer sinal precoce de trombose, e receberá um tratamento preventivo (profilaxia) contra a obstrução das veias devido aos coágulos de sangue.
Quando se usa um produto de fator de von Willebrand que contém fator VIII, o médico deverá ter em conta que o tratamento contínuo pode produzir um aumento excessivo do FVIII. Se receber um produto de FVW que contém FVIII, o médico controlará periodicamente os níveis plasmáticos de FVIII. Desta forma, garante-se que não se produz um excesso sustentado dos níveis plasmáticos de FVIII, o que poderia aumentar o risco de eventos trombóticos.
Eficácia limitada
É possível que, nos pacientes com doença de von Willebrand, especialmente os pacientes com o Tipo 3, se formem proteínas que neutralizam o efeito do FVW. Estas proteínas são chamadas anticorpos neutralizantes ou inibidores. Se os resultados de laboratório mostram que os seus níveis de FVW não se estão repondo ou se a hemorragia não se detém apesar da administração de uma dose adequada de Willfact, o seu médico comprovará se o seu organismo desenvolveu inibidores do FVW.
Se houver presença destes inibidores em uma concentração alta, o tratamento com FVW pode não ser eficaz, e deverão ser consideradas outras opções de tratamento. O novo tratamento será administrado por um médico com experiência no tratamento de distúrbios da hemostasia.
Outros medicamentos e Willfact
Informa o seu médico ou farmacêutico se está utilizando, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez e lactação
Não deve utilizar Willfact durante a gravidez ou a lactação a menos que esteja claramente indicado.
Não foi estudada a segurança de Willfact durante a gravidez e a lactação em estudos clínicos controlados. Os estudos realizados em animais são insuficientes para estabelecer a segurança com respeito à fertilidade, gravidez e desenvolvimento do filho durante a gravidez e após o nascimento.
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Condução e uso de máquinas
Não se observaram efeitos sobre a capacidade para conduzir e utilizar máquinas.
Willfact contémsódio
Um frasco de 5 ml (500 UI) de Willfact contém 0,15 mmol (3,4 mg) de sódio.
Isso equivale a 0,17 % da ingestão diária máxima recomendada de sódio para um adulto.
Um frasco de 10 ml (1000 UI) de Willfact contém 0,3 mmol (6,9 mg) de sódio.
Isso equivale a 0,35 % da ingestão diária máxima recomendada de sódio para um adulto.
Um frasco de 20 ml (2000 UI) de Willfact contém 0,6 mmol (13,8 mg) de sódio.
Isso equivale a 0,69 % da ingestão diária máxima recomendada de sódio para um adulto.
3. Como usar Willfact
O seu tratamento deverá ser iniciado e monitorizado por um médico com experiência no tratamento de distúrbios hemorrágicos.
Se o seu médico considerar que a administração pode ser realizada no seu domicílio, fornecer-lhe-á as instruções adequadas.
Posologia
Tome sempre este medicamento exatamente como lhe foi indicado pelo médico. Se não tiver certeza, consulte o seu médico.
Preferencialmente, Willfact deve ser administrado pelo seu médico ou enfermeira. No entanto, se lhe foi prescrito Willfact para que o administre em casa, o seu médico assegurará que lhe ensine como injetá-lo e quanto deve utilizar. Siga as instruções que lhe der o médico e peça ajuda se tiver problemas para manejar a seringa; esta deve ser utilizada sempre por uma pessoa capacitada para isso.
O seu médico calculará a sua dose de Willfact (em unidades internacionais ou UI).
A dose que lhe será administrada dependerá de:
- Peso corporal,
- Local da hemorragia,
- Intensidade da hemorragia,
- Estado clínico,
- Cirurgia requerida,
- Níveis de atividade do FVW no seu sangue após a cirurgia,
- Gravidade da sua doença
Esta dose varia entre 40 a 80 UI/kg.
O seu médico recomendará que se submeta a análises de sangue durante o tratamento para controlar
- os níveis de fator VIII (FVIII:C),
- os níveis do fator von Willebrand (FVW:Rco),
- a presença de inibidores,
- sinais preliminares de formação de coágulos se corre o risco de sofrer tais complicações.
Com base nos resultados destes exames, o seu médico pode decidir adaptar a dose e a frequência das suas injeções.
Em certos casos, pode ser necessário utilizar um preparado de fator VIII (outra proteína de coagulação) além de Willfact para tratar ou prevenir mais rapidamente as hemorragias (em situações de emergência ou hemorragias agudas).
Willfact pode ser administrado como profilaxia a longo prazo; o nível de dose também se determina de forma individual neste caso. As doses entre 40 e 60 UI/kg de Willfact, administradas duas ou três vezes por semana, reduzem o número de episódios hemorrágicos.
Uso em crianças e adolescentes
A dose para crianças e adolescentes baseia-se no peso corporal. Em alguns casos, especialmente nos pacientes mais jovens (de menos de 6 anos), podem ser necessárias doses mais altas (de até 100 UI/kg).
Informa o seu médico se acredita que o efeito de Willfact é demasiado forte ou demasiado fraco.
Método de administração
As instruções detalhadas para a reconstituição e administração do medicamento figuram no final do prospecto.
Se usar maisWillfactdo que deve
Não se descreveram sintomas de sobredose com Willfact.
No entanto, não pode ser descartado o risco de trombose no caso de uma sobredosificação importante.
Se esquecer de utilizar Willfact
Se esquecer de tomar WILLFACT, consulte o seu médico.
Não tome uma dose dupla para compensar a dose esquecida.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
Em caso de sobredose ou ingestão acidental, consulte o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone 91 562 04 20, indicando o medicamento e a quantidade ingerida.
4. Efeitos adversos possíveis
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Entre em contacto com o seu médico imediatamente se:
- Nota sintomas de hipersensibilidade ou reações alérgicas (observado com pouca frequência: pode afetar 1 de cada 100 pessoas).
Em alguns casos, estas reações podem evoluir para uma reação alérgica grave (anafilaxia) incluindo choque anafiláctico (observado com uma frequência desconocida).
Os sinais de alarme das reações alérgicas são
- Dificuldade para respirar e engolir
- Sibilâncias
- Opressão no peito
- Aumento da frequência cardíaca
- Diminuição ou queda da tensão arterial
- Desmaio
- Fadiga extrema
- Inquietude, nervosismo
- Dor de cabeça
- Arrepios, sensação de frio
- Rubor, sofocos
- Inchaço em diferentes partes do corpo
- Erupção cutânea, urticária generalizada
- Ardor e picadura no local de infusão
- Formigamento
- Vómitos
- Náuseas
Se se produzir um destes efeitos, interrompa o tratamento imediatamente e entre em contacto com o seu médicopara iniciar um tratamento adequado segundo o tipo e a gravidade da reação. |
- Nota que o medicamento deixa de funcionar corretamente (a hemorragia não se controla). Isso pode dever-se à inibição do fator de von Willebrand (observada com uma frequência desconocida).
Nos pacientes com doença de von Willebrand, especialmente nos de tipo 3, podem formar-se proteínas que neutralizam o efeito do FvW. Estas proteínas são denominadas anticorpos neutralizantes ou inibidores. Os pacientes tratados com FvW devem ser controlados cuidadosamente pelos seus médicos para detectar a aparência de inibidores mediante observações clínicas e exames de laboratório adequados. Se se produzirem tais inibidores, a afecção pode manifestar-se como uma resposta clínica inadequada ou ocorrer concomitantemente a reações alérgicas graves.
- Nota algum sintoma de deterioração da perfusão nas extremidades (por exemplo, extremidades frias e pálidas) ou nos órgãos vitais (por exemplo, dor torácica intensa). Isso pode dever-se à formação de coágulos sanguíneos nos vasos sanguíneos (observados com uma frequência desconocida).
Existe risco de formação de coágulos sanguíneos (trombose), especialmente em pacientes com fatores de risco conhecidos. Após a correção da deficiência do fator von Willebrand, deve ser vigilado para detectar sinais precoces de trombose ou coagulação intravascular disseminada e receber tratamento para prevenir a trombose em situações que impliquem um maior risco de trombose (após operações, durante o confinamento na cama, em casos de deficiência de um inibidor da coagulação ou de uma enzima fibrinolítica).
Se receber preparados de FVIII que contêm FVW, o risco de trombose também pode aumentar devido aos níveis plasmáticos de FVIII persistentemente elevados.
Observou-se o seguinte efeito adverso frequentemente(pode afetar até 1 de cada 10 pessoas):
- Reações no ponto de infusão
Os seguintes efeitos adversos foram observados com pouca frequência(pode afetar até 1 de cada 100 pessoas):
- Tonturas
- Parestesia, hipoestesia
- Sofoco
- Coceira
- Sensação de opressão
- Arrepios, sensação de frio
O seguinte efeito adversofoi observado com uma frequência não conhecida:
- Febre
Comunicação de efeitos adversos:
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Willfact
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta do frasco e no envase.
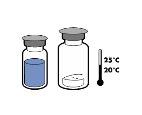
Não conserve a uma temperatura superior a + 25°C. Conservar no envase original para protegê-lo da luz.
Não congelar.
Por razões de esterilidade, o produto deve ser utilizado imediatamente após a reconstituição física e química. Estabilidade físico-química, no entanto, foi demonstrada após 24 horas a +25ºC.
Não utilize este medicamento se observar que a solução está turva ou contém depósitos.
Os medicamentos não devem ser jogados fora pelos esgotos nem para o lixo. Pergunte ao seu farmacêutico ou enfermeiro como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deWillfact
- O princípio ativoé: fator de von Willebrand humano (500 UI, 1000 UI ou 2000 UI), expresso em Unidades Internacionais (UI) de atividade do cofator de ristocetina (FVW:RCo).
Após a reconstituição com 5 ml (500 UI), 10 ml (1000 UI) ou 20 ml (2000 UI) de água para preparações injetáveis, um frasco contém aproximadamente 100 UI/ml de fator de von Willebrand humano.
Antes de adicionar a albumina, a atividade específica é maior ou igual a 60 UI de FVW:RCo/mg de proteína total.
- Os demais componentessão:
Pó: albumina humana, cloreto de arginina, glicina, citrato de sódio e cloreto de cálcio diidratado.
Veículo: água para preparações injetáveis.
Aspecto do produtoe conteúdo do envase
Willfact é apresentado como pó ou sólido desmenuzável branco ou amarelo pálido e um veículo transparente ou incolor para solução injetável após a reconstituição com um sistema de transferência.
Willfact está disponível em envases de 500 UI/5 ml, 1000 UI/10 ml e 2000 UI/20 ml.
A solução reconstituída deve ser transparente ou ligeiramente opalescente, incolor ou ligeiramente amarela.
Título da autorização de comercialização
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 Les Ulis
FRANÇA
Responsável pela fabricação
LFB BIOMEDICAMENTS
3, Avenue des Tropiques, BP 305 - Les Ulis, Courtaboeuf - F-91958 – França
ou
LFB BIOMEDICAMENTS
59 Rue de Trevise. BP 2006 - Lille - F-59011 - França
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
LFB BIOTERAPIAS HISPANIA,S.L.
C/ Diego de León 47
28006 Madrid
(Espanha)
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Áustria Willfact
República Checa WILLFACT
Dinamarca Willfact
Alemanha WILLFACT
Hungria Willfact
Noruega Willfact
Polônia Willfact
República Eslovaca Willfact
Espanha Willfact
Suécia Willfact
Reino Unido (Irlanda do Norte) Willfact
Data da última revisão deste prospecto:Março 2024
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
_____________________________________________________________________________
INSTRUÇÕES DE USO:
Posologia
Em geral, a administração de uma UI/kg de fator de von Willebrand eleva o nível circulante de FvW:RCo em aproximadamente 0,02 UI/mL (2%).
Deve-se alcançar níveis de VWF:RCo de > 0,6 UI/mL (60%) e de FVIII:C de > 0,4 UI/mL (40%).
A hemostasia não pode ser garantida até que a atividade coagulante do fator VIII (FVIII:C) tenha alcançado 0,4 UI/ml (40%). A injeção de fator von Willebrand por si só não induz um aumento máximo de FVIII:C até passadas pelo menos 6 a 12 horas. Não pode corrigir imediatamente o nível de FVIII:C. Portanto, se os níveis basais de FVIII:C do paciente estão abaixo deste nível crítico, em todas as situações em que se requer uma correção rápida da hemostasia, como o tratamento de uma hemorragia, um traumatismo grave ou uma intervenção cirúrgica de urgência, deve ser administrado fator VIII com a primeira injeção de fator de von Willebrand para alcançar um nível plasmático hemostático de FVIII:C.
No entanto, se não for necessário um aumento imediato de FVIII:C, como no caso de uma intervenção cirúrgica programada, ou se os níveis basais de FVIII:C forem suficientes para garantir a hemostasia, o médico pode decidir prescindir da coadministração de FVIII para a primeira injeção de fator de von Willebrand.
- Início do tratamento:
A primeira dose de WILLFACT é de 40 a 80 UI/kg para o tratamento de hemorragias ou traumatismos, juntamente com a quantidade necessária de produto de fator VIII, calculada com base no nível plasmático basal de FVIII:C do paciente, a fim de alcançar um nível plasmático adequado de FVIII:C imediatamente antes da intervenção ou o mais rápido possível após o início do episódio hemorrágico ou traumatismo grave. No caso de cirurgia, a primeira injeção deve ser administrada 1 hora antes da intervenção.
Pode ser necessária uma dose inicial de 80 UI/kg de WILLFACT, especialmente em pacientes com doença de von Willebrand de tipo 3, nos quais a manutenção de níveis adequados pode requerer doses mais altas do que em outros tipos de EVW.
No caso de cirurgia eletiva, a primeira injeção de WILLFACT deve ser administrada entre 12 e 24 horas antes da intervenção e a segunda antes da mesma. Nesses casos, não é necessária a administração conjunta de um produto de fator VIII, pois o FVIII:C endógeno geralmente alcançou o nível crítico de 0,4 UI/mL (40%) antes da intervenção. No entanto, isso deve ser confirmado em cada paciente.
- Injeções posteriores:
Se necessário, o tratamento deve continuar com 40 a 80 UI/kg de WILLFACT apenas ao dia, em uma ou duas injeções diárias durante um ou vários dias. A dose e a frequência das injeções devem ser adaptadas sempre ao tipo de intervenção cirúrgica, ao estado clínico e biológico do paciente (VWF:RCo e FVIII:C) e ao tipo e gravidade do episódio hemorrágico.
- Profilaxia a longo prazo:
WILLFACT pode ser administrado como profilaxia a longo prazo, a doses adaptadas a cada paciente. Doses de WILLFACT de 40 a 60 UI/kg, administradas de 2 a 3 vezes por semana, reduzem o número de episódios hemorrágicos.
- Tratamento ambulatorial:
O tratamento domiciliar pode ser iniciado com a aprovação do médico, especialmente em casos de hemorragias leves a moderadas ou durante a profilaxia a longo prazo para prevenir hemorragias.
- População pediátrica
Para cada indicação, a dose é baseada no peso corporal. A dose e a duração do tratamento devem ser ajustadas com base no estado clínico do paciente e seus níveis plasmáticos de FVIII:C e FVW:Rco.
- Início do tratamento:
- Para menores de 6 anos de idade, a dose inicial pode ser guiada pela recuperação incremental (RI) do paciente ou, se não houver dados disponíveis de RI, pode ser necessária uma dose inicial de entre 60 e 100 UI/kg com o objetivo de elevar os níveis de FVW:Rco a 100 UI/dl.
- No caso de crianças maiores de 6 anos de idade e adolescentes, a posologia é a mesma que para os pacientes adultos.
- Injeções posteriores:
Para as crianças e os adolescentes, as doses posteriores devem ser individualizadas com base no estado clínico e nos níveis de FVW:Rco, e ajustadas de acordo com a resposta clínica.
Quando existir uma intervenção cirúrgica programada:
- Em menores de 6 anos, após uma primeira dose administrada de 12 a 24 horas antes da intervenção, a dose repetida pode ser administrada 30 minutos antes da intervenção.
- No caso de crianças maiores de 6 anos de idade e adolescentes, a posologia é a mesma que para os pacientes adultos.
- Profilaxia:
Para as crianças e os adolescentes, a dose e a frequência de administrações posteriores devem ser individualizadas com base na recuperação incremental do paciente e nos níveis de FVW:Rco, e ajustadas de acordo com a resposta clínica.
Via e rota de administração
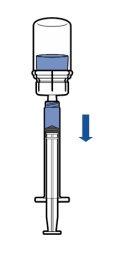
Administração intravenosa
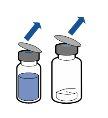
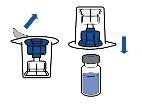
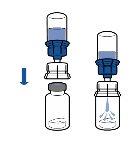
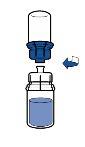
Reconstituição:
Devem ser seguidas as diretrizes atualmente vigentes para procedimentos assépticos. O sistema de transferência será utilizado apenas para reconstituir o medicamento, como descrito a seguir. Não está concebido para administrar o medicamento ao paciente.
|
|
O pó geralmente se dissolve instantaneamente e deve se dissolver em menos de 10 minutos.
A solução deve ser transparente ou pouco opalescente, incolor ou amarelo claro. O produto reconstituído deve ser inspecionado visualmente em busca de partículas e decoloração antes de sua administração.
Não utilizar soluções que estejam turvas ou apresentem sedimentos.
Não misturar com outros medicamentos.
Não diluir o produto reconstituído.
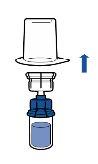
Administração:
|
|
Conservação após a reconstituição
Por razões de esterilidade, o produto deve ser utilizado imediatamente após a reconstituição. No entanto, demonstrou-se sua estabilidade física e química após 24 horas a +25°C.
A eliminação dos produtos não utilizados ou dos envases será realizada de acordo com as exigências locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 100 UI/mlSubstância ativa: von Willebrand factorFabricante: Lfb BiomedicamentsRequer receita médicaForma farmacêutica: INJETÁVEL, 100 UI/mlSubstância ativa: von Willebrand factorFabricante: Lfb BiomedicamentsRequer receita médicaForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica
Alternativas a WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Médicos online para WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de WILLFACT 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.