
Uillfact 1000 i.m.
Pergunte a um médico sobre a prescrição de Uillfact 1000 i.m.

Como usar Uillfact 1000 i.m.
BULA DO PACOTE: INFORMAÇÃO PARA O UTILIZADOR
Willfact 500 j.m.
pó e solvente para solução injectável
Willfact 1000 j.m. pó e solvente para solução injectável
Willfact 2000 j.m. pó e solvente para solução injectável
fator de von Willebrand humano
Deve ler atentamente o conteúdo da bula antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve conservar esta bula, para que possa relê-la novamente se necessário.
- Em caso de alguma dúvida, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outras pessoas, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados nesta bula, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice da bula
- 1. O que é o medicamento Willfact e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Willfact
- 3. Como tomar o medicamento Willfact
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Willfact
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Willfact e para que é utilizado
O medicamento Willfact é produzido a partir de plasma humano (parte líquida do sangue) e contém a substância ativa fator de von Willebrand humano (vWF).
O fator vWF participa na coagulação do sangue. A falta deste fator, como no caso da doença de von Willebrand, faz com que o sangue não coagule tão rapidamente como deveria, resultando numa tendência aumentada para sangramentos. A substituição do vWF pelo medicamento Willfact corrige temporariamente os mecanismos de coagulação do sangue.
O medicamento Willfact é indicado para prevenir sangramentos associados a procedimentos cirúrgicos e outros sangramentos, bem como para tratar esses sangramentos em pacientes com diagnóstico de doença de von Willebrand, se o tratamento apenas com desmopressina (DDAVP) for ineficaz ou contraindicado.
O medicamento Willfact pode ser utilizado em todas as faixas etárias.
2. Informações importantes antes de tomar o medicamento Willfact
Quando não tomar o medicamento Willfact
- Se o paciente tiver alergia ao fator de von Willebrand humano ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
- Se o paciente tiver hemofilia tipo A.
Precauções e advertências
O tratamento com o medicamento Willfact deve ser sempre supervisionado por um médico com experiência no tratamento de distúrbios de coagulação.
Se o paciente apresentar sangramentos graves e os exames de sangue confirmarem uma redução na quantidade de fator VIII, o paciente receberá um preparado de fator de coagulação VIII e um preparado de vWF nas primeiras 12 horas.
Reações alérgicas
Podem ocorrer reações de sensibilidade de caráter alérgico, assim como após a administração de outros medicamentos proteicos intravenosos obtidos a partir de sangue ou plasma humano.
O paciente será monitorizado durante a injeção para detectar sinais precoces de sensibilidade.
Estes incluem erupções cutâneas (urticária ou urticária generalizada), sensação de pressão no peito, respiração sibilante, redução da pressão arterial (hipotensão) e reações alérgicas graves (anafilaxia).
O médico informará o paciente sobre os sinais de alerta que indicam a ocorrência de uma reação alérgica.
Em caso de ocorrência de sintomas objetivos ou subjetivos de sensibilidade, deve-se interromper o tratamento e procurar imediatamente ajuda médica.
Segurança viral
Na produção de medicamentos a partir de sangue ou plasma humano, são tomadas certas medidas para prevenir a transmissão de infecções para os pacientes. Estas incluem:
- seleção rigorosa de doadores de sangue e plasma, permitindo excluir pessoas em grupos de risco de infecção,
- teste de cada lote e pool de plasma para detectar a presença de vírus/infecções,
- introdução de etapas no processo de tratamento do sangue ou plasma para inativar ou remover vírus.
Apesar da implementação dessas medidas, durante a administração de medicamentos produzidos a partir de sangue ou plasma humano, não é possível excluir completamente a possibilidade de transmissão de infecção. Isso se aplica também a vírus ou infecções desconhecidos ou emergentes.
As medidas tomadas são consideradas eficazes no caso de vírus envelopados, como o vírus da imunodeficiência humana (HIV, que causa a AIDS), vírus da hepatite B e vírus da hepatite C.
As medidas têm um valor limitado no caso de vírus não envelopados, como o vírus da hepatite A e parvovirus B19. A infecção por parvovirus B19 pode ser grave em casos de mulheres grávidas (pois há um risco de infecção do feto) e pacientes com sistema imunológico debilitado ou certos tipos de anemia (como anemia falciforme ou anemia hemolítica).
Vacinação
O médico pode recomendar que o paciente receba vacinas contra a hepatite A e B, se o paciente receber regularmente/preparados de fator de von Willebrand humano a partir de plasma.
Registo do número de lote
É fortemente recomendado que, ao administrar cada dose do medicamento Willfact, sejam registrados o nome do paciente e o número de lote do medicamento, para documentar quais os lotes do medicamento que foram administrados.
Risco de trombose
Pode ocorrer o bloqueio de vasos sanguíneos por coágulos de sangue (trombose). O risco é particularmente alto se houver fatores de risco identificados no histórico médico ou exames laboratoriais. Nesse caso, o estado do paciente será cuidadosamente monitorizado para detectar sinais precoces de trombose. Além disso, deve-se administrar medicamentos para prevenir o bloqueio de vasos sanguíneos por coágulos de sangue (profilaxia).
O médico que administra o fator de coagulação VIII contendo o fator de von Willebrand deve lembrar que a continuação do tratamento pode causar um aumento excessivo da atividade do fator VIII. Se o paciente receber um preparado de vWF contendo o fator de coagulação VIII, o médico deve monitorar regularmente a atividade do fator VIII no plasma. Isso protegerá o paciente de uma atividade excessiva do fator VIII no plasma, que pode aumentar o risco de ocorrência de eventos trombóticos.
Limitação da eficácia
Em pacientes com doença de von Willebrand (particularmente tipo 3), podem ocorrer a formação de proteínas que neutralizam a ação do fator de von Willebrand. Essas proteínas são chamadas de anticorpos neutralizantes ou inibidores. O médico verificará se o paciente desenvolveu inibidores do vWF, se os resultados dos exames laboratoriais mostrarem uma falta de restauração adequada dos níveis de vWF ou se os sangramentos não diminuírem apesar da administração da dose adequada do medicamento Willfact. Se houver uma grande quantidade de inibidores, o tratamento com o vWF pode não ser eficaz. Nesses casos, deve-se considerar outras opções de tratamento. Um novo tratamento será realizado por um médico com experiência no tratamento de distúrbios de coagulação.
Willfact e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está tomando atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar.
Gravidez e amamentação
O medicamento Willfact pode ser utilizado em mulheres grávidas ou em aleitamento materno apenas se for claramente necessário.
Não foram realizados estudos clínicos controlados para avaliar a segurança do uso do medicamento Willfact em mulheres grávidas e em aleitamento materno, e os estudos em animais não são suficientes para confirmar a segurança do uso em relação à fertilidade, gravidez e desenvolvimento do feto durante a gravidez e após o parto.
Se a paciente estiver grávida ou em aleitamento materno, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
Condução de veículos e operação de máquinas
Não foi observado qualquer efeito na capacidade de conduzir veículos ou operar máquinas.
Willfact contém sódio
Uma ampola de 5 ml (500 j.m.) do medicamento Willfact contém 0,15 mmol (3,4 mg) de sódio.
Isso corresponde a 0,17% do consumo diário máximo recomendado de sódio para um adulto.
Uma ampola de 10 ml (1000 j.m.) do medicamento Willfact contém 0,3 mmol (6,9 mg) de sódio.
Isso corresponde a 0,35% do consumo diário máximo recomendado de sódio para um adulto.
Uma ampola de 20 ml (2000 j.m.) do medicamento Willfact contém 0,6 mmol (13,8 mg) de sódio.
Isso corresponde a 0,69% do consumo diário máximo recomendado de sódio para um adulto.
3. Como tomar o medicamento Willfact
O tratamento deve ser iniciado e monitorizado por um médico com experiência no tratamento de distúrbios hemorrágicos.
Se o médico considerar que o paciente pode administrar o medicamento em casa, instruirá o paciente adequadamente.
Dosagem
Este medicamento deve ser sempre administrado de acordo com as recomendações do médico. Em caso de dúvida, deve-se consultar o médico.
É recomendável que o medicamento Willfact seja administrado por um médico ou enfermeiro. No entanto, se o paciente receber o medicamento Willfact para uso em casa, o médico garantirá que o paciente seja informado sobre como realizar a injeção e a dose correta do medicamento. Deve-se seguir as recomendações do médico e pedir ajuda em caso de problemas com a seringa. A seringa só pode ser usada por uma pessoa treinada.
O médico calculará a dose correta do medicamento Willfact (expressa em unidades internacionais - j.m.).
A dose depende de:
- peso corporal,
- local do sangramento,
- gravidade do sangramento,
- estado clínico do paciente,
- necessidade de realizar um procedimento,
- atividade do vWF no sangue após o procedimento,
- gravidade da doença.
A dose está dentro da faixa de 40–80 j.m./kg de peso corporal.
O médico recomendará a realização de exames de sangue durante o tratamento para:
- concentração do fator VIII (FVIII:C),
- concentração do fator de von Willebrand (vWF:RCo),
- presença de inibidores,
- sinais iniciais de formação de coágulos - em pacientes em grupo de risco para essas complicações.
Com base nos resultados desses exames, o médico pode ajustar a frequência das injeções e a dose administrada.
Em alguns casos, pode ser necessário o uso de um preparado de fator VIII (outro proteína com ação coagulante) em adição ao medicamento Willfact, para permitir um tratamento mais rápido ou prevenir o sangramento (em situações de emergência ou em caso de sangramento agudo).
O medicamento Willfact também pode ser utilizado em profilaxia de longo prazo, e a dose também é determinada individualmente. A administração do medicamento Willfact na dose de 40–60 j.m./kg de peso corporal, 2-3 vezes por semana, reduz o número de episódios de sangramento.
Se o paciente achar que o medicamento Willfact está funcionando muito forte ou muito fraco, deve consultar o médico.
Uso em crianças e adolescentes
A dosagem em crianças e adolescentes é baseada no peso corporal. Em alguns casos, particularmente em pacientes mais jovens (abaixo de 6 anos), pode ser necessário o uso de doses mais altas (até 100 j.m./kg de peso corporal).
Método de administração
As instruções detalhadas para a reconstituição e administração do produto medicamentoso estão no final da bula.
Uso de dose maior do que a recomendada do medicamento Willfact
Não foram relatados sinais de superdose do medicamento Willfact, no entanto, em caso de administração de uma grande quantidade, não é possível excluir o risco de trombose.
Omissão da administração do medicamento Willfact
Em caso de omissão da administração do medicamento Willfact, deve-se consultar o médico.
Não se deve administrar uma dose dupla para compensar a dose omitida.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve-se consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não todos os pacientes os apresentem.
Deve entrar em contato imediatamente com o médico nos seguintes casos:
- Ocorrência de sinais de sensibilidade ou reações alérgicas (observadas com frequência não muito alta, podem afetar até 1 em 100 pacientes). Em alguns casos, essas reações podem evoluir para uma reação alérgica grave (anafilaxia), incluindo choque anafilático (com frequência desconhecida).
Os sinais de alerta que indicam a ocorrência de uma reação alérgica incluem:
- dificuldade para respirar e engolir,
- respiração sibilante,
- pressão no peito,
- aumento da frequência cardíaca,
- queda da pressão arterial,
- desmaio,
- cansaço extremo,
- ansiedade, nervosismo,
- dor de cabeça,
- calafrios, sensação de frio,
- ondas de calor,
- inchaço de várias partes do corpo,
- erupções cutâneas, urticária generalizada,
- sensação de queimadura e picada no local da injeção,
- formigamento,
- vômitos,
- náuseas.
Se ocorrer um desses sinais, deve-se interromper imediatamente o tratamento e informar o médico, para que possa iniciar o tratamento adequado, dependendo do tipo e gravidade da reação.
- Observação da perda de eficácia do medicamento (falta de controle do sangramento). Isso pode ser devido à inibição do fator de von Willebrand (com frequência desconhecida).
Em pacientes com doença de von Willebrand, particularmente tipo 3, é possível a formação de proteínas que neutralizam a ação do vWF. Essas proteínas são chamadas de anticorpos neutralizantes ou inibidores. Os pacientes tratados com o vWF devem ser monitorados cuidadosamente pelo médico para detectar a ocorrência de inibidores por meio de observação clínica adequada e realização de exames laboratoriais. Em caso de ocorrência de inibidores, o estado pode se manifestar como uma resposta clínica inadequada. Também pode coexistir com reações alérgicas graves.
- Observação de sinais de distúrbios circulatórios nos membros (por exemplo, membros frios e pálidos) ou órgãos vitais (por exemplo, dor intensa no peito). Isso pode ser devido à formação de coágulos de sangue nos vasos sanguíneos (com frequência desconhecida).
Existe um risco de formação de coágulos de sangue (trombose), especialmente em pacientes em grupo de risco. Após a correção da deficiência do fator de von Willebrand, os pacientes devem ser monitorados para detectar sinais precoces de trombose ou coagulação intravascular disseminada e receber tratamento para prevenir a trombose em situações em que o risco de ocorrência é aumentado (após procedimentos, em pacientes acamados, em caso de deficiência de inibidor de coagulação ou enzima fibrinolítica).
Se o paciente receber preparados de vWF contendo o fator VIII, o risco de trombose pode ser maior devido às concentrações persistentemente elevadas de fator VIII no plasma.
Os seguintes efeitos não desejados foram observados com frequência(podem afetar até 1 em 10 pacientes):
- reações no local da injeção.
Os seguintes efeitos não desejados foram observados com frequência não muito alta(podem afetar até 1 em 100 pacientes):
- tontura,
- parestesia, anestesia,
- ondas de calor,
- coceira,
- pressão no peito,
- calafrios, sensação de frio.
Os seguintes efeitos não desejados foram observados com frequência desconhecida:
- febre.
Notificação de efeitos não desejados
Se ocorrerem qualquer efeitos não desejados, incluindo quaisquer efeitos não desejados não mencionados na bula, deve-se informar o médico ou farmacêutico, ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Medicamentosos da Agência Reguladora de Produtos Medicamentosos:
Rua Jerozolimskie, 181C
02-222 Varsóvia
Telefone: +48 22 49 21 301
Fax: +48 22 49 21 309
Site: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao responsável pelo medicamento.
A notificação de efeitos não desejados permitirá reunir mais informações sobre a segurança do uso do medicamento.
5. Como conservar o medicamento Willfact
O medicamento deve ser conservado em um local não visível e inacessível a crianças.
Não use este medicamento após a data de validade impressa na etiqueta da ampola e na caixa.
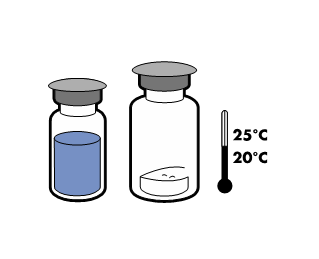
Não armazene a uma temperatura superior a 25°C. Conservar no embalagem original para proteger da luz.
Não congelar.
Para manter a esterilidade do produto, use imediatamente após a reconstituição. No entanto, foi demonstrada a estabilidade química e física do produto após armazenamento por 24 horas a 25°C.
Não use este medicamento se notar turvação ou partículas sólidas na solução.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve-se perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Willfact
Substância ativaé o fator de von Willebrand humano (500 j.m., 1000 j.m., 2000 j.m.) expresso em unidades internacionais de atividade do cofator de ristocetina (vWF:RCo).
Após a reconstituição com 5 ml (500 j.m.), 10 ml (1000 j.m.) ou 20 ml (2000 j.m.) de água para injeção, uma ampola contém aproximadamente 100 j.m./ml de fator de von Willebrand humano.
Antes da adição da albumina, a atividade específica da solução é de pelo menos 60 j.m. de vWF:RCo por 1 mg de proteína total.
Outros componentes:
Pó: albumina humana, cloreto de arginina, glicina, citrato de sódio e cloreto de cálcio di-hidratado.
Solvente: água para injeção.
Como é o medicamento Willfact e que conteúdo tem o pacote
O medicamento Willfact é fornecido na forma de pó branco ou amarelado pálido e solvente transparente e incolor para solução injectável após reconstituição com o sistema de transferência.
Os tamanhos de embalagem do medicamento Willfact disponíveis são 500 j.m./5 ml, 1000 j.m./10 ml, 2000 j.m./20 ml.
A solução reconstituída deve ser transparente ou ligeiramente opalescente, incolor ou ligeiramente amarelada.
Responsável e fabricante
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANÇA
[email protected]
Fabricantes
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANÇA
LFB-BIOMEDICAMENTS
59 Rue de Trévise
59000 LILLE
FRANÇA
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia e no Reino Unido (Irlanda do Norte) sob as seguintes denominações:
Áustria
Willfact
República Checa
WILLFACT
Dinamarca
Willfact
Espanha
Willfact
Alemanha
WILLFACT
Noruega
Willfact
Polônia
Willfact
Eslováquia
Willfact
Suécia
Willfact
Hungria
Willfact
Reino Unido (Irlanda do Norte)
Willfact
Data da última atualização da bula:
- 01.2024 ________________________________________________________________________________________
INSTRUÇÕES DE USO:
Dosagem
Em geral, a administração de 1 j.m./kg de peso corporal de fator de von Willebrand humano aumenta a atividade do vWF:RCo circulante em aproximadamente 0,02 j.m./ml (2%).
Deve-se visar alcançar concentrações de vWF:RCo de >0,6 j.m./ml (60%) e FVIII:C de >0,4 j.m./ml (40%).
A hemostasia é incerta até que se atinja uma atividade coagulante do fator VIII (FVIII:C) de 0,4 j.m./ml (40%). A injeção do fator de von Willebrand sozinho não causa um aumento máximo da atividade do FVIII:C por pelo menos 6–12 horas. Não é suficiente para a normalização imediata da atividade do FVIII:C. Portanto, se a atividade inicial do FVIII:C do paciente for abaixo do valor crítico e for necessário um ajuste rápido da hemostasia — como no caso do tratamento de um sangramento ou lesão grave, ou durante um procedimento cirúrgico de emergência — com a primeira injeção do fator de von Willebrand, deve-se administrar o fator VIII para alcançar uma atividade do FVIII:C no plasma que permita a hemostasia.
Se, no entanto, um aumento imediato da atividade do FVIII:C não for necessário — por exemplo, no caso de um procedimento cirúrgico planejado — ou se a atividade inicial do FVIII:C permitir a manutenção da hemostasia, o médico pode decidir não administrar o fator VIII com a primeira injeção do fator de von Willebrand.
- Início do tratamento: A primeira dose do medicamento Willfact é de 40-80 j.m./kg de peso corporal no caso do tratamento de um sangramento ou lesão. É administrada em combinação com a quantidade necessária de um produto contendo o fator VIII, calculada com base na atividade inicial do FVIII:C no plasma do paciente, para alcançar a atividade adequada do FVIII:C no plasma, imediatamente antes do procedimento ou o mais rápido possível após o início do episódio de sangramento ou lesão grave. No caso de um procedimento cirúrgico, a primeira injeção deve ser administrada 1 hora antes do procedimento. A administração de uma dose inicial de 80 j.m./kg de peso corporal do medicamento Willfact pode ser necessária, especialmente em pacientes com doença de von Willebrand tipo 3, nos quais a manutenção da atividade adequada pode exigir doses mais altas do que nos outros tipos de vWD.
No caso de um procedimento cirúrgico planejado, a primeira injeção do medicamento Willfact deve ser administrada 12–24 horas antes do procedimento, e a segunda injeção — imediatamente antes do procedimento. Nesses casos, a administração concomitante de um preparado de fator VIII não é necessária, pois antes do procedimento, a concentração de FVIII:C endógeno geralmente atinge o valor crítico de 0,4 j.m./ml (40%). No entanto, isso deve ser confirmado em cada paciente.
- Injeções subsequentes: Se necessário, o tratamento com o medicamento Willfact deve ser continuado como monoterapia na dose de 40-80 j.m./kg de peso corporal por dia em 1 ou 2 injeções diárias por um ou vários dias. A dose e a frequência das injeções devem ser sempre ajustadas de acordo com o tipo de procedimento, o estado clínico e biológico (vWF:RCo e FVIII:C) do paciente, bem como o tipo e a gravidade do episódio de sangramento.
- Profilaxia de longo prazo: O medicamento Willfact pode ser administrado como profilaxia de longo prazo na dose ajustada individualmente para cada paciente. A administração do medicamento Willfact na dose de 40-60 j.m./kg de peso corporal, 2-3 vezes por semana, reduz o número de episódios de sangramento.
- Tratamento ambulatorial: Com a concordância do médico, especialmente no caso de um sangramento menor ou moderado ou profilaxia de longo prazo de sangramentos, pode-se iniciar o tratamento em casa.
Crianças e adolescentes
A dose para cada indicação é baseada no peso corporal. A dose e a duração do tratamento devem ser ajustadas de acordo com o estado clínico do paciente e as concentrações de vWF:RCo e FVIII:C no plasma.
- Início do tratamento
- Em crianças com menos de 6 anos de idade, a dose inicial pode ser calculada com base na recuperação incremental (IR) do paciente ou, se os dados de IR não estiverem disponíveis, pode ser necessária uma dose inicial de 60 a 100 j.m./kg de peso corporal para aumentar a concentração de vWF:RCo do paciente para 100 j.m./dl.
- Em crianças com mais de 6 anos de idade e adolescentes, a dosagem é a mesma que para pacientes adultos.
- Injeções subsequentes Em crianças e adolescentes, as doses subsequentes devem ser determinadas individualmente com base no estado clínico e na concentração de vWF:RCo, e ajustadas de acordo com a resposta clínica.
Procedimento cirúrgico planejado
- Em crianças com menos de 6 anos de idade, após a primeira dose administrada 12 a 24 horas antes do procedimento, uma segunda dose pode ser administrada 30 minutos antes do procedimento.
- Em crianças com mais de 6 anos de idade e adolescentes, a dosagem é a mesma que para pacientes adultos.
- Profilaxia Em crianças e adolescentes, a dose e a frequência de administração devem ser determinadas individualmente com base na recuperação incremental e na concentração de vWF:RCo do paciente, e ajustadas de acordo com a resposta clínica.
Método e via de administração
Administração intravenosa
Reconstituição
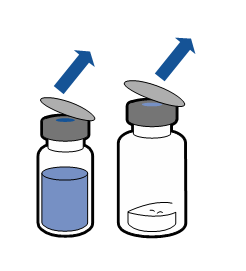
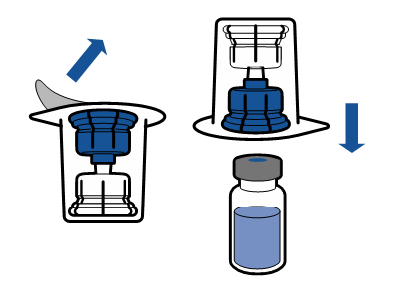
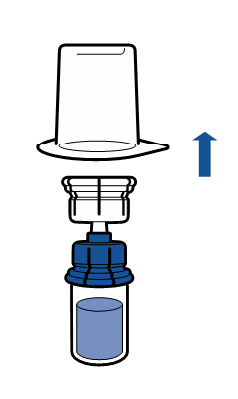
Deve-se seguir as recomendações atuais para a técnica de trabalho asséptica. O sistema de transferência é usado apenas para a reconstituição do medicamento, de acordo com a descrição abaixo. O sistema não é destinado à administração do medicamento ao paciente.
  |
|
  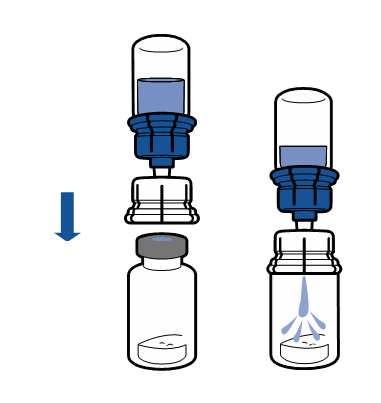 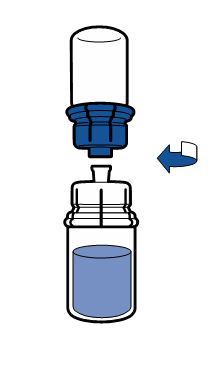 |
|
O pó deve dissolver em menos de 5 minutos, geralmente dissolve imediatamente.
A solução resultante deve ser transparente ou ligeiramente opalescente, incolor ou ligeiramente amarelada. Antes da administração, o produto reconstituído deve ser inspecionado visualmente para detectar partículas sólidas e descoloração.
Não use a solução se estiver turva ou contiver depósitos.
Não misture com outros medicamentos.
Não dilua o produto após a reconstituição.
Administração
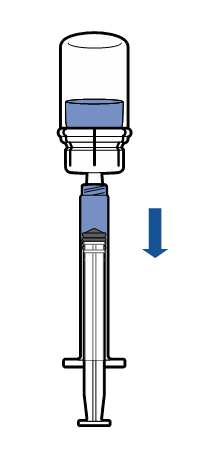 |
|
Armazenamento após a reconstituição
Para manter a esterilidade do produto, use imediatamente após a reconstituição. No entanto, foi demonstrada a estabilidade química e física do produto após armazenamento por 24 horas a 25°C.
Qualquer produto não utilizado ou resíduos devem ser descartados de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorLFB-Biomedicamensts LFB-Biomedicaments
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Uillfact 1000 i.m.Forma farmacêutica: Pó, 2000 UI/20 mlSubstância ativa: von Willebrand factorFabricante: LFB-Biomedicamensts LFB-BiomedicamentsNão requer receita médicaForma farmacêutica: Pó, 500 UI/5 mlSubstância ativa: von Willebrand factorFabricante: LFB-Biomedicamensts LFB-BiomedicamentsNão requer receita médicaForma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Uillfact 1000 i.m. noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Uillfact 1000 i.m. em Spain
Médicos online para Uillfact 1000 i.m.
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Uillfact 1000 i.m. – sujeita a avaliação médica e regras locais.














