
TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃO

Como usar TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
Treosulfano Zentiva 5 g pó para solução para perfusão EFG
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Treosulfano Zentiva e para que é utilizado
- O que necessita de saber antes de começar a usar Treosulfano Zentiva
- Como usar Treosulfano Zentiva
- Possíveis efeitos adversos
- Conservação de Treosulfano Zentiva
- Conteúdo do envase e informação adicional
1. O que é Treosulfano Zentiva e para que é utilizado
Treosulfano Zentiva contém o princípio ativo treosulfano. Treosulfano pertence ao grupo dos agentes alquilantes. Estes agentes actuam detendo o crescimento de células cancerosas.
Treosulfano Zentiva foi-lhe prescrito pelo seu médico para o tratamento do cancro do ovário avançado após, pelo menos, um tratamento padrão prévio.
2. O que necessita de saber antes de começar a usar Treosulfano Zentiva
Não use Treosulfano Zentiva:
- se é alérgico ao treosulfano;
- se não tem células sanguíneas suficientes (supressão severa da medula óssea);
- se se encontra em período de amamentação.
Antes de cada administração, deve realizar-se uma análise de sangue para verificar que tem células sanguíneas suficientes para receber Treosulfano Zentiva.
Advertências e precauções
Consulte o seu médico ou enfermeiro antes de começar a usar Treosulfano Zentiva:
Dano na medula óssea e controles do recuento sanguíneo
A reação adversa que limita a dose de treosulfano é a restrição da função da medula óssea, que geralmente desaparece após a interrupção do tratamento. Manifesta-se numa redução dos glóbulos brancos (leucócitos) e das plaquetas (trombócitos) e numa diminuição dos glóbulos vermelhos (hemoglobina).
Como os distúrbios da função da medula óssea se acumulam, o seu médico controlará o recuento sanguíneo a intervalos mais curtos a partir do terceiro ciclo. Isto é especialmente importante quando se combina com outras formas de terapia que atacam a medula óssea, como a radioterapia. Se a função da medula óssea for afetada, existe um maior risco de infecção.
Em geral, os glóbulos brancos (leucócitos) e as plaquetas (trombócitos) voltam aos níveis basais após 28 dias.
Toxicidade pulmonar
A dificuldade para respirar, a tos ou a febre alta podem indicar uma doença pulmonar. Se existirem limitações graves da função pulmonar, como inflamação, cicatrizes ou infecções, deve interromper-se o tratamento com treosulfano.
Deve ter em conta os seguintes aspetos enquanto estiver em tratamento com Treosulfano Zentiva:
- aumenta o seu risco de desenvolver certos tipos de infecção;
- podem ocorrer diferentes tipos de cancro de sangue após um tratamento prolongado;
- se tiver problemas renais, o treosulfano é excretado através dos rins, por esta razão, deve realizar-se um controlo estrito dos seus recuentos sanguíneos e, se necessário, ajustar a sua dose;
- o tratamento com medicamentos contra o cancro pode aumentar o risco de infecção generalizada após algumas vacinações. Por isso, deve evitar ser vacinado com vacinas vivas;
- devido ao possível desenvolvimento de inflamação na bexiga que causa dor ou micção mais frequente ou urgente, com ou sem presença de sangue na urina (cistite hemorrágica), recomenda-se beber mais líquidos do que o normal até 24 horas após o tratamento com treosulfano.
- se for mulher em idade fértil, deve utilizar também métodos anticonceptivos eficazes (ou seja, de prevenção da gravidez) durante e até seis meses após o tratamento (ver secção Gravidez e amamentação).
Extravasação
A perfusão de treosulfano deve ser realizada utilizando uma técnica segura, dado que a extravasação da solução de treosulfano no tecido circundante pode produzir reações inflamatórias e dolorosas no local da injeção. Se ocorrer extravasação, deve interromper-se a perfusão imediatamente e administrar a dose restante em outra veia.
Outros medicamentos e Treosulfano Zentiva
Informa o seu médico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento, mesmo os medicamentos adquiridos sem receita. Isto inclui medicamentos à base de plantas.
O efeito do tratamento com ibuprofeno/cloroquina pode ser reduzido quando administrado com Treosulfano Zentiva.
Gravidez eamamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de utilizar este medicamento. Não existem dados, ou estes são escassos, em relação ao uso de Treosulfano Zentiva 5 g pó para solução para perfusão em mulheres grávidas ou em período de amamentação.
Gravidez
Devido a que não se podem descartar lesões no feto, Treosulfano Zentiva 5 g pó para solução para perfusão não deve ser utilizado durante a gravidez, a menos que o seu médico o considere absolutamente necessário. Não deve ficar grávida durante o tratamento com Treosulfano Zentiva 5 g pó para solução para perfusão.
Se ficar grávida durante o tratamento com Treosulfano Zentiva 5 g pó para solução para perfusão, deve informar imediatamente o seu médico.
Anticoncepção em mulheres
Durante e até seis meses após o tratamento com Treosulfano Zentiva 5 g pó para solução para perfusão, deve utilizar métodos anticonceptivos adequados se se encontrar em idade fértil.
Amamentação
Como não se pode descartar uma possível transferência da substância para o leite materno, não deve amamentar durante o tratamento com Treosulfano Zentiva 5 g pó para solução para perfusão.
Condução e uso de máquinas
Não foram realizados estudos sobre o efeito na capacidade para conduzir e utilizar máquinas. Não conduza e não utilize máquinas se tiver náuseas e vómitos, pois estes efeitos podem diminuir a sua capacidade de conduzir ou manejar maquinaria.
3. Como usar Treosulfano Zentiva
Treosulfano Zentiva é administrado normalmente por um médico ou enfermeiro diretamente no torrente circulatório. O seu médico calculará a dose correta para si e será administrado (perfusão intravenosa) durante 15 a 30 minutos.
O seu médico calculará a dose correta de Treosulfano Zentiva, de acordo com os valores dos seus recuentos sanguíneos. O seu médico reduzirá a dose se lhe foi administrado outro medicamento anticanceroso ou um tratamento de radioterapia. A dose também dependerá do tamanho do seu corpo e variará de acordo com a sua área de superfície corporal.
Durante o tratamento com Treosulfano Zentiva, as perfusões normalmente são administradas cada 3 a 4 semanas. Em geral, são dados 6 ciclos de tratamento.
O seu médico pode alterar a dose e a frequência do seu tratamento de acordo com os resultados da sua análise de sangue, do seu estado geral, de qualquer tratamento adicional que esteja a receber e da sua resposta ao tratamento com Treosulfano Zentiva. Em caso de dúvida, pergunte ao seu médico ou enfermeiro.
Se sentir dor no local da injeção, informe o seu médico ou enfermeiro imediatamente.
Uso em crianças
Não se recomenda o seu uso em crianças.
Se receber mais Treosulfano Zentiva do que deve
Se lhe foi administrada demasiada dose deste medicamento, pode sentir-se doente ou as suas células sanguíneas podem ser reduzidas. O seu médico pode administrar-lhe uma transfusão de sangue e tomará outras medidas se for necessário.
Se tiver alguma dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone: 91 562 04 20, indicando o medicamento e a quantidade ingerida.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram. Se sofrer algum efeito adverso, é importante que informe o seu médico antes do próximo tratamento.
Informa o seu médico imediatamente se nota algum dos seguintes sintomas:
- Reações alérgicas [raras (podem afetar até 1 de cada 1000 pessoas)]: se desenvolve picazón, erupção cutânea, inchaço da face, lábios, língua e/ou garganta, que pode causar dificuldade para engolir ou respirar ou uma diminuição da pressão arterial.
- Febre ou infecção [muito frequentes (podem afetar mais de 1 de cada 10 pessoas)]: se tem uma temperatura corporal de 38°C ou mais, experimenta sudorese ou observa qualquer outro sinal de infecção (pode ter menos glóbulos brancos do que o normal).
- Debilidade [muito frequentes (podem afetar mais de 1 de cada 10 pessoas)], dificuldade para respirar ou se a sua pele se torna pálida (pode ter menos glóbulos vermelhos do que o normal).
- Sangramento [muito frequentes (podem afetar mais de 1 de cada 10 pessoas)]das gengivas, da boca ou do nariz ou aparência anormal de hematomas (pode ter menos plaquetas do que o normal).
- Dificuldade para respirar [muito raras (podem afetar até 1 de cada 10.000 pessoas)](pode ter uma reação alérgica, inflamação ou infecção do pulmão).
Efeitos adversos muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
- Redução dos glóbulos brancos (aumenta o risco de infecção), plaquetas (pode causar hematomas e sangramento das gengivas e sangramento da boca e do nariz) e glóbulos vermelhos (pode causar palidez, debilidade e dificuldade para respirar) - por isso, deve controlar regularmente o recuento sanguíneo.
- Problemas estomacais, incluindo náuseas (sentir-se doente) com ou sem vómitos (estar doente).
- Perda de cabelo leve. Após o tratamento, regressa o crescimento normal do cabelo.
- Descoloração bronzeada da pele.
Efeitos adversos frequentes (podem afetar até 1 de cada 10 pessoas):
- Infecções causadas por fungos, vírus ou bactérias (podem dar origem a febre, sudorese e sensação geral de mal-estar).
- Molestias gastrointestinais.
Efeitos adversos pouco frequentes (podem afetar até 1 de cada 100 pessoas):
- Diferentes tipos de cancro de sangue (após tratamentos de longa duração).
- Inflamação da membrana mucosa oral (estomatite).
Efeitos adversos muito raros (podem afetar até 1 de cada 10.000 pessoas):
- Redução grave e simultânea de todas as células sanguíneas (pancitopenia); pode causar debilidade e hematomas e aumentar o risco de infecção.
- Doença de Addison, uma doença em que as glândulas suprarrenais não funcionam corretamente, o que produz pele bronzeada, mal-estar estomacal, pressão arterial baixa (sensação de tontura) e uma sensação geral de debilidade.
- Sudorese, tremores e fome como resultado de uma descida nos níveis de glicose dentro do seu sangue (hipoglicemia).
- Formigamento e sensação de entorpecimento (parestesia).
- Debilidade do músculo cardíaco causada por uma alteração estrutural (cardiomiopatia).
- Dificuldade para respirar (inflamação e cicatrização dos pulmões e infecções pulmonares).
- Aumento dos valores da função hepática (pode provocar cansaço, sensação de pressão na parte superior direita do abdômen e coloração amarelada da esclerótica e da pele).
- Urticária ou erupção cutânea com picazón; inflamação da pele com ou sem formação de escamas (esclerodermia e psoríase), vermelhidão da pele (eritema).
- Inflamação da bexiga, que causa dor ou micção mais frequente e urgente, com ou sem sangue na urina (cistite hemorrágica).
- Sensação de mal-estar (sintomas semelhantes aos da gripe).
- Vermelhidão ou inchaço dolorosos no local da injeção (em caso de que a solução de treosulfano saia e entre em contacto com a pele).
Frequência não conhecida: não pode ser estimada a partir dos dados disponíveis
- Septicemia (sepsis).
Informa o seu médico ou pessoal de enfermagem imediatamente se nota algum dos sintomas anteriores.
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Español de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Treosulfano Zentiva
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de caducidade que aparece no envase após CAD. A data de caducidade é o último dia do mês que se indica.
Uma vez reconstituído, não conserve o medicamento em frigorífico (2 - 8°C) porque poderia precipitar. Não use se a solução contém precipitados.
Não refrigerar.
A estabilidade fisicoquímica em uso foi demonstrada durante 12 horas a 30°C. Desde o ponto de vista microbiológico, a menos que a diluição tenha sido efetuada em condições assépticas controladas e validadas, deve ser utilizada de forma imediata. De não ser assim, os tempos de conservação durante o uso e as condições prévias ao mesmo são responsabilidade do utilizador.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Treosulfano Zentiva
- O princípio ativo é treosulfano. Cada frasco contém 5 g de treosulfano.
- Após a reconstituição, cada mililitro de solução contém 50 mg de treosulfano
Aspecto do produto e conteúdo do envase
Pó ou agregado compacto cristalino de cor branca que é fornecido em frascos de vidro transparentes, cada frasco contém 5 g de treosulfano.
O pó é reconstituído com água para preparações injetáveis no frasco formando uma solução antes da sua administração.
Treosulfano Zentiva está disponível em envases com 1 frasco ou 5 frascos.
Frascos com ou sem envoltura de plástico retráctil com base protetora (disco). A envoltura retráctil não está em contato com o produto e fornece uma proteção adicional durante o transporte. Além disso, melhora a manipulação segura do produto por profissionais de saúde.
Título da autorização de comercialização
Zentiva k.s.,
U kabelovny 130,
Praga 10 – Dolní Mecholupy,
102 37 República Checa
Responsável pela fabricação
MIAS Pharma Limited
Suite 2, Stafford House, Strand Road
Portmarnock, Co. Dublin
Irlanda
Tillomed Malta Limited,
Malta Life Sciences Park,
LS2.01.06 Industrial Estate,
San Gwann, SGN 3000, Malta
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Zentiva Spain S.L.U.
Avenida de Europa, 19, Edificio 3, Planta 1.
28224 Pozuelo de Alarcón, Madrid
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Alemanha | Treosulfan Tillomed 5g Pó para solução para infusão |
França | Treosulfan Tillomed 5g poudre pour solution pour perfusion |
Espanha | Treosulfano Zentiva 5 g pó para solução para perfusão EFG |
Áustria: | Treosulfan Tillomed 5g Pó para solução para infusão |
República Checa: | Treosulfan Tillomed |
Grécia: | Treosulfan Tillomed 5g κόνις για διύλυμα προς έγχυση |
Polônia: | Treosulfan Tillomed |
Romênia: | Treosulfan Tillomed 5g Pulbere pentru soluție perfuzabilă |
Dinamarca: | Treosulfan Tillomed |
Finlândia: | Treosulfan Tillomed infuusiokuiva-aine liuosta varten 5g |
Noruega: | Treosulfan Tillomed 5g Pulver til infusjonsvæske, oppløsning |
Suécia: | Treosulfan Tillomed 5g Pulver till infusionsvätska, lösning |
Bélgica: | Treosulfan Tillomed 5g Poeder voor oplossing voor infusie Treosulfan Tillomed 5g poudre pour solution pour perfusion Treosulfan Tillomed 5g Pulver zur Herstellung einer Infusionslösung |
Irlanda: | Treosulfan Tillomed 5g powder for solution for infusion |
Países Baixos: | Treosulfan Tillomed 5g Poeder voor oplossing voor infusie |
Portugal: | Treossulfano Tillomed 5g pó para solução para perfusão |
Data da última revisão desteprospecto:Maio 2025
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/)
--------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do setor sanitário:
Para um único uso.
Procedimentos para manipulação e eliminação de medicamentos citotóxicos:
- Apenas pessoal instruído deve reconstituir a solução.
- É necessária uma área de preparação reservada para isso.
- O pessoal deve usar roupa, máscara e luvas de proteção adequadas.
- Devem ser tomadas precauções para evitar que o medicamento entre em contato acidental com os olhos. Se a solução entrar em contato com a pele ou olhos, enxaguar imediatamente a área com água abundante ou solução salina. Pode ser usada uma pomada para tratar o escozor transitório da pele. Em caso de irritação ocular, entrar em contato com um oftalmologista.
- As pessoas grávidas não devem manipular este medicamento.
- Devem ser tomadas precauções adequadas para a eliminação dos artigos utilizados para reconstituir os medicamentos citotóxicos (seringas, agulhas, etc.).
- A superfície de trabalho deve ser coberta com plástico descartável e papel absorvente.
- Utilizar acessórios Luer-lock para todos os equipamentos e seringas. Recomenda-se agulhas de grande calibre para minimizar a pressão e a possível formação de aerossóis. Isso também pode ser reduzido mediante o uso de uma agulha de ventilação.
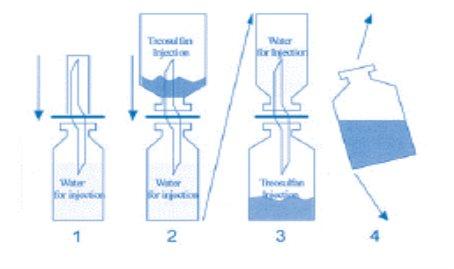
Instruções para a reconstituição de Treosulfano Zentiva
Para evitar problemas de solubilidade durante a reconstituição, devem ser considerados os seguintes aspectos:
- O solvente, água para preparações injetáveis, deve ser aquecido a 25 - 30° C usando um banho de água.
- O treosulfano deve ser retirado cuidadosamente da superfície interna do frasco de perfusão agitando.
Este procedimento é muito importante, porque a umedecção do pó que se adere à superfície dá como resultado o apelmazamento. Em caso de que se produza apelmazamento, deve-se sacudir o frasco vigorosamente.
- Um lado da cânula é colocado no tampão de borracha do frasco de água e no outro extremo da cânula é colocado o frasco de treosulfano boca para baixo.
Girar todo o sistema para permitir que a água entre no frasco inferior enquanto se agita suavemente.
Siguiendo estas instruções, o procedimento de reconstituição não deve demorar mais de 2 minutos. Veja o diagrama abaixo para ajudar no processo de reconstituição:
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 5 gSubstância ativa: treosulfanRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 6 mg/mlSubstância ativa: busulfanFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: COMPRIMIDO, 2 mg de busulfanoSubstância ativa: busulfanFabricante: Aspen Pharma Trading LimitedRequer receita médica
Alternativas a TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃO em Polónia
Médicos online para TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TREOSULFANO ZENTIVA 5 g PÓ PARA SOLUÇÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.





