PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto: informação para o utilizador
Primovist 0,25 mmol/ml, solução injetável em seringa pré-carregada
Gadoxetato de disódio
Leia todo o prospecto atentamente antes de começar a usar o medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o médico que lhe administra Primovist.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Primovist e para que é utilizado
- O que precisa saber antes de começar a usar Primovist
- Como usar Primovist
- Possíveis efeitos adversos
- Conservação de Primovist
- Conteúdo do envase e informações adicionais
1. O que é Primovist e para que é utilizado
Primovist é um meio de contraste para o diagnóstico por imagem mediante ressonância magnética (RM) do fígado. É utilizado para contribuir para a detecção e diagnóstico de alterações que podem aparecer no fígado. Podem ser avaliados melhor sinais anormais do fígado quanto ao número, ao tamanho e à distribuição. Primovist também pode ajudar o médico a determinar a natureza de qualquer anormalidade, aumentando assim a confiança no diagnóstico. É fornecido como solução injetável. Este medicamento é apenas para uso diagnóstico.
A RM (ressonância magnética) é um método de diagnóstico por imagem que cria imagens mediante a detecção de moléculas de água nos tecidos normais e anormais. Isso é realizado mediante um complexo sistema de ímanes e ondas de rádio.
2. O que precisa saber antes de começar a usar Primovist
Não usePrimovist
- Se você é alérgico ao gadoxetato de disódio ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico antes de começar a usar Primovist se você padece:
- ou já padeceu asma ou uma alergia como febre do feno, urticária.
- previamente já padeceu alguma reação aos meios de contraste.
- uma redução da função renal.
O uso de alguns agentes de contraste contendo gadolínio em pacientes com esta doença está associado à doença conhecida como Fibrose Nefrogénica Sistémica (FNS). A FNS é uma doença que dá origem a um engrossamento da pele e dos tecidos conjuntivos. A FNS pode chegar a produzir uma diminuição da mobilidade das articulações, debilitação dos músculos ou alteração da função dos órgãos internos, o que pode pôr em perigo a vida.
- uma doença grave do coração ou dos vasos sanguíneos.
- de níveis de potássio no sangue baixos.
- ou alguém da sua família teve um problema de ritmo cardíaco chamado síndrome do QT longo.
- teve alterações do ritmo cardíaco devido a algum medicamento.
- tem um marcapasso cardíaco ou se há algum implante ou clipe que contenha ferro no seu corpo.
Após a administração de Primovist podem ocorrer reações alérgicas retardadas horas ou dias depois. Ver secção 4.
Informa ao seu médico se:
- os seus rins não funcionam corretamente
- recentemente lhe foi realizado, ou em breve lhe será realizado, um transplante de fígado
O seu médico pode decidir realizar-lhe uma análise de sangue para comprovar o funcionamento correto dos seus rins antes de decidir o uso de Primovist, especialmente se você tiver 65 anos ou mais.
Acumulação no corpo
Primovist funciona porque contém um metal chamado gadolínio. Os estudos demonstraram que se podem acumular pequenas quantidades de gadolínio no organismo, incluindo o cérebro.
Não se observaram efeitos adversos devidos à acumulação de gadolínio no cérebro.
Crianças e adolescentes
Não se estabeleceu a segurança e eficácia de Primovist em pacientes menores de 18 anos, pois a experiência deste uso é limitada. Fornecem-se informações adicionais no final do prospecto.
Uso de Primovist com outros medicamentos
Comunique ao seu médico ou farmacêutico se está utilizando, utilizou recentemente ou poderia ter que utilizar qualquer outro medicamento. Incluem-se especialmente:
- betabloqueantes, medicamentos para o tratamento da tensão arterial alta ou outras doenças cardíacas
- medicamentos que alteram o ritmo ou cadência dos batimentos do coração, como amiodarona, sotalol
- rifampicina, medicamento que se utiliza para o tratamento da tuberculose ou outras infecções.
Gravidez e amamentação
Gravidez
Gadoxetato pode atravessar a placenta. Desconhece-se se afeta ao feto. Deve informar o seu médico se acredita que está grávida ou que poderia estar, pois Primovist não deve ser utilizado durante a gravidez a menos que seja estritamente necessário.
Amamentação
Informa ao seu médico se está a amamentar ou a ponto de começar. O seu médico avaliará se você deve continuar a amamentar ou se deve interromper por um período de 24 horas após a administração de Primovist.
Condução e uso de máquinas
Primovist não tem qualquer influência na capacidade de conduzir e usar máquinas.
Primovist contém sódio
Este medicamento contém 82 mg de sódio (componente principal da sal de mesa/para cozinhar) por dose, com base na quantidade administrada para uma pessoa de 70 kg. Isso equivale a 4,1% da ingestão diária máxima de sódio recomendada para um adulto.
3. Como usar Primovist
Primovist é injetado na veia mediante uma agulha de pequeno tamanho. Você receberá Primovist imediatamente antes do seu exame de RM (ressonância magnética).
Após a injeção, você estará em observação durante, pelo menos, 30 minutos.
Dose recomendada
0,1 ml de Primovist por quilograma de peso corporal.
Posologia em populações especiais
O uso de Primovist não é recomendado em pacientes com problemas renais graves ou em pacientes a quem recentemente se realizou ou em breve se realizará um transplante de fígado. No entanto, se se requerer o uso, durante uma exploração apenas deve ser administrada uma dose de Primovist e não deve ser administrada uma segunda injeção até que tenham transcorrido pelo menos 7 dias.
Pacientes de idade avançada
Se você tiver 65 anos ou mais, não é necessário que a dose seja ajustada, mas poderia ser realizado um exame de sangue para comprovar o funcionamento correto dos seus rins.
Se você usar mais Primovist do que devia:
Uma sobredose é improvável. Se isso acontecer, o seu médico tratará qualquer sintoma que apareça.
Se tiver alguma outra dúvida sobre o uso deste produto, pergunte ao seu médico ou farmacêutico.
Também pode ligar para o Serviço de Informação Toxicológica. Telefone: 91 562 04 20.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
A maioria dos efeitos adversos é de natureza leve a moderada.
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico.
Como com outros meios de contraste, podem ocorrer casos raros de reações alérgicas. Podem ocorrer reações retardadas de horas a dias após a administração de Primovist.
O efeito adverso mais grave em pacientes que recebem Primovist é o choque anafilático (uma reação alérgica severa).
Informa ao seu médico imediatamente se você experimentar qualquer um dos seguintes sinais ou se tiver dificuldade para respirar:
- pressão arterial baixa
- inchaço na língua, garganta ou face
- secreção nasal, espirros, tosse
- olhos vermelhos, lacrimejantes e com picazón
- dor estomacal
- urticária
- diminuição da sensação ou sensibilidade na pele, picazón, pele pálida
Os seguintes efeitos adversos adicionais podem ocorrer:
Efeitos adversos frequentes:podem afetar até 1 de cada 10 pessoas
- dor de cabeça
- náuseas
Efeitos adversos pouco frequentes:podem afetar até 1 de cada 100 pessoas
- tontura
- entorpecimento e formigamento
- alterações do sentido do gosto ou do olfato
- rubor
- aumento da pressão arterial
- dificuldades respiratórias
- vómito
- secura da boca
- erupção cutânea
- picazón intenso, que afeta todo o corpo ou os olhos
- dor de costas, dor no peito
- reações no local de injeção, tais como ardor, frialdade, irritação, dor
- sensação de calor,
- calafrios
- cansaço
- sensibilidade anormal
Efeitos adversos raros:podem afetar até 1 de cada 1000 pessoas
- incapacidade para sentar-se ou permanecer de pé
- trejeção incontrolável
- batimentos do coração anormalmente intensos ou rápidos (palpitações)
- batimentos do coração irregulares (sinais de bloqueio cardíaco)
- molestias na boca
- aumento da produção de saliva
- vermelhidão da pele com bolhas e manchas
- aumento da sudorese
- sensação de desconforto, mal-estar geral
Frequência não conhecida:a frequência não pode ser estimada a partir dos dados disponíveis
- ritmo cardíaco rápido
- agitação
Alguns valores de laboratório podem mudar pouco tempo após a administração de Primovist. Informe o seu profissional de saúde se lhe foi realizado um exame com Primovist recentemente, caso tenham que realizar-lhe um exame de sangue ou urina.
Foram notificados casos de fibrose nefrogénica sistémica (que provoca um endurecimento da pele e pode afetar também os tecidos moles e os órgãos internos), associados ao uso de outros meios de contraste de gadolínio.
Comunicação de efeitos adversosSe experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Primovist
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta da seringa ou do estojo após CAD. A data de validade é o último dia do mês que se indica.
Este medicamento não requer condições especiais de conservação.
Este medicamento deve ser utilizado imediatamente após a abertura.
Deve ser inspecionado visualmente antes de ser utilizado. Este medicamento não deve ser utilizado em caso de apresentar alterações significativas da cor, de aparecimento de partículas ou em caso de o envase estar defeituoso.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Primovist
- O princípio ativo é gadoxetato de disódio. Cada ml de solução para injeção contém 0,25 mmol de gadoxetato de disódio (equivalente a 181,43 mg de gadoxetato de disódio).
- Os demais componentes são: caloxetato trissódico, trometamol, hidróxido de sódio e ácido clorídrico (ambos para ajustar o pH), e água para preparações injetáveis.
1 seringa pré-carregada com 5,0 ml de solução contém 907 mg de gadoxetato de disódio,
1 seringa pré-carregada com 7,5 ml de solução contém 1361 mg de gadoxetato de disódio, [apenas a seringa de vidro]
1 seringa pré-carregada com 10,0 ml de solução contém 1814 mg de gadoxetato de disódio.
Aspecto do produto e conteúdo do envase
Primovist é uma solução clara, incolora a amarelo pálido livre de partículas. O conteúdo dos envases é de 1, 5 ou 10 seringas pré-carregadas com:
5,0 ml de solução para injeção (em seringa pré-carregada de 10 ml de vidro ou plástico)
7,5 ml de solução para injeção (em seringa pré-carregada de 10 ml de vidro) [apenas a seringa de vidro]
10,0 ml de solução para injeção (em seringa pré-carregada de 10 ml de vidro ou plástico)
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização:
Bayer Hispania, S.L.
Avda. Baix Llobregat, 3-5
08970 Sant Joan Despí (Barcelona)
Espanha
Responsável pela fabricação:
Bayer AG
Müllerstrasse 178
13353 Berlin, Alemanha
Data da última revisão deste prospecto: Dezembro 2024
A informação detalhada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
-----------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do setor sanitário:
- Insuficiência renal
Antes da administração de Primovist, recomenda-se avaliar todos os pacientes para detectar uma possível disfunção renal mediante provas de laboratório.
Foram notificados casos de fibrose nefrogênica sistémica (FNS) associados ao uso de alguns meios de contraste de gadolínio em pacientes com insuficiência renal grave aguda ou crônica (TFG ou taxa de filtração glomerular <30 ml min 1,73 m2). os pacientes submetidos a transplante hepático têm um risco especial, pois incidência de falha renal é elevada neste grupo. como existe possibilidade que possa ocorrer uma fns com primovist, este deve ser evitado:< p>
- em pacientes com insuficiência renal grave
- no período perioperatório de um transplante hepático
a não ser que a informação diagnóstica seja imprescindível e não possa ser obtida mediante ressonância magnética (RM) sem contraste. Se o uso de Primovist não puder ser evitado, a dose não deve exceder 0,025 mmol/kg de peso corporal. Durante uma exploração, não deve ser administrada mais de uma dose. Devido à ausência de informação sobre a administração repetida, a administração de Primovist não deve ser repetida a não ser que tenha transcorrido um intervalo entre injeções de, pelo menos, 7 dias.
Como a eliminação renal do gadoxetato pode estar reduzida nos pacientes de idade avançada, é especialmente importante avaliar os pacientes de 65 anos e mais para detectar uma possível disfunção renal.
A hemodiálise pouco após a administração de Primovist pode resultar útil para a eliminação corporal de Primovist. Não há evidência que apoie o início da hemodiálise para a prevenção ou tratamento da FNS em pacientes que não estão submetidos a hemodiálise.
- Gravidez e Lactação
Não deve ser utilizado Primovist durante a gravidez a não ser que a situação clínica da mulher requeira tratamento com gadoxetato.
A continuação ou a interrupção da lactação 24 horas após a administração de Primovist, ficarão a critério do médico e da mãe em período de lactação.
- População pediátrica
Foi realizado um estudo observacional em 52 pacientes pediátricos de idade superior a 2 meses e inferior a 18 anos. Os pacientes foram derivados para uma Imagem por Ressonância Magnética (MRI, por sua sigla em inglês) hepática com realce com Primovist, para avaliar lesões hepáticas focais conhecidas ou suspeitas. Foi obtida informação diagnóstica adicional quando se compararam a MRI hepática combinada com e sem realce, com a MRI sem realce. Foram notificados acontecimentos adversos graves, no entanto, nenhum deles foi relacionado com Primovist pelo investigador. Devido à natureza retrospectiva e ao pequeno tamanho da amostra deste estudo, não se pode extrair nenhuma conclusão definitiva com respeito à eficácia e à segurança nesta população.
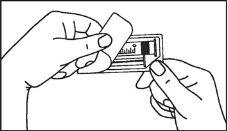
- Antes da injeção
Primovist é um líquido claro, incolora a amarelo pálido livre de partículas visíveis. O meio de contraste deve ser inspecionado visualmente antes de ser utilizado. O meio de contraste não deve ser utilizado em caso de apresentar alterações significativas do cor, de aparecimento de partículas ou em caso de que o envase esteja defeituoso.
- Administração
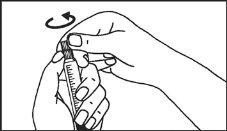
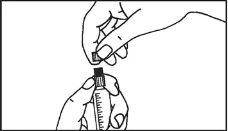
Primovist deve ser administrado sem diluir em forma de injeção intravenosa em bolus com uma velocidade de fluxo de aproximadamente 2 ml/s. Após a injeção do meio de contraste, deve-se lavar a cânula/via intravenosa com uma solução salina fisiológica (9 mg/ml).
- Os pacientes devem ser mantidos em observação durante, pelo menos, 30 minutos após a injeção.
- Primovist não deve ser misturado com outros medicamentos.
- Deve-se evitar a injeção intramuscular em sentido estrito.
- Manipulação
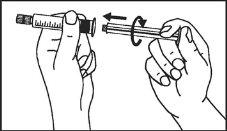
Primovist está pronto para uso.
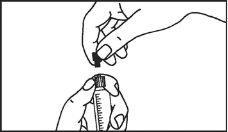
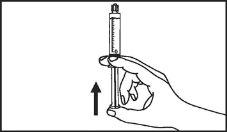
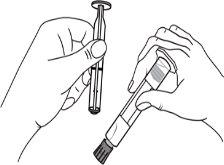
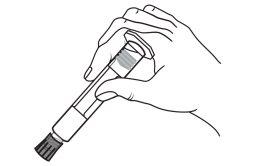
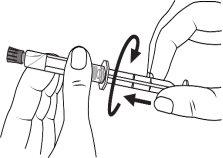
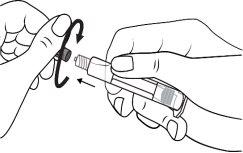
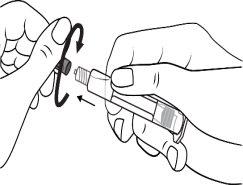
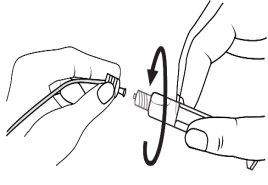
A seringa pré-carregada deve ser preparada para a injeção imediatamente antes da prova. Deve-se separar a tampa do extremo (capuchão) da seringa pré-carregada imediatamente antes do uso.
Todo o meio de contraste não utilizado deve ser descartado seguindo as normas locais.
A etiqueta separável das seringas pré-carregadas deve ser colada na história do paciente a fim de permitir um registro preciso do meio de contraste de gadolínio utilizado. Também deve ser registrado a dose utilizada. No caso de se utilizarem registros eletrônicos de pacientes, devem ser introduzidos nos mesmos o nome do produto, o número de lote e a dose administrada.
Seringa de vidro:
|
| |
|
| |
|
| |
|
| |
|
| |
|
|
Seringa de plástico:
Injeção manual | Injeção com injetor | ||
|
| ||
|
| ||
|
| ||
|
|
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, 0,5 mmol/mlSubstância ativa: gadoteric acidFabricante: Ge Healthcare Bio-Sciences, S.A.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mmol/mlSubstância ativa: gadoteric acidFabricante: Ge Healthcare Bio-Sciences, S.A.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mmol/mlSubstância ativa: gadoteric acidFabricante: Sanochemia Pharmazeutika GmbhRequer receita médica
Alternativas a PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Poland
Alternativa a PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Ukraine
Médicos online para PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de PRIMOVIST 0,25 mmol/ml, SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.