
Primovist

Pergunte a um médico sobre a prescrição de Primovist

Como usar Primovist
Folheto informativo para o utilizador
Primovist, 0,25 mmol/ml, solução para injeção, seringa pré-cheia
Gadoxetato de dissódio
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico que prescreveu o Primovist.
- Se o doente apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico. Ver ponto 4.
Índice do folheto:
- 1. O que é o Primovist e para que é utilizado
- 2. Informações importantes antes de usar o Primovist
- 3. Como usar o Primovist
- 4. Efeitos secundários possíveis
- 5. Como conservar o Primovist
- 6. Conteúdo da embalagem e outras informações
1. O que é o Primovist e para que é utilizado
O Primovist é um meio de contraste utilizado na imagem do fígado por ressonância magnética (RM). É utilizado para permitir a detecção e melhorar a visualização de alterações que podem ocorrer no fígado. Com ele, é possível avaliar melhor as alterações anormais no fígado, o seu número, tamanho e distribuição. O Primovist também pode ajudar o médico a determinar o tipo de alterações, aumentando a confiabilidade do diagnóstico.
O Primovist é destinado a injeção intravenosa. O produto é exclusivamente para diagnóstico.
A RM é um tipo de exame diagnóstico que utiliza diferenças na distribuição e quantidade de moléculas de água nos tecidos normais e anormais para criar imagens. A base desta técnica é a utilização de um sistema complexo de ímãs e ondas de rádio.
2. Informações importantes antes de usar o Primovist
Quando não usar o Primovist
- se o doente tem alergia ao gadoxetato de dissódio ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Precauções e advertências
Antes de iniciar o uso do Primovist, deve discutir com o médico se o doente:
- tem asma ou alergia (como febre dos fenos, urticária);
- teve uma reação alérgica após a administração de um meio de contraste;
- tem deterioração da função renal. A administração de alguns meios de contraste que contêm gadolínio em doentes com este estado tem sido associada ao desenvolvimento de fibrose sistémica nefrogénica (FSN). A FSN é uma doença que causa espessamento da pele e do tecido conjuntivo. A FSN pode levar à incapacidade devido à imobilização das articulações, fraqueza muscular ou disfunção dos órgãos internos, e pode ser fatal;
- tem doença cardíaca grave e vascular;
- tem baixos níveis de potássio;
- ou tem na família anormalidades no traçado do ritmo cardíaco (EKG) conhecidas como síndrome do intervalo QT prolongado;
- teve um ritmo cardíaco anormal após a administração de medicamentos;
- tem um marca-passo ou qualquer implante ou stent que contenha ferro.
Após a administração do Primovist, podem ocorrer reações retardadas semelhantes a alergias. Estas reações podem aparecer após várias horas ou dias. Ver ponto 4.
Deve informar o médico se:
- os rins do doente não funcionam corretamente,
- o doente teve ou vai ter um transplante de fígado em breve. O médico pode decidir realizar um exame de sangue para controlar a função renal antes de decidir usar o Primovist, especialmente em pessoas com mais de 65 anos.
Acumulação no organismo
O Primovist funciona porque contém um metal chamado gadolínio. Estudos mostraram que pequenas quantidades de gadolínio podem se acumular no organismo, incluindo no cérebro. Não foram observados efeitos secundários relacionados à acumulação de gadolínio no cérebro.
Crianças e jovens
A segurança e eficácia do Primovist não foram estabelecidas em crianças com menos de 18 anos devido à experiência limitada com este medicamento nesta população. Mais informações podem ser encontradas no final deste folheto.
Primovist e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o doente está tomando atualmente ou recentemente, bem como sobre qualquer medicamento que o doente planeje tomar. Em particular:
- sobre beta-bloqueadores, medicamentos usados para tratar a hipertensão ou doenças cardíacas;
- sobre medicamentos que afetam o ritmo ou a frequência cardíaca, como amiodarona, sotalol;
- sobre rifampicina, um medicamento usado para tratar a tuberculose ou outras infecções.
Gravidez e amamentação Gravidez
O gadoxetato de dissódio pode atravessar a placenta. Não se sabe se isso afeta o feto. Mulheres que acreditam estar grávidas ou podem estar grávidas devem informar o médico, pois o Primovist não deve ser usado durante a gravidez, a menos que seja absolutamente necessário.
Amamentação
Mulheres que amamentam ou planeiam amamentar devem informar o médico. O médico discutirá com a paciente se ela deve continuar a amamentar ou interromper a amamentação por 24 horas após a administração do Primovist.
Condução de veículos e uso de máquinas
O Primovist não afeta a capacidade de conduzir veículos ou operar máquinas.
Primovist contém sódio
O medicamento contém 82 mg de sódio (principal componente do sal de cozinha) em cada dose, com base na quantidade administrada a uma pessoa de 70 kg de peso corporal. Isso corresponde a 4,1% da dose diária máxima recomendada de sódio na dieta para adultos.
3. Como usar o Primovist
O Primovist é administrado por injeção intravenosa com uma pequena agulha, logo antes do início do exame de ressonância magnética.
Após a injeção do meio de contraste, o doente permanecerá sob observação por pelo menos 30 minutos.
Dose recomendada
0,1 ml do produto Primovist por quilograma de peso corporal.
Dosagem em grupos especiais de doentes
Não se recomenda o uso do Primovist em doentes com doenças renais graves ou que tenham tido ou vão ter um transplante de fígado em breve. Se a administração for necessária, o doente deve receber apenas uma dose do Primovist durante o exame e não deve receber uma segunda injeção por pelo menos 7 dias.
Pessoas idosas
Não há necessidade de ajustar as doses em doentes com mais de 65 anos, mas deve ser realizado um exame de sangue para controlar a função renal.
Uso de dose maior do que a recomendada do Primovist
O risco de superdose é muito baixo. Se ocorrerem sintomas de superdose, o médico observará o seu curso e tomará as medidas apropriadas.
4. Efeitos secundários possíveis
Como qualquer medicamento, o Primovist pode causar efeitos secundários, embora não em todos os doentes.
A maioria desses efeitos secundários é leve ou moderada.
Se ocorrerem qualquer efeito secundário, deve informar o médico.
Assim como com outros meios de contraste, podem ocorrer reações semelhantes a alergias, embora raramente. Após a administração do Primovist, podem ocorrer reações retardadas após várias horas ou dias.
O efeito secundário mais grave em doentes que receberam o Primovist é o choque anafilactoide (reação alérgica grave).
Se ocorrer qualquer um dos seguintes sintomas ou se tiver dificuldade para respirar, deve informar imediatamente o médico:
- baixa pressão arterial
- inchaço da língua, garganta ou face
- coriza, espirros, tosse
- olhos vermelhos, úmidos e coçados
- dor de estômago
- urticária
- diminuição da sensação ou sensibilidade da pele, coceira, pele pálida
Podem ocorrer os seguintes efeitos secundários adicionais:
Frequentemente:podem ocorrer em 1 de cada 10 doentes
- dor de cabeça
- náuseas
Menos frequentemente:podem ocorrer em 1 de cada 100 doentes
- tontura
- formigamento e dormência
- alterações do paladar ou olfato
- rubor
- aumento da pressão arterial
- alterações da respiração
- vômitos
- secura na boca
- erupções cutâneas
- coceira intensa em todo o corpo ou nos olhos
- dor nas costas, dor no peito
- reações no local da injeção, como
- sensação de queimadura, frio, irritação ou dor
- sensação de calor
- calafrios
- fadiga
- mal-estar
Raramente:podem ocorrer em 1 de cada 1000 doentes
- incapacidade de sentar ou ficar de pé por muito tempo
- trejeção incontrolável
- sensação de batimento cardíaco forte
- batimento cardíaco irregular (sintomas de bloco cardíaco)
- desconforto na boca, aumento da salivação
- erupção cutânea vermelha com bolhas ou manchas na pele
- sudorese excessiva
- desconforto, mal-estar geral
Frequência desconhecida:a frequência não pode ser estimada com base nos dados disponíveis
- batimento cardíaco rápido
- ansiedade
Após a administração do meio de contraste Primovist, foram observadas alterações nos resultados dos exames laboratoriais. Deve informar o pessoal médico que realizar os exames de sangue ou urina se o Primovist foi administrado recentemente.
Foram relatados casos de fibrose sistémica nefrogénica (doença relacionada à fibrose da pele, que também pode afetar os tecidos moles e os órgãos internos) associados ao uso de outros medicamentos que contêm gadolínio.
Notificação de efeitos secundários
Se ocorrerem qualquer efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou o pessoal do centro de ressonância magnética. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos, Agência Reguladora de Medicamentos, Dispositivos Médicos e Produtos Biocidas, Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Fax: + 48 22 49 21 309,
Site: https://smz.ezdrowie.gov.pl.
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar o Primovist
O medicamento deve ser conservado em um local fora do alcance das crianças.
Não use este meio de contraste após a data de validade impressa na etiqueta da seringa e na caixa. A data de validade é o último dia do mês indicado.
Não há precauções especiais para a conservação do medicamento.
O medicamento deve ser usado imediatamente após a abertura.
Antes de usar, o aspecto do medicamento deve ser avaliado visualmente. O medicamento não deve ser usado se houver uma grande alteração na cor, presença de partículas no líquido ou danos na embalagem.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico o que fazer com os medicamentos que não são mais necessários. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o Primovist
- O princípio ativo é o gadoxetato de dissódio. 1 ml da solução para injeção contém 0,25 mmol de gadoxetato de dissódio (o que corresponde a 181,43 mg de gadoxetato de dissódio).
- Os outros componentes do medicamento são: caloxetato de trissódio, trometamol, hidróxido de sódio e ácido clorídrico diluído (ambos para ajustar o pH), água para injeção.
1 seringa pré-cheia com 5,0 ml contém 907 mg de gadoxetato de dissódio,
1 seringa pré-cheia com 7,5 ml contém 1361 mg de gadoxetato de dissódio (apenas seringa de vidro) ,
1 seringa pré-cheia com 10,0 ml contém 1814 mg de gadoxetato de dissódio.
Como é o Primovist e que conteúdo tem a embalagem
O Primovist é uma solução clara, incolor ou ligeiramente amarelada, sem partículas sólidas. O tamanho das embalagens é de 1, 5 ou 10 seringas pré-cheias contendo:
- 5 ml de solução para injeção (em seringa de vidro ou plástico de 10 ml)
- 7,5 ml de solução para injeção (em seringa de vidro de 10 ml) (apenas seringa de vidro)
- 10 ml de solução para injeção (em seringa de vidro ou plástico de 10 ml)
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Bayer AG
Kaiser-Wilhelm-Allee 1
51373 Leverkusen
Alemanha
Fabricante
Bayer AG
Mullerstrasse 178
13353 Berlin
Alemanha
Para obter informações mais detalhadas, deve contatar o representante do titular da autorização de comercialização:
Bayer Sp. z o.o.
Al. Jerozolimskie 158
02-326 Warszawa
tel. (0-22) 572 35 00
Data da última atualização do folheto:Dezembro 2024
--------------------------------------------------------------------------------------------------------------------------------
Informações destinadas exclusivamente ao pessoal médico especializado.
Distúrbios da função renal
Antes da administração do Primovist, é recomendado que todos os doentes sejam submetidos a um exame para detectar distúrbios da função renal, incluindo testes laboratoriais.
Foram relatados casos de fibrose sistémica nefrogénica (FSN) associados ao uso de outros medicamentos que contêm gadolínio em doentes com distúrbios graves da função renal (TFG <30 ml min 1,73 m2).
Os doentes submetidos a transplante de fígado estão particularmente expostos, pois o risco de insuficiência renal aguda é alto neste grupo de doentes. Devido ao risco de FSN associado ao uso do Primovist, deve-se evitar o uso deste medicamento em doentes com distúrbios graves da função renal e em doentes no período pós-operatório de transplante de fígado, a menos que a informação diagnóstica seja necessária e não esteja disponível para o exame de RM sem contraste. Se não for possível evitar o uso do Primovist, a dose não deve ser maior que 0,025 mmol/kg de peso corporal. Não deve ser administrada mais de uma dose durante a imagem. Devido à falta de dados sobre a administração repetida, as injeções do Primovist não devem ser repetidas, a menos que os intervalos entre as injeções sejam de pelo menos 7 dias.
Como a depuração renal do gadoxetato pode ser reduzida em doentes idosos, especialmente importante é monitorar os doentes com mais de 65 anos para detectar distúrbios da função renal.
A hemodiálise logo após a administração do Primovist pode facilitar a remoção do medicamento do organismo. Não há evidências que justifiquem o início da hemodiálise para prevenir ou tratar a FSN em doentes que não estão ainda em diálise.
Gravidez e amamentação
O Primovist não deve ser usado durante a gravidez, a menos que o estado clínico da mulher exija o uso do gadoxetato de dissódio.
O médico e a mãe que amamenta devem decidir se ela deve continuar a amamentar ou interromper a amamentação por 24 horas após a administração do Primovist.
Crianças e jovens
Um estudo observacional foi realizado em 52 doentes pediátricos (com mais de 2 meses e menos de 18 anos). Os doentes foram submetidos a um exame de imagem do fígado por ressonância magnética com administração do Primovist para avaliar lesões focais suspeitas ou conhecidas no fígado.
Informações diagnósticas adicionais foram obtidas comparando imagens sobrepostas do fígado com contraste e sem contraste na ressonância magnética, em comparação com imagens de ressonância magnética sem contraste. Não foram relatados efeitos secundários graves, na opinião do investigador, relacionados ao uso do Primovist. Devido ao caráter retrospectivo e ao pequeno tamanho da amostra deste estudo, não é possível tirar uma conclusão definitiva sobre a eficácia e segurança nesta população.
Antes da administração
O Primovist é uma solução clara, incolor ou ligeiramente amarelada, sem partículas sólidas. Deve sempre verificar o aspecto do medicamento antes de usá-lo. O medicamento não deve ser usado se houver uma grande alteração na cor, presença de partículas no líquido ou danos na embalagem.
A administração do Primovist deve ser feita sem diluição por injeção intravenosa com uma velocidade de fluxo de aproximadamente 2 ml/s. Após a injeção, a cânula/conduto deve ser lavada com solução salina (9 mg/ml).
- após a injeção, o doente deve ser observado por pelo menos 30 minutos.
- não deve ser administrado o Primovist simultaneamente com outros medicamentos.
- não deve ser administrado o Primovist por via intramuscular.
Preparação
O Primovist é uma solução pronta para uso.
A seringa pré-cheia deve ser preparada para a injeção logo antes do exame.
A tampa da seringa pré-cheia deve ser removida logo antes de usá-la.
Qualquer sobra do meio de contraste que não tenha sido usado durante um exame deve ser descartada de acordo com as regulamentações locais.
A etiqueta da seringa pré-cheia deve ser colada na ficha do doente para permitir o registro adequado do medicamento que contém gadolínio utilizado. A dose administrada também deve ser documentada. Se os prontuários dos doentes forem eletrônicos, deve ser registrada a nome do medicamento, o número da série e a dose.
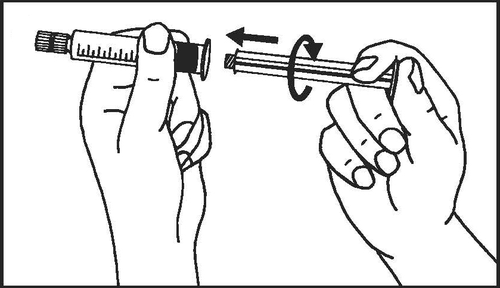
Seringas pré-cheias de vidro:
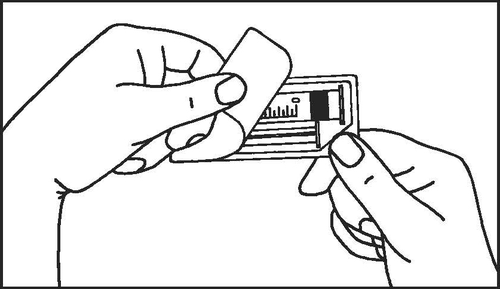
- 1. Abrir a embalagem
- 2. Enroscar o êmbolo da seringa
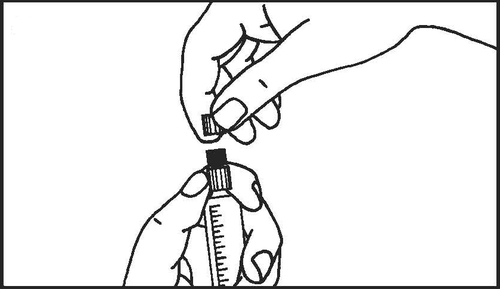
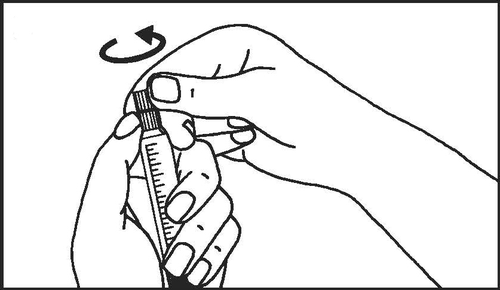
- 3. Quebrar a proteção da tampa da seringa
- 4. Remover a tampa da seringa
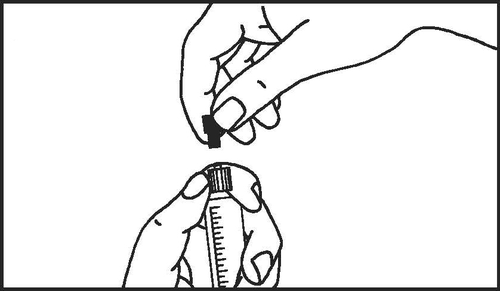
- 5. Remover a tampa de borracha
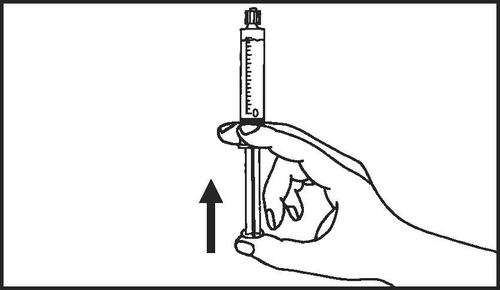
- 6. Remover o ar da seringa
Seringas pré-cheias de plástico
Injeção manual
Injeção com uso de seringa
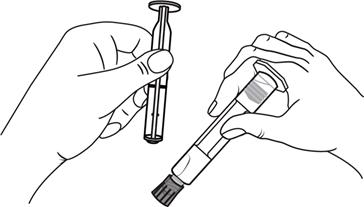
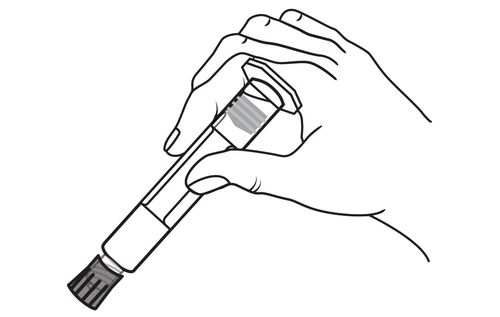
- 1. Retirar a seringa
- 1. Retirar a seringa e o êmbolo
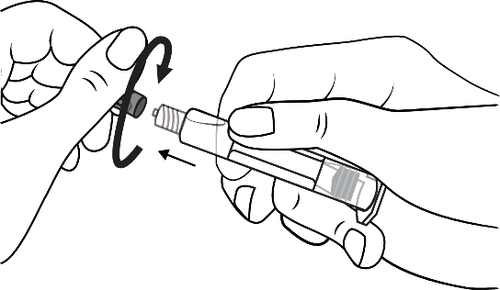
- 2. Abrir a tampa da seringa girando no sentido horário
- 2. Enroscar o êmbolo na seringa de acordo com as setas
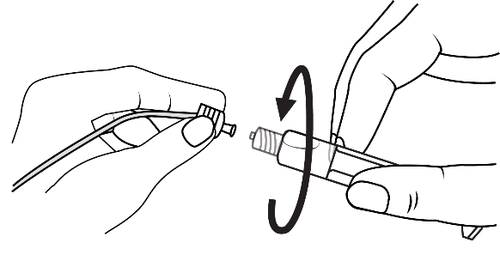
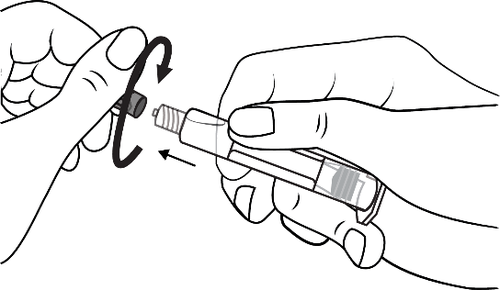
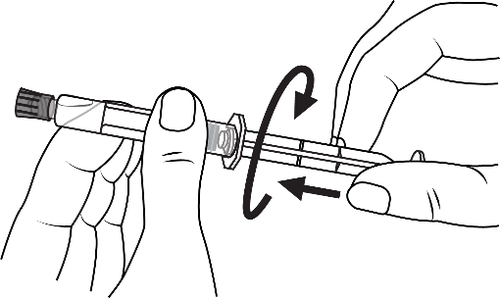
- 3. Conectar a ponta da seringa ao dreno girando no sentido horário e seguir as instruções
- 3. Abrir a tampa da seringa girando no sentido horário e seguir as instruções
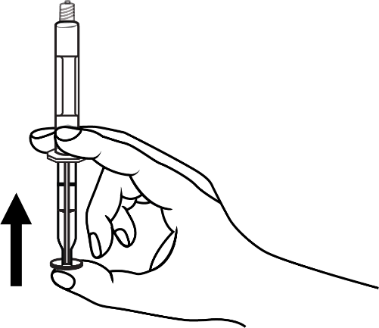
- 4. Remover o ar da seringa
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBayer Pharma AG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PrimovistForma farmacêutica: Solução, 0.5 mmol/mlSubstância ativa: gadoteric acidFabricante: GE Healthcare AS GE Healthcare IrelandRequer receita médicaForma farmacêutica: Solução, 0.5 mmol/mlSubstância ativa: gadoteric acidFabricante: GE Healthcare ASRequer receita médicaForma farmacêutica: Solução, 0.5 mmol/mlSubstância ativa: gadoteric acidFabricante: Sanochemia Pharmazeutika GmbHRequer receita médica
Alternativas a Primovist noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Primovist em Ucrania
Alternativa a Primovist em España
Médicos online para Primovist
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Primovist – sujeita a avaliação médica e regras locais.














