
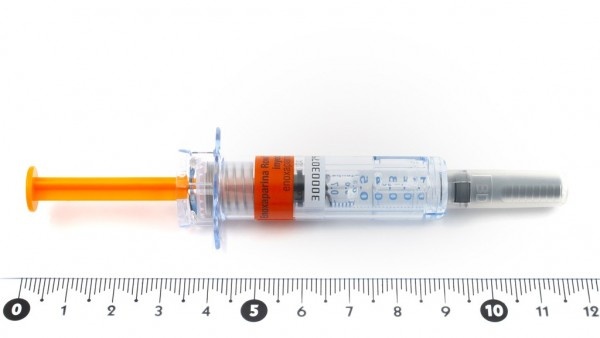
JUNOD 60 mg Solução injetável em seringa pré-carregada

Pergunte a um médico sobre a prescrição de JUNOD 60 mg Solução injetável em seringa pré-carregada

Como usar JUNOD 60 mg Solução injetável em seringa pré-carregada
Introdução
Prospecto: informação para o utilizador
Junod 60 mg solução injetável em seringa pré-carregada
denosumab
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
- O seu médico fornecerá uma tarjeta de recordatório para o paciente, que contém informação importante de segurança que deve conhecer antes e durante o tratamento com Junod.
Conteúdo do prospecto
- O que é Junod e para que é utilizado
- O que necessita saber antes de começar a usar Junod
- Como usar Junod
- Posíveis efeitos adversos
- Conservação de Junod
- Conteúdo do envase e informação adicional
1. O que é Junod e para que é utilizado
O que é Junod e como funciona
Junod contém denosumab, uma proteína (anticorpo monoclonal) que interfere na ação de outra proteína com o objetivo de tratar a perda óssea e a osteoporose. O tratamento com Junod reforça os ossos e reduz as possibilidades de fratura.
O osso é um tecido vivo que se renova continuamente. Os estrógenos contribuem para a conservação da saúde dos ossos.
Nas mulheres, após a menopausa, o nível de estrógenos desce, o que pode provocar que os ossos se tornem mais finos e frágeis. A longo prazo, isso pode provocar uma doença chamada osteoporose.
A osteoporose também pode ocorrer em homens devido a várias causas, incluindo a idade e/ou um nível baixo da hormona masculina, testosterona. Também pode ocorrer em pacientes em tratamento com glucocorticoides.
Muitos pacientes com osteoporose não apresentam sintomas, embora continuem tendo risco de fraturar os ossos, especialmente na coluna, na anca e nos pulsos.
As intervenções cirúrgicas ou os medicamentos que detêm a produção de estrógeno ou testosterona, utilizados para tratar pacientes com cancro da próstata ou da mama, também podem provocar a perda óssea. Com isso, os ossos se tornam mais débeis e se partem com mais facilidade.
Para que é utilizado Junod
Junod é utilizado para tratar:
- a osteoporose pós-menopáusica (pós-menopausa) em mulheres e em homens que têm um risco aumentado de fratura (quebra de ossos), reduzindo o risco de fraturas da anca, da coluna e em localizações que não são a coluna.
- a perda óssea causada pela redução do nível hormonal (testosterona) como consequência de uma operação cirúrgica ou um tratamento com medicamentos em pacientes com cancro da próstata.
- a perda óssea resultante do tratamento a longo prazo com glucocorticoides em pacientes que têm risco elevado de fratura.
2. O que necessita saber antes de começar a usar Junod
Não use Junod
- se tiver níveis baixos de cálcio no sangue (hipocalcemia).
- se for alérgico a denosumab ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a usar Junod
Durante o tratamento com denosumab, você pode desenvolver uma infecção da pele com sintomas como uma zona inflamada e avermelhada na pele, mais frequentemente na parte inferior da perna, que nota quente e sensível ao toque (celulite), e que pode estar acompanhada de febre. Informe o seu médico imediatamente se apresentar algum desses sintomas.
Além disso, deve tomar suplementos de cálcio e vitamina D durante o tratamento com Junod. O seu médico discutirá este aspecto com você.
O seu nível de cálcio no sangue pode descer durante o tratamento com denosumab. Informe o seu médico imediatamente se notar algum dos seguintes sintomas: espasmos, contrações ou cãibras musculares, e/ou entorpecimento ou formigamento nos dedos das mãos, dos pés ou ao redor da boca, e/ou convulsões, confusão ou perda de consciência.
Em raros casos, foram notificados casos de níveis muito baixos de cálcio no sangue que requereram hospitalização e, até, reações potencialmente mortais. Por isso, antes da administração de cada dose e, em pacientes com predisposição para hipocalcemia, em um prazo de duas semanas após a dose inicial, serão verificados os níveis de cálcio no sangue (por meio de uma análise de sangue).
Informe o seu médico se tiver ou tiver tido problemas renais graves, insuficiência renal, se precisou se submeter a diálise ou se está tomando medicamentos chamados glucocorticoides (como prednisolona ou dexametasona), porque podem aumentar o risco de ter níveis baixos de cálcio no sangue se não tomar suplementos de cálcio.
Problemas na boca, dentes ou mandíbula
Em pacientes que recebem denosumab para a osteoporose, foi notificado em raros casos (pode afetar até 1 em cada 1.000 pessoas) um efeito adverso chamado osteonecrose mandibular (ONM) (dano no osso da mandíbula). O risco de ONM aumenta em pacientes tratados durante muito tempo (pode afetar até 1 em cada 200 pessoas se forem tratadas durante 10 anos). A ONM também pode ocorrer após interromper o tratamento. É importante tentar prevenir o desenvolvimento da ONM, porque pode ser uma afecção dolorosa que pode ser difícil de tratar. Para reduzir o risco de desenvolver ONM, siga estas precauções:
Antes de receber o tratamento, informe o seu médico ou enfermeiro (profissional de saúde) se:
- tiver algum problema na boca ou dentes, como má saúde dental, doença das gengivas ou uma extração dental planeada.
- não recebe revisões dentárias periódicas ou faz tempo que não se submeteu a uma revisão dental.
- é fumante (porque pode aumentar o risco de problemas dentários).
- foi tratado previamente com um bisfosfonato (utilizado para prevenir ou tratar distúrbios ósseos).
- está tomando medicamentos chamados corticosteroides (como prednisolona ou dexametasona).
- tiver cancro.
O seu médico pode pedir que se submeta a uma revisão dental antes de iniciar o tratamento com Junod.
Enquanto estiver sendo tratado, deve manter uma boa higiene bucal e se submeter a revisões dentárias rotineiras. Se utilizar prótese dental, deve garantir que esta se ajuste adequadamente. Se estiver em tratamento dental ou se vai se submeter a cirurgia dental (p. ex., extrações dentárias), informe o seu médico sobre o tratamento dental e informe o seu dentista de que está em tratamento com Junod.
Entre em contato com o seu médico e o seu dentista imediatamente se experimentar qualquer problema na boca ou dentes, como dentes móveis, dor ou inflamação, ou úlceras que não curam ou que supuram, porque podem ser sintomas de ONM.
Fraturas inusitadas do fêmur
Algumas pessoas desenvolveram fraturas inusitadas no fêmur enquanto estavam em tratamento com denosumab. Consulte o seu médico se sofrer uma dor nova ou inusitada na anca, virilha ou coxa.
Crianças e adolescentes
Junod não deve ser utilizado em menores de 18 anos de idade.
Outros medicamentos e Junod
Informe o seu médico ou farmacêutico se está tomando, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
É especialmente importante que informe o seu médico se está em tratamento com outro medicamento que contenha denosumab. Não deve usar Junod junto com outro medicamento que contenha denosumab.
Informe o seu médico se está tomando medicamentos chamados glucocorticoides (como prednisolona ou dexametasona), ver também a secção “Advertências e precauções”.
Gravidez e amamentação
Se estiver grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Denosumab não foi testado em mulheres grávidas. Não se recomenda utilizar Junod durante a gravidez. As mulheres em idade fértil devem utilizar métodos anticoncepcionais eficazes durante o tratamento com Junod e pelo menos 5 meses após interromper o tratamento com Junod.
Se engravidar durante o tratamento com Junod ou menos de 5 meses após interromper o tratamento com Junod, informe o seu médico.
Desconhece-se se denosumab é excretado no leite materno. É importante que comunique ao seu médico se está em período de amamentação ou se planeia estar. O seu médico o ajudará a decidir se deve abandonar a amamentação ou se deve deixar de usar Junod, tendo em conta o benefício da amamentação para o bebê e o benefício de Junod para si.
Condução e uso de máquinas
A influência de Junod sobre a capacidade para conduzir e utilizar máquinas é nula ou insignificante.
Junod contém sorbitol, polissorbato 20 e sódio
Este medicamento contém 46 mg de sorbitol em cada ml de solução.
Este medicamento contém 0,1 mg de polissorbato 20 em cada ml de solução. Os polissorbatos podem causar reações alérgicas. Informe o seu médico se você ou seu filho têm alguma alergia conhecida.
Este medicamento contém menos de 1 mmol de sódio (23 mg) por ml; isto é, é essencialmente “isento de sódio”.
3. Como usar Junod
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é uma seringa pré-carregada de 60 mg administrada sob a pele (via subcutânea) em uma única injeção uma vez cada 6 meses.
Os melhores lugares para aplicar a injeção são a parte superior das coxas e o abdômen. Se a injeção for aplicada por um cuidador (pessoa que o atende), também pode administrar a injeção na face externa da parte superior do braço.
Consulte o seu médico sobre a data da próxima possível injeção.
Cada embalagem de Junod contém uma tarjeta de recordatório que pode ser destacada do cartão e utilizada para manter um registro da data da próxima injeção.
Além disso, deve tomar suplementos de cálcio e vitamina D durante o tratamento com Junod. O seu médico discutirá este aspecto com você.
O seu médico pode decidir se é melhor que a injeção de Junod seja administrada por você ou por um cuidador. O seu médico ou profissional de saúde mostrará a você ou ao seu cuidador como utilizar Junod. Se desejar obter instruções sobre como injetar Junod, leia o último item deste prospecto.
Não agite.
Se esquecer de usar Junod
Se saltar uma dose de Junod, a injeção deve ser administrada o mais rápido possível. Posteriormente, as injeções devem ser programadas cada 6 meses a partir da data da última injeção.
Se interromper o tratamento com Junod
Para obter o máximo benefício do seu tratamento e reduzir o risco de fraturas, é importante que use Junod durante todo o período que o médico prescrever. Não interrompa o tratamento sem falar antes com o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os pacientes tratados com denosumab podem desenvolver infecções na pele (principalmente celulite) com pouca frequência (podem afetar até 1 em cada 100 pessoas). Informe o seu médico imediatamentese aparecer algum desses sintomas durante o tratamento com Junod: zona inchada e avermelhada na pele, normalmente na parte inferior da perna, quente e sensível ao toque e que pode estar acompanhada de febre.
Raramente (podem afetar até 1 em cada 1.000 pessoas), os pacientes que recebem denosumab podem desenvolver dor na boca e/ou mandíbula, inflamação ou úlceras que não se curam na boca ou mandíbula, supuração, entorpecimento ou sensação de peso na mandíbula, ou mobilidade de um dente. Estes podem ser sintomas de dano ósseo na mandíbula (osteonecrose). Informe o seu médico e o seu dentista imediatamentese experimentar tais sintomas enquanto estiver em tratamento com Junod ou após interromper o tratamento.
Raramente (podem afetar até 1 em cada 1.000 pessoas), os pacientes que recebem denosumab podem apresentar níveis baixos de cálcio no sangue (hipocalcemia); os níveis muito baixos de cálcio no sangue podem requerer hospitalização e, até, reações potencialmente mortais. Os sintomas incluem espasmos, contrações ou cãibras musculares, e/ou entorpecimento ou formigamento nos dedos das mãos, nos dedos dos pés ou ao redor da boca e/ou convulsões, confusão ou perda de consciência. Se apresentar algum, informe o seu médico imediatamente. Os níveis baixos de cálcio no sangue também podem provocar uma alteração no ritmo do coração chamada prolongamento do QT, que pode ser observada realizando um eletrocardiograma (ECG).
Raramente (podem afetar até 1 em cada 1.000 pessoas), podem ocorrer fraturas inusitadas do fêmur em pacientes que recebem denosumab. Consulte o seu médicose sofrer uma dor nova ou inusitada na anca, virilha ou coxa, porque pode ser uma indicação precoce de uma possível fratura do fêmur.
Raramente (podem afetar até 1 em cada 1.000 pessoas), podem ocorrer reações alérgicas em pacientes que recebem denosumab. Os sintomas incluem inchaço no rosto, lábios, língua, garganta ou outras partes do corpo; erupção, coceira ou urticária na pele, sibilância ou dificuldade para respirar.
Informe o seu médicose experimentar tais sintomas enquanto estiver em tratamento com Junod.
Efeitos adversos muito frequentes (podem afetar mais de 1 em cada 10 pessoas):
- dor de ossos, articulações e/ou músculos que às vezes é intensa,
- dor de pernas ou braços (dor nas extremidades).
Efeitos adversos frequentes (podem afetar até 1 em cada 10 pessoas):
- micção dolorosa, micção frequente, presença de sangue na urina, incontinência urinária,
- infecção do trato respiratório superior,
- dor, formigamento ou insensibilidade que se estende para a parte inferior da perna (ciática),
- prisão de ventre,
- molestias abdominais,
- erupção cutânea,
- afecção cutânea com coceira, vermelhidão e/ou secura (eczema),
- perda de cabelo (alopecia).
Efeitos adversos pouco frequentes (podem afetar até 1 em cada 100 pessoas):
- febre, vômitos e dor ou molestias abdominais (diverticulite),
- infecção do ouvido,
- erupção na pele ou úlceras na boca (erupções liquenoides induzidas por medicamentos).
Efeitos adversos muito raros (podem afetar até 1 em cada 10.000 pessoas):
- reação alérgica que pode danificar os vasos sanguíneos, principalmente da pele (p. ex. manchas de cor púrpura ou vermelho-acastanhado, urticária ou úlceras da pele) (vasculite por hipersensibilidade).
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis):
- consulte o seu médico se tiver dor de ouvido, o ouvido supura e/ou sofre uma infecção de ouvido. Estes podem ser sintomas de dano nos ossos do ouvido.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Junod
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa após “EXP”. A data de validade é o último dia do mês que se indica.
Não utilize este medicamento se observar que a solução contém partículas, ou se está turva ou descolorida.
Conservar na geladeira (entre 2 °C e 8 °C). Não congelar.
Conservar a seringa pré-carregada no embalagem exterior para protegê-la da luz.
Uma vez fora da geladeira, Junod pode ser conservado a temperatura ambiente (até 25 °C) durante um máximo de 30 dias no envase original e no embalagem exterior para protegê-la da luz. Deve ser utilizado dentro de um prazo de 30 dias.
Os medicamentos não devem ser jogados fora pelos esgotos nem pela lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, você ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Junod
- O princípio ativo é o denosumab. Cada ml de seringa precarregada contém 60 mg de denosumab.
- Os outros componentes são ácido acético glacial, hidróxido de sódio, sorbitol (E420), polissorbato 20 (E432) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Junod é uma solução injetável transparente, incolora a ligeiramente amarela, fornecida em uma seringa precarregada pronta para uso.
Um ml de Junod é apresentado em uma seringa precarregada de vidro individual (vidro Tipo I) com um êmbolo FluroTec®, uma agulha (27 G × 12,7 mm) e um protetor rígido da agulha (carcaça rígida de elastômero + polipropileno).
O envase contém uma seringa precarregada com protetor de segurança.
Título da autorização de comercialização
Gedeon Richter Plc.
Gyömroi út 19-21.
1103 Budapeste Hungria
Responsável pela fabricação
Gedeon Richter Plc.
Gyömroi út 19-21.
1103 Budapeste Hungria
Chemical Works of Gedeon Richter Plc.
(Gedeon Richter Plc.)
Richter Gedeon utca 20. Debrecen
4031
Hungria
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste produto também está disponível digitalizando o código QR incluído abaixo ou no embalagem exterior com o seu telemóvel. A mesma informação também está disponível no seguinte URL: www.junodinfo.com
Código QR deve ser incluído
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: https://www.ema.europa.eu, e na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/.
INSTRUÇÕES DE USO
Guia das partes
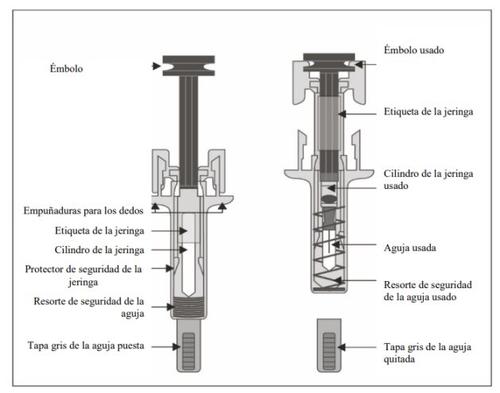
Importante
Antes de usar a seringa precarregada Junod com o protetor automático da agulha, leia toda esta informação importante até o final.Siga as instruções cuidadosamente quando utilizar a seringa.
- É importante que não tente administrar a injeção a si mesmo a menos que tenha recebido a formação por parte do seu médico ou profissional de saúde.
- Junod é apresentado como uma injeção que atravessa o tecido sob a pele (injeção subcutânea).
- Nãoretire a tampa cinza da agulha da seringa precarregada até que esteja pronto para injetar.
- Nãoutilize a seringa precarregada se ela tiver caído sobre uma superfície dura. Utilize uma nova seringa precarregada e contacte com o seu médico ou profissional de saúde.
- Nãotente ativar a seringa precarregada antes da injeção.
- Nãotente eliminar o protetor de segurança da seringa precarregada.
Contacte com o seu médico ou profissional de saúde se tiver alguma dúvida.
Paso 1: Preparação
- Abrir o envase que contém a seringa precarregada e reunir os materiais necessários para a injeção: toalhetas com álcool, uma bola de algodão ou gaze, uma tirita e um recipiente para descartar objetos pontiagudos (não incluídos).
Para uma injeção mais confortável, deixe a seringa precarregada à temperatura ambiente por cerca de 15 – 30 minutos antes de injetá-la. Lave as suas mãos minuciosamente com sabão e água.
Sobre uma superfície de trabalho limpa e bem iluminada, coloque a nova seringa precarregada e os demais materiais.
- Nãotente aquecer a seringa precarregada utilizando uma fonte de calor como água quente ou micro-ondas.
- Nãodeixe a seringa precarregada exposta à luz solar direta.
- Nãoagite a seringa precarregada.
Mantenha a seringa precarregada fora da vista e do alcance das crianças.
- Agarre o protetor de segurança da seringa para retirá-la do envase.
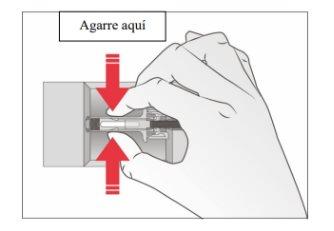
Por motivos de segurança:
- Nãoagarre o êmbolo.
- Nãoagarre a tampa cinza da agulha.
- Examine o medicamento e a seringa precarregada.
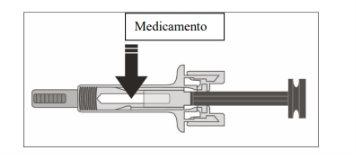
Nãouse a seringa precarregada se:
- O medicamento está turvo ou se há partículas nele. Deve ser uma solução transparente, incolora a ligeiramente amarela.
- Qualquer parte aparece rachada ou quebrada.
- A tampa cinza da agulha está perdida ou não está bem sujeta.
- A data de validade impressa na etiqueta ultrapassou o último dia do mês indicado.
Em todos os casos, consulte com o seu médico ou profissional de saúde.
Paso 2: Prepare-se
- Lave as suas mãos cuidadosamente. Prepare e limpe a zona de injeção.
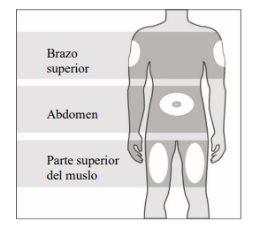
Pode usar:
- Parte superior da coxa.
- Abdômen, a exceção de uma área de 5 cm ao redor do umbigo.
- Área externa do braço superior (somente se alguém lhe administrar a injeção).
Limpe a zona de injeção com uma toalheta com álcool. Deixe que a pele seque.
- Nãotoque a zona de injeção antes de se injetar.
- Nãose injete em áreas onde a pele esteja sensível, contundida, vermelha ou com endurecimentos.
Evite injetar-se em áreas com cicatrizes ou estrias.
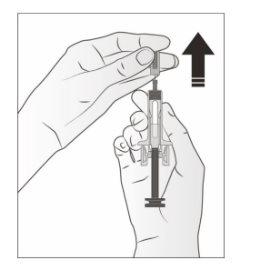
- Tire cuidadosamente a tampa cinza da agulha para fora e longe do seu corpo.
- Pellizque a zona de injeção para criar uma superfície firme.
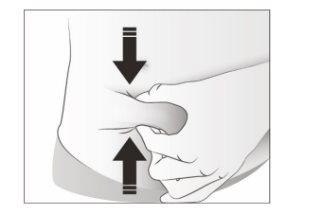
É importante manter a pele pellizcada quando se injeta.
Paso 3: Injete
- Sostenha o pellizco. INSIRA a agulha com um ângulo de 45 a 90 graus na pele.
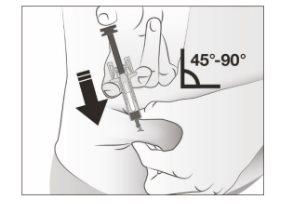
- Nãotoque a área limpa da pele.
- Empurreo êmbolo com pressão lenta e constante até que sinta ou ouça um “clic”. Empurre completamente para baixo até ouvir o “clic”.
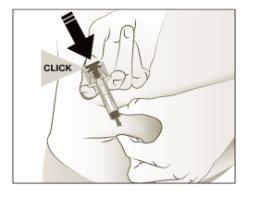
Nota:É importante empurrar para baixo até ouvir “clic” para administrar a dose completa.
- Solteo polegar. A seguir, separea seringa da pele.
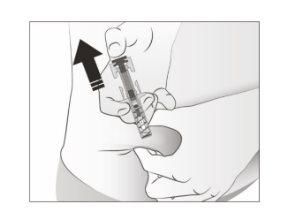
Após soltar o êmbolo, o protetor de segurança da seringa precarregada cobrirá de forma segura a agulha de injeção.
Nãovolte a colocar a tampa cinza da agulha na seringa precarregada usada.
Paso 4: Final
- Descarte a seringa precarregada usada e os demais materiais em um recipiente para descartar objetos pontiagudos.
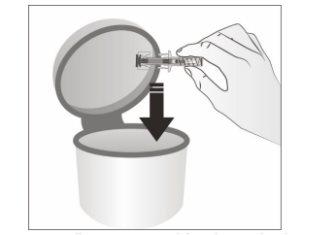
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como descartar os envases e os medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
Mantenha a seringa e o recipiente para descartar objetos pontiagudos fora da vista e do alcance das crianças.
- Nãoreutilize a seringa precarregada.
- Nãorecicle as seringas precarregadas nem as jogue na lixeira.
- Examine a zona de injeção.
Se houver sangue, pressione uma bola de algodão ou uma gaze no local de injeção. Nãoesfregue o local da injeção. Aplique uma tirita se necessário.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a JUNOD 60 mg Solução injetável em seringa pré-carregadaForma farmacêutica: INJETÁVEL, 120 mgSubstância ativa: denosumabFabricante: Fresenius Kabi Deutschland GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 120 mgSubstância ativa: denosumabFabricante: Fresenius Kabi Deutschland GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 60 mgSubstância ativa: denosumabFabricante: Fresenius Kabi Deutschland GmbhRequer receita médica
Alternativas a JUNOD 60 mg Solução injetável em seringa pré-carregada noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a JUNOD 60 mg Solução injetável em seringa pré-carregada em Ukraine
Alternativa a JUNOD 60 mg Solução injetável em seringa pré-carregada em Poland
Médicos online para JUNOD 60 mg Solução injetável em seringa pré-carregada
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de JUNOD 60 mg Solução injetável em seringa pré-carregada – sujeita a avaliação médica e regras locais.










