
IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO

Como usar IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
Ig Vena 50 g/l, solução para perfusão
imunoglobulina humana normal (IgIV)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Ig Vena e para que é utilizado
- O que precisa saber antes de começar a usar Ig Vena
- Como usar Ig Vena
- Possíveis efeitos adversos
- Conservação de Ig Vena
- Conteúdo do envase e informações adicionais
1. O que é Ig Vena e para que é utilizado
Ig Vena é uma solução de imunoglobulina humana normal para administração intravenosa. As imunoglobulinas são anticorpos humanos que também estão presentes no sangue.
Ig Vena é utilizado para:
Tratamento em adultos, crianças e adolescentes (0-18anos) que carecem de suficientes anticorpos (terapia de substituição) nos seguintes casos:
- Pacientes com deficiência congénita na produção de anticorpos (síndromes de imunodeficiência primária).
- Pacientes com deficiência adquirida de produção de anticorpos (imunodeficiências secundárias) que sofrem infecções graves ou recorrentes devido a diferentes condições médicas (por exemplo, doenças oncológicas ou autoimunes ou devido ao tratamento consequente dessas doenças). Estes pacientes foram submetidos a um tratamento com antibióticos que resultou ineficaz e não tiveram um aumento suficientemente significativo do título de anticorpos IgG após a vacinação (vacinas antineumocócicas com antígenos polisacáridos e polipéptidos) ou têm um nível de IgG no sangue de < 4 g/l.
Tratamento em adultos, crianças e adolescentes (0-18 anos) com certas afecçõesinflamatórias(imunomodulação)nos seguintes casos:
- Pacientes que não têm suficientes plaquetas (Trombocitopenia Imune Primária, TIP), com alto risco de sofrer hemorragia ou antes de ser submetidos a uma cirurgia para corrigir o recuento de plaquetas.
- Pacientes com o síndrome de Guillain Barré. Esta é uma doença aguda que se caracteriza por uma inflamação dos nervos periféricos que causa fraqueza muscular grave, principalmente nas pernas e extremidades superiores.
- Pacientes com doença de Kawasaki (em combinação com ácido acetilsalicílico). Esta é uma doença aguda que afeta principalmente as crianças de curta idade e que se caracteriza por uma inflamação dos vasos sanguíneos de todo o corpo.
- Pacientes com Polineuropatia Desmielinizante Inflamatória Crónica (PDIC). Esta doença crónica é um distúrbio raro dos nervos periféricos que se caracteriza por um aumento gradual da fraqueza nas pernas e, em menor grau, nos braços.
- Pacientes com Neuropatia Motora Multifocal (NMM). Se trata de uma doença rara que afeta os nervos motores e que se caracteriza por uma fraqueza assimétrica e lentamente progressiva das extremidades sem perda de sensibilidade.
2. O que precisa saber antes de começar a usar Ig Vena
Não use Ig Vena
- Se é alérgico (hipersensível) às imunoglobulinas humanas ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- Se tem anticorpos contra as imunoglobulinas do tipo IgA no sangue, pois a administração de um medicamento que contém IgA pode causar uma reação alérgica grave.
Advertências e precauções
Consulte o seu médico ou enfermeiro antes de usar Ig Vena.
O seu médico ou profissional de saúde o monitorizará de perto e o observará atentamente durante o período de perfusão com Ig Vena para se certificar de que não sofre reações adversas.
Certas reações adversas podem ocorrer com maior frequência:
- em caso de alta velocidade de perfusão;
- se tem sinais não controlados de infecções não tratadas (por exemplo, febre) ou sinais de inflamação crónica;
- se recebe imunoglobulina humana normal pela primeira vez;
- em casos raros, ao mudar de produto de imunoglobulina humana normal, ou quando há transcorrido um longo período de tempo desde a perfusão anterior.
- Em certos casos, as imunoglobulinas podem aumentar o risco de infarto de miocárdio, acidente vascular cerebral, embolia pulmonar ou trombose venosa profunda, pois incrementam a viscosidade do sangue.
Portanto, o seu médico terá especial precaução nos seguintes casos:
- se tem excesso de peso,
- se tem idade avançada,
- se tem diabetes,
- se padece pressão arterial alta (hipertensão),
- se o volume sanguíneo é muito baixo (hipovolemia),
- se tem ou já teve problemas nos vasos sanguíneos (doenças vasculares),
- se padece uma maior tendência à formação de coágulos (distúrbios trombóticos hereditários ou adquiridos),
- se padece episódios trombóticos,
- se padece uma doença que faz com que o sangue se espesse (viscosidade),
- se esteve acamado por um longo período de tempo,
- se tem ou teve problemas com os rins ou se está tomando medicamentos que podem danificar os rins (medicamentos nefrotóxicos), pois foram notificados casos de insuficiência renal aguda. Em caso de distúrbio renal, o seu médico considerará a interrupção do tratamento.
- Você pode ser alérgico (hipersensível) às imunoglobulinas (anticorpos) sem saber.
Isso pode ocorrer mesmo se você tomou anteriormente imunoglobulinas humanas normais e as tolerou bem. Pode acontecer especialmente se você não tem imunoglobulinas do tipo IgA (deficiência de IgA com anticorpos anti-IgA). Nesses casos raros podem produzir-se reações alérgicas (hipersensibilidade) tais como uma diminuição repentina da pressão arterial ou choque.
Em caso de que se produza uma reação adversa, o seu médico poderá decidir se reduzir a velocidade de administração ou interromper a perfusão. Assim como, o seu médico decidirá o tratamento que requer dependendo da natureza e gravidade do efeito adverso.
Em caso de choque, deverá aplicar-se o tratamento médico estándar correspondente. Por favor, informe o seu médico se padece de pelo menos uma das afecções mencionadas anteriormente, o seu médico terá especial cuidado quando lhe prescrever e administrar Ig Vena.
Segurança face a vírus
Os medicamentos derivados de sangue ou plasma humanos estão sujeitos a um número determinado de medidas de segurança para prevenir a transmissão de infecções aos pacientes. Estas incluem uma cuidadosa seleção de doadores de sangue ou plasma para se certificar de excluir aqueles que estão em risco de ser portadores de infecções, e o análise de cada doação e misturas de plasma para detectar sinais de vírus. Os fabricantes destes medicamentos também incluem medidas no processamento do sangue ou do plasma para inativar ou eliminar os patógenos. Apesar destas medidas, quando se administram medicamentos elaborados a partir de sangue ou plasma humanos, a possibilidade de transmitir uma infecção não pode ser descartada totalmente. Isso também é válido para qualquer vírus desconhecido ou emergente ou outros tipos de infecções.
As medidas adoptadas são consideradas eficazes para vírus com envoltura como o vírus da imunodeficiência humana (VIH), o vírus da hepatite B (VHB), o vírus da hepatite C (VHC), e para o vírus da hepatite A (VHA) sem envoltura.
As medidas tomadas podem ter um efeito limitado nos vírus sem envoltura tais como o parvovirus B19.
As imunoglobulinas não se associaram a infecções por hepatite A ou parvovirus B19, possivelmente porque os anticorpos frente a estas infecções, como os contidos no medicamento, são protectores.
É altamente recomendável que cada vez que receba uma dose de Ig Vena se registe o nome e o número de lote do produto para manter um registo dos lotes utilizados.
Crianças e adolescentes
Observou-se glucosuria transitória e leve (presença de glicose na urina) sem sinais clínicos após a administração de Ig Vena em pacientes pediátricos. Este evento pode estar relacionado com a maltose que contém Ig Vena, pois a maltose se hidrolisa a glicose nos túbulos renais, a qual é reabsorvida e geralmente se excreta muito pouco na urina. A reabsorção de glicose está determinada pela idade. O aumento transitório de maltose no plasma pode exceder a capacidade renal de reabsorção de açúcares e dar resultados positivos no ensaio de glicose na urina.
Outros medicamentos e Ig Vena
Informa o seu médico se está tomando, tomou recentemente ou pudesse ter que tomar qualquer outro medicamento.
A imunoglobulina humana normal para administração intravenosa não deve ser misturada com outros medicamentos nem com qualquer outro produto de IgIV.
Vacinas com vírus vivos atenuados
A administração de imunoglobulina pode alterar a eficácia das vacinas com vírus vivos atenuados como sarampo, rubéola, papeira e varicela durante um período de pelo menos 6 semanas e até 3 meses. Depois da administração deste medicamento, deve-se deixar passar um intervalo de 3 meses antes de administrar vacinas com vírus vivos atenuados. No caso do sarampo, a alteração pode durar até 1 ano. Portanto, devem-se controlar os níveis de anticorpos nos pacientes que recebam a vacina contra o sarampo.
Diuréticos de asa (um grupo de medicamentos que aumentam o fluxo de urina)
Evite o uso concomitante de diuréticos do asa.
Análise de sangue
Ig Vena pode interferir em alguns análises de sangue devido ao aumento transitório de vários dos anticorpos transferidos de forma passiva para o sangue após a injeção de imunoglobulina; este aumento de anticorpos pode gerar resultados enganosos nas provas serológicas. A transmissão passiva de anticorpos para antígenos eritrocitários, por exemplo, A, B, D (que determinam o grupo sanguíneo), pode interferir em algumas provas serológicas para detectar anticorpos de glóbulos vermelhos, por exemplo, a prova de antiglobulina direta (prova de Coombs direta, DAT).
Análise de glicose no sangue
Alguns sistemas de análise de glicose no sangue (por exemplo, aqueles baseados na glicose desidrogenase pirroloquinolinaquinona (GDH-PQQ) ou métodos de glicose-corante-oxidorredutase) interpretam falsamente a maltose (100 mg/ml) contida em Ig Vena como glicose. Isso pode resultar em leituras falsamente elevadas de glicose durante uma perfusão e por um período de aproximadamente 15 horas após finalizar a perfusão e, por conseguinte, na administração inadequada de insulina, causando hipoglicemia que pode pôr em perigo a vida do paciente ou mesmo causar a morte. Assim como, é possível que os casos de hipoglicemia real não sejam tratados se o estado hipoglicêmico resulta em leituras de glicose falsamente elevadas. Portanto, quando se administra Ig Vena ou outros produtos parenterais que contêm maltose, a medição de glicose no sangue deve ser efectuada empregando um método específico para glicose. Deve-se rever atentamente a informação sobre o produto do sistema de medição de glicose no sangue, incluyendo o das tiras reagentes, para determinar se o sistema é adequado para o seu uso com produtos parenterais que contêm maltose. Se existir alguma dúvida, comunique-se com o fabricante do sistema de medição para determinar se o sistema é adequado para o seu uso com produtos parenterais que contêm maltose.
Crianças e adolescentes
Embora não se tenham realizado estudos específicos de interação na população pediátrica, não devem esperar-se diferenças entre crianças e adultos.
Gravidez, lactação e fertilidade
- Se está grávida ou em período de lactação, acha que poderia estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento. O seu médico decidirá se pode utilizar Ig Vena durante a gravidez ou período de lactação.
- Não se realizaram estudos clínicos com Ig Vena em mulheres grávidas. Demonstrou-se que os produtos com IgIV atravessam a placenta, em maior medida durante o terceiro trimestre. No entanto, empregaram-se medicamentos que contêm anticorpos em mulheres grávidas durante anos, e demonstrou-se que não é de esperar efeitos prejudiciais durante a gravidez nem no feto ou recém-nascido.
- Se está em período de lactação e recebe Ig Vena, os anticorpos do medicamento podem passar para o leite materno. Portanto, o seu bebê pode estar protegido de certas infecções.
- A experiência clínica com imunoglobulinas indica que não devem esperar-se efeitos prejudiciais na fertilidade.
Condução e uso de máquinas
A capacidade para conduzir e utilizar máquinas pode ser afectada por algumas reações adversas relacionadas com Ig Vena. Os pacientes que sofram reações adversas durante o tratamento devem esperar até que estas desapareçam para poder conduzir ou utilizar máquinas.
Ig Vena contém maltose e sódio
Este medicamento contém 100 mg de maltose por ml.
Este medicamento contém 69 mg de sódio por litro. Os pacientes com uma dieta baixa em sódio devem ter isto em consideração.
3. Como usar Ig Vena
Ig Vena pode ser administrado unicamente em hospitais ou centros de saúde por médicos ou profissionais de saúde.
A dose e o regime de tratamento dependem da indicação; o médico determinará a dose e o tratamento adequados para si.
No início da perfusão, será administrado Ig Vena a uma velocidade de perfusão lenta. Se tolerar bem, o seu médico pode aumentar gradualmente a velocidade de perfusão.
Uso em crianças e adolescentes
A posologia em crianças e adolescentes (0 a 18 anos) não é diferente da dos adultos, pois a posologia para cada indicação é calculada de acordo com o peso corporal e é ajustada aos resultados clínicos do paciente.
Se usa mais Ig Vena do que deve
Se usa mais Ig Vena do que deve, pode produzir-se uma sobrecarga de líquidos e o sangue pode tornar-se demasiado espesso (hiperviscosidade); isto pode ocorrer especialmente em pacientes de risco, particularmente em pacientes de idade avançada ou pacientes com problemas cardíacos ou renais.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Os seguintes efeitos adversos podem produzir-se geralmente após o tratamento com imunoglobulinas:
- ocasionalmente se comunicaram arrepios, dor de cabeça, tontura, febre, vómitos, náuseas, reações alérgicas, artralgia (dor de articulações), pressão arterial baixa e dor de costas moderada;
- casos isolados de redução temporária no número de eritrócitos no sangue (anemia hemolítica reversível/ hemólise);
- raramente se comunicou uma diminuição repentina da pressão arterial e, em casos isolados, podem produzir-se reações de hipersensibilidade (choque anafiláctico), mesmo quando o paciente não manifestou hipersensibilidade em administrações anteriores;
- se observaram casos raros de reações cutâneas transitórias.
- se notificaram muito raramente eventos tromboembólicos (formação de coágulos) que podem causar infarto de miocárdio, acidente vascular cerebral, obstrução das veias pulmonares (embolia pulmonar) e trombose venosa profunda.
- casos de meningite não infecciosa transitória (meningite asséptica reversível);
- se observou um aumento no nível de creatinina sérica no sangue e/ou insuficiência renal aguda;
- casos de lesão pulmonar aguda relacionada com a transfusão (TRALI).
A lista a seguir inclui, por ordem decrescente de frequência, os efeitos adversos que foram notificados após a administração de Ig Vena em ensaios clínicos e os notificados após a comercialização do medicamento.
Frequentes (podem afetar até 1 de cada 10 pessoas)
- Dor de costas
- Náuseas
- Debilidade generalizada, fadiga, febre
- Dor muscular
- Cefaleia, sonolência
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis)
- Meningite não infecciosa
- Destruição e consequente falta de glóbulos vermelhos
- Reações alérgicas e choque alérgico potencialmente mortal
- Estado de confusão
- Acidente vascular cerebral, tontura, tremor incontrolável, entorpecimento ou sensação de formigueiro na pele ou em uma extremidade
- Ataque cardíaco, coloração azul ou morada da pele, taquicardia, bradicardia, ritmo cardíaco irregular
- Coágulos nas veias maiores e nos vasos sanguíneos, pressão arterial baixa, pressão arterial alta, palidez
- Coágulos na artéria pulmonar principal, volume anormal de líquido nos pulmões, dificuldade para respirar com sibilância ou tos
- Vómitos, diarreia, dor abdominal
- Inchação rápida da pele, urticária, enrubescimento e inflamação da pele, erupção cutânea, prurido, eczema, sudorese excessiva
- Dor muscular e articular, dor de costas, dor de pescoço, rigidez musculoesquelética
- Insuficiência renal súbita
- Inflamação da veia no ponto de injeção, arrepios, dor ou malestar no peito, inchação da face, sensação de malestar geral
- Nível elevado de creatinina no sangue
Outros efeitos adversos em crianças e adolescentes
Espera-se que a frequência, o tipo e a gravidade das reações adversas em crianças sejam os mesmos que em adultos.
Observou-se glucosuria transitória e leve (presença de glicose na urina) sem importância clínica após a administração de Ig Vena em crianças.
Para informação sobre segurança viral, ver a secção 2 “Antes de começar a usar Ig Vena”.
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Ig Vena
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa exterior após “EXP”. A data de validade é o último dia do mês que se indica. Conservar em frigorífico (entre 2°C e 8°C).
Antes de usar, e dentro da vida útil, o medicamento pode ser conservado a temperatura ambiente, sem ultrapassar os 25°C, por um período máximo de 6 meses consecutivos.
Após este período, o medicamento deve ser descartado. Em qualquer caso, o medicamento já não pode ser refrigerado se for conservado a temperatura ambiente.
Registre a data de início de conservação a temperatura ambiente no embalagem externo
Uma vez que o frasco da perfusão se tenha aberto, deve-se utilizar o conteúdo imediatamente.
Mantenha o frasco no embalagem exterior. Não congelar.
Não utilize este medicamento se observar que a solução é turva, contém sedimentos ou mudou de cor.
Os medicamentos não devem ser jogados nos ralos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do frasco e informações adicionais
Composição de Ig Vena
O princípio ativo é imunoglobulina humana normal.
1 ml de solução contém 50 mg de imunoglobulina humana normal.
A solução contém 50 g/l de proteínas humanas, das quais pelo menos 95% é imunoglobulina G (IgG).
As subclases de IgG (IgG) têm a seguinte distribuição:
IgG1 62,1%
IgG2 34,8%
IgG3 2,5%
IgG4 0,6%
O conteúdo máximo de IgA é de 50 microgramas/ml.
Produzido a partir de plasma de doadores humanos.
Os demais componentes são maltose e água para injeções.
Aspecto de Ig Vena e conteúdo do frasco
Ig Vena é uma solução para perfusão, fornecida em frascos individuais de 20, 50, 100 ou 200 ml, com suporte integrado (frasco + suporte). A solução é transparente ou ligeiramente opalescente, incolor ou de cor amarela pálida.
Tamanhos de frascos:
Apresentações de frascos individuais:
1 frasco com 1 g/20 ml.
1 frasco com 2,5 g/50 ml.
1 frasco com 5 g/100 ml.
1 frasco com 10 g/200 ml.
Apresentações de frascos múltiplos:
Frascos múltiplos com 2 frascos individuais de 1 frasco com 10 g/200 ml
Frascos múltiplos com 3 frascos individuais de 1 frasco com 10 g/200 ml
Pode ser que apenas alguns tamanhos de frascos estejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), ITÁLIA.
Responsável pela fabricação
Kedrion S.p.A., 55027 Bolognana, Gallicano (Lucca), ITÁLIA.
Este medicamento está autorizado nos Estados Membros do EEE com os seguintes nomes:
Áustria | Ig Vena 50 g/l Solução para Perfusão |
Alemanha | Ig Vena 50 g/l Solução para Perfusão |
Grécia | Ig VENA |
Itália | Ig VENA |
Polônia | Ig VENA |
Portugal | Ig Vena |
Espanha | Ig Vena |
Data da última revisão deste prospecto:
A seguinte informação está destinada apenas a médicos ou profissionais de saúde:
Instruções para um uso correto
- Ig Vena deve atingir a temperatura ambiente ou corporal antes da sua administração.
- Antes da sua administração, a solução deve ser inspecionada visualmente para detectar a presença de partículas em suspensão e mudanças de cor. Não utilize soluções turvas ou com sedimentos.
- A imunoglobulina humana normal deve ser administrada por via intravenosa a uma velocidade inicial de 0,46 – 0,92 ml/kg/h (10 - 20 gotas por minuto) durante 20 - 30 minutos. Em caso de reação adversa, deve reduzir a velocidade de administração ou suspender a perfusão. Se for bem tolerada, a velocidade de administração pode ser aumentada gradualmente até um máximo de 1,85 ml/kg/h (40 gotas/minuto).
- Em pacientes com IDP que toleram a velocidade de perfusão de 0,92 ml/kg/h, a velocidade de administração pode ser aumentada gradualmente para 2 ml/kg/h, 4 ml/kg/h, até um máximo de 6 ml/kg/h, cada 20-30 minutos e apenas se o paciente tolerar bem a perfusão.
- Em geral, a dose e as velocidades de perfusão devem ser estabelecidas individualmente de acordo com as necessidades do paciente. Dependendo do peso corporal, da dose e da ocorrência de reações adversas, o paciente talvez não atinja a velocidade máxima de perfusão. Em caso de reações adversas, a perfusão deve ser interrompida imediatamente e reiniciada à velocidade de perfusão adequada para o paciente.
Populações especiais
Em pacientes pediátricos (0 a 18 anos) e pessoas de idade avançada (> 64 anos de idade), a velocidade inicial de administração deve ser 0,46 – 0,92 ml/kg/h (10 - 20 gotas por minuto) durante 20 - 30 minutos. Se for bem tolerada e dependendo das condições clínicas do paciente, a velocidade pode ser aumentada gradualmente até um máximo de 1,85 ml/kg/h (40 gotas/minuto).
Instruções para o uso do suporte
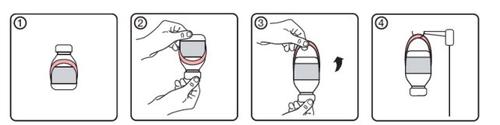
- Estado inicial do frasco com etiqueta do suporte
- Colocar o frasco com a boca para baixo
- Ativar suporte desdobrando-o da etiqueta
- Pendurar o frasco no suporte de perfusão
Precauções especiais
Algumas reações adversas graves ao produto podem ser devidas à velocidade de perfusão.
Com frequência, as possíveis complicações podem ser evitadas assegurando-se de que:
- os pacientes não sejam sensíveis à imunoglobulina humana normal, injetando lentamente o produto no início (velocidade de administração 0,46 – 0,92 ml/kg/h);
- os pacientes sejam monitorizados atentamente para detectar qualquer sintoma durante o período de perfusão. Em particular, os pacientes tratados pela primeira vez com imunoglobulina humana normal, os pacientes que mudaram de produto IgIV, ou quando há um longo período de tempo desde a perfusão anterior, devem ser monitorizados durante a primeira perfusão e durante a primeira hora após a primeira perfusão para detectar possíveis reações adversas. Os demais pacientes devem ser observados por pelo menos 20 minutos após a administração.
Em todos os pacientes, a administração de IgIV requer:
- uma hidratação adequada antes de iniciar a perfusão de IgIV;
- monitorizar a diurese;
- monitorizar os níveis de creatinina sérica;
- evitar o uso concomitante de diuréticos do asa.
Em caso de reação adversa, deve reduzir a velocidade de administração ou suspender a perfusão.
O tratamento necessário depende da natureza e intensidade da reação adversa.
Em caso de choque, deve proceder de acordo com o tratamento médico padrão.
Reação à perfusão
Certas reações adversas (por exemplo, dor de cabeça, rubor, calafrios, mialgia, sibilância, taquicardia, dor lombar, náuseas e hipotensão) podem estar relacionadas à velocidade de perfusão.
Deve respeitar-se estritamente a velocidade de perfusão recomendada.
Os pacientes devem ser vigilados de perto e observados cuidadosamente para detectar qualquer sintoma durante o período de perfusão.
As reações adversas podem ser mais frequentes:
- em pacientes que recebem imunoglobulina humana normal pela primeira vez ou, em casos raros, quando se muda o produto de imunoglobulina humana normal ou quando há um intervalo prolongado desde a perfusão anterior.
- em pacientes com uma infecção não tratada ou uma inflamação crônica subjacente.
Crianças e adolescentes
Não são necessárias medidas ou monitoramento específicos para a população pediátrica.
Espera-se que não haja diferenças na população pediátrica (0 a 18 anos).
Tromboembolismo
Existem evidências clínicas que associam a administração de IgIV com a ocorrência de eventos tromboembólicos, como o infarto do miocárdio, acidente cerebrovascular (incluindo acidente vascular cerebral), embolia pulmonar e trombose venosa profunda, que se supõe estarem relacionados ao aumento relativo da viscosidade sanguínea pelo alto fluxo de imunoglobulina em pacientes de risco. Deve-se ter precaução ao prescrever e administrar a IgIV em pacientes obesos e em pacientes com fatores de risco preexistentes de eventos trombóticos (como idade avançada, hipertensão, diabetes mellitus e com antecedentes de doença vascular ou eventos trombóticos, pacientes com trombofilia congênita ou adquirida, pacientes com períodos prolongados de imobilização, pacientes com hipovolemia grave e pacientes com doenças que aumentam a viscosidade do sangue).
Em pacientes com risco de sofrer reações adversas tromboembólicas, devem ser administrados os produtos de IgIV à menor velocidade de perfusão e dose praticável.
Insuficiência renal aguda
Foram notificados casos de insuficiência renal aguda em pacientes que receberam tratamento com IgIV. Na maioria dos casos, foram identificados fatores de risco, tais como insuficiência renal preexistente, diabetes mellitus, hipovolemia, sobrepeso, tratamento concomitante com fármacos nefrotóxicos ou idade superior a 65 anos.
Devem ser avaliados os parâmetros renais antes da administração de IgIV, especialmente em pacientes com um possível risco elevado de sofrer uma insuficiência renal aguda, e também nos intervalos apropriados. Em pacientes com risco de sofrer uma insuficiência renal aguda, devem ser administrados os produtos de IgIV à menor velocidade de perfusão e dose praticável.
Em caso de insuficiência renal, deve-se considerar a suspensão do tratamento com IgIV.
Enquanto os casos de disfunção renal e de insuficiência renal aguda se associam ao uso de muitos dos produtos de IgIV autorizados que contêm vários excipientes, como sacarose, glicose e maltose, observou-se que existe uma acumulação de casos naqueles que contêm sacarose como estabilizante. Em pacientes de risco, deve-se considerar o uso de produtos de IgIV que não contenham tais excipientes.
Síndrome de meningite asséptica (SMA)
Foi notificado um síndrome de meningite asséptica associado ao tratamento com IgIV.
O síndrome geralmente aparece desde várias horas a 2 dias após o tratamento com IgIV. Os estudos do líquido cefalorraquidiano geralmente revelam pleocitose com vários milhares de células por mm3, principalmente da série granulocítica, e níveis elevados de proteína com vários cientos de mg/dl.
O SMA geralmente ocorre com mais frequência associado a tratamentos com altas doses de IgIV (2 g/kg).
Os pacientes que apresentam esses sinais e sintomas devem receber uma exploração neurológica exhaustiva, incluindo estudos do líquido cefalorraquidiano, para descartar outras causas de meningite.
A interrupção do tratamento com IgIV deu lugar a remissões do SMA em vários dias sem sequelas.
Anemia hemolítica
Os produtos de IgIV podem conter anticorpos de grupos sanguíneos que podem agir como hemolisinas e induzir o recobrimento in vivodos glóbulos vermelhos com imunoglobulina, causando uma reação de antiglobulina direta positiva (teste de Coombs) e, em raros casos, hemólise. A anemia hemolítica pode se desenvolver como consequência do tratamento com IgIV devido ao aumento da captura de glóbulos vermelhos. Devem ser vigilados os sinais e sintomas clínicos de hemólise nos pacientes que recebem IgIV.
Neutropenia/Leucopenia
Após o tratamento com IgIV, foi notificado um declínio transitório no número de neutrófilos e/ou episódios de neutropenia, em ocasões graves. Isso geralmente ocorre nas horas ou dias posteriores à administração de IgIV e se resolve de maneira espontânea em cerca de 7 a 14 dias.
Lesão pulmonar aguda produzida por transfusão (Lesão Pulmonar Aguda Relacionada à Transfusão - TRALI)
Em ocasões, foi notificado edema pulmonar agudo não cardiogênico [Lesão Pulmonar Aguda Relacionada à Transfusão (TRALI)] em pacientes que receberam IgIV. TRALI se caracteriza por hipoxia grave, dispneia, taquipneia, cianose, febre e hipotensão. Os sintomas de TRALI geralmente se desenvolvem durante ou às 6 horas após a transfusão, normalmente às 1-2 horas. Portanto, devem ser monitorizados os receptores de IgIV e a administração de IgIV deve ser suspensa imediatamente em caso de reações adversas pulmonares. A TRALI é uma afecção potencialmente mortal que requer tratamento imediato em uma unidade de cuidados intensivos.
Este medicamento contém 100 mg de maltose por ml como excipiente. A interferência da maltose na análise de glicose no sangue pode resultar em leituras falsamente elevadas de glicose e, consequentemente, na administração inadequada de insulina, causando hipoglicemia que põe em perigo a vida do paciente e pode causar sua morte. Da mesma forma, casos reais de hipoglicemia poderiam ficar sem tratamento se o estado de hipoglicemia ficar mascarado pelos falsos valores elevados de glicose. Para mais detalhes, ver a seção “Análise de glicose no sangue”.
Dose recomendada
A terapia de reposição deve ser iniciada e monitorizada sob a supervisão de um médico com experiência no tratamento de imunodeficiências.
Posologia
A dose e o regime de dosificação dependem da indicação. Pode ser necessário individualizar a dose para cada paciente com base na resposta clínica.
A dose baseada no peso corporal pode requerer um ajuste em pacientes com baixo peso ou sobrepeso.
Pode ser empregado o seguinte regime de dosificação como guia orientativa.
Terapia de reposição em síndromes de imunodeficiência primária
O regime de dosificação deve alcançar uma concentração mínima de IgG (medida antes da próxima perfusão) de pelo menos 6 g/l ou dentro do intervalo de referência normal para a idade da população. São necessários de três a seis meses desde o início do tratamento para estabelecer o equilíbrio (estado estacionário de IgG). A dose inicial recomendada é de 0,4-0,8 g/kg em uma única administração, seguida de pelo menos 0,2 g/kg a cada três ou quatro semanas. A dose necessária para alcançar uma concentração mínima de IgG de 6 g/l é de aproximadamente 0,2-0,8 g/kg/mês. O intervalo de dosificação quando se alcança o estado estacionário varia de 3 a 4 semanas.
As concentrações mínimas de IgG devem ser medidas e avaliadas juntamente com a incidência de infecção. Para reduzir a taxa de infecções bacterianas, pode ser necessário aumentar a dose para alcançar concentrações mínimas mais altas.
Imunodeficiências secundárias
A dose recomendada é de 0,2-0,4 g/kg a cada três ou quatro semanas.
As concentrações mínimas de IgG devem ser medidas e avaliadas juntamente com a incidência de infecção. A dose deve ser ajustada conforme necessário para lograr uma proteção óptima contra as infecções; pode ser necessário um aumento em pacientes com infecção persistente; pode ser considerada uma diminuição da dose quando o paciente permanece livre de infecção.
Trombocitopenia imune primária
Existem dois regimes alternativos de tratamento:
- 0,8 - 1 g/kg no primeiro dia; esta dose pode ser repetida uma vez nos 3 dias seguintes;
- 0,4 g/kg administrados diariamente durante dois a cinco dias.
O tratamento pode ser repetido em caso de recidiva.
Síndrome de Guillain-Barré
0,4 g/kg/dia durante 5 dias (possível repetição da dose em caso de recidiva).
Doença de Kawasaki
Devem ser administrados 2,0 g/kg como dose única. Os pacientes devem receber tratamento concomitante com ácido acetilsalicílico.
Polineuropatia desmielinizante inflamatoria crônica (PDIC)
Dose inicial: 2 g/kg em 2-5 dias consecutivos.
Dose de manutenção:
1 g/kg durante 1-2 dias consecutivos a cada 3 semanas.
Deve ser avaliado o efeito do tratamento após cada ciclo. Se não for observado nenhum efeito no tratamento após 6 meses, deve ser interrompido o tratamento.
Se o tratamento for eficaz, o tratamento a longo prazo ficará sujeito ao critério do médico com base na resposta do paciente e na resposta de manutenção. A dosificação e os intervalos podem precisar ser adaptados de acordo com o curso individual da doença.
Neuropatia motora multifocal (NMM)
Dose inicial: 2 g/kg administrados durante 2-5 dias consecutivos.
Dose de manutenção: 1 g/kg a cada 2 a 4 semanas ou 2 g/kg a cada 4 a 8 semanas.
O efeito do tratamento deve ser avaliado após cada ciclo. Se não for observado nenhum efeito no tratamento após 6 meses, deve ser interrompido o tratamento.
Se o tratamento for eficaz, o tratamento a longo prazo ficará sujeito ao critério do médico com base na resposta do paciente e na resposta de manutenção. A dosificação e os intervalos podem precisar ser adaptados de acordo com o curso individual da doença.
As doses recomendadas são resumidas na tabela seguinte:
Indicação | Dose | Frequência de injeções |
Terapia de reposição: | ||
Síndromes de imunodeficiência primária | Dose inicial: 0,4 – 0,8 g/kg Dose de manutenção: 0,2 – 0,8 g/kg | a cada 3 – 4 semanas |
Imunodeficiências secundárias | 0,2 – 0,4 g/kg | a cada 3 – 4 semanas |
Imunomodulação: | ||
Trombocitopenia imune primária | 0,8 – 1 g/kg ou 0,4 g/kg/d | no dia 1, com possibilidade de repetir uma vez em um prazo de 3 dias durante 2 - 5 dias |
Síndrome de Guillain-Barré | 0,4 g/kg/d | durante 5 dias |
Doença de Kawasaki | 2 g/kg | em uma dose, associado a ácido acetilsalicílico |
Polineuropatia desmielinizante inflamatoria crônica (PDIC) | Dose inicial: 2 g/kg Dose de manutenção: 1 g/kg | em doses divididas durante 2-5 dias a cada 3 semanas durante 1-2 dias |
Neuropatia motora multifocal (NMM) | Dose inicial: 2 g/kg Dose de manutenção: 1 g/kg ou 2 g/kg | durante 2-5 dias consecutivos a cada 2-4 semanas ou a cada 4-8 semanas durante 2-5 dias |
População pediátrica
A posologia em crianças e adolescentes (0 a 18 anos) não é diferente da dos adultos, pois a posologia para cada indicação é calculada com base no peso corporal e ajustada aos resultados clínicos das doenças mencionadas anteriormente.
Insuficiência hepática
Não há dados que justifiquem a necessidade de um ajuste da dose.
Insuficiência renal
Não é necessário ajuste da dose, a menos que esteja clinicamente justificado.
Pacientes de idade avançada
Não é necessário ajuste da dose, a menos que esteja clinicamente justificado.
PDIC
Devido ao fato de se tratar de uma doença rara e, em consequência, ao baixo número total de pacientes, apenas há experiência limitada sobre o uso de imunoglobulinas intravenosas em crianças com PDIC; portanto, apenas há dados disponíveis da literatura. No entanto, os dados publicados são consistentes em mostrar que o tratamento com IgIV é igualmente eficaz em adultos e crianças, tal como é o caso para as indicações já estabelecidas de IgIV.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médica
Alternativas a IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO em Polónia
Alternativa a IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO em Ukraine
Médicos online para IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de IG VENA 50 G/L SOLUÇÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














