
GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO

Como usar GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
Gamunex 100mg/ml solução para perfusão
imunoglobulina humana normal (IgIV)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Gamunex e para que é utilizado
- O que precisa saber antes de começar a usar Gamunex
- Como usar Gamunex
- Possíveis efeitos adversos
- Conservação de Gamunex
Conteúdo do envase e informações adicionais
1. O que é Gamunex e para que é utilizado
O que éGamunex
Gamunex contém imunoglobulina normal humana (anticorpos) como proteína altamente purificada extraída a partir de plasma humano (parte do sangue dos doadores). Este medicamento pertence a um grupo de medicamentos chamado imunoglobulinas intravenosas, que são utilizados para tratar as doenças em que o sistema de defesa do organismo que permite lutar contra as doenças não funciona corretamente.
Para que é utilizadoGamunex
Tratamento em adultos, crianças e adolescentes (0-18 anos) que carecem de anticorpos suficientes (tratamento de reposição) como:
- Pacientes com síndrome de imunodeficiência primária (SIP), uma deficiência congênita de anticorpos.
- Pacientes com imunodeficiência adquirida (IDS) com infecções graves ou recorrentes, tratamento antibiótico ineficaz e deficiência de anticorpos específicos demonstrada ou um nível de IgG sérico <4 g/l.
Tratamento em adultos, crianças e adolescentes (0-18 anos) suscetíveis que estiveram expostos ao sarampo ou têm um risco de uma futura exposição ao sarampo e nos quais a imunização ativa contra o sarampo está contraindicada ou não é recomendável.
Tratamento em adultos, crianças e adolescentes (0-18 anos) com certas doenças autoimunes (imunomodulação). São classificadas em cinco grupos:
- Trombocitopenia imune primária, uma afecção em que o número de plaquetas no torrente sanguíneo está drasticamente reduzido. As plaquetas são uma parte importante do processo de coagulação e um número reduzido de plaquetas pode causar hemorragias e hematomas não desejados. Este medicamento também é utilizado em pacientes com alto risco de hemorragia ou antes de uma intervenção cirúrgica, para corrigir o número de plaquetas.
- Síndrome de Guillain Barré, uma afecção em que o sistema imunológico ataca os nervos e impede que funcionem corretamente.
- Doença de Kawasaki (neste caso, juntamente com ácido acetilsalicílico), uma doença infantil em que se agrandam os vasos sanguíneos (artérias) do corpo.
- Polirradiculoneuropatia desmielinizante inflamatória crônica (PDIC), uma doença rara e progressiva que causa fraqueza nas extremidades, entorpecimento, dor e fadiga.
- Neuropatia motora multifocal (NMM), uma doença rara que causa fraqueza nas extremidades de forma lenta e progressiva sem perda sensorial.
Tratamento em adultos de 18 anos ou mais com:
Exacerbações agudas graves de miastenia gravis. Miastenia gravis é uma doença que causa fraqueza muscular; as exacerbações afetam principalmente a deglutição, a fala e a respiração.
2. O que precisa saber antes de começar a usar Gamunex
Não useGamunex
- se é alérgico às imunoglobulinas normais humanas ou a algum dos outros componentes deste medicamento (incluídos na secção 6);
- se não tem imunoglobulinas do tipo IgA no sangue e desenvolveu anticorpos contra IgA.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Gamunex.
Reações à perfusão e hipersensibilidade
Certas reações adversas podem estar relacionadas com a velocidade de perfusão. Por isso, deve seguir a velocidade de perfusão recomendada (ver “Informação destinada a profissionais do setor sanitário” no final deste prospecto).
Certos efeitos adversos podem ocorrer com maior frequência:
- em caso de velocidade de perfusão alta;
- em pacientes com ausência completa de gama-globulinas ou níveis baixos de gama-globulina (agamaglobulinemia ou hipogamaglobulinemia) com ou sem deficiência de IgA;
- em pacientes que recebem imunoglobulina humana normal pela primeira vez ou, em casos raros, ao mudar o medicamento de imunoglobulina ou após um intervalo prolongado sem tratamento.
As possíveis complicações podem ser evitadas assegurando que:
- não é hipersensível à imunoglobulina humana administrando a perfusão inicial de Gamunex lentamente,
- é observado atentamente para detectar algum sintoma durante o período de perfusão. Sobretudo se for a primeira vez que recebe uma imunoglobulina humana, se lhe foi mudado de outra imunoglobulina diferente ou se levou algum tempo sem receber tratamento, deve ser controlado por si apresenta possíveis efeitos adversos durante a primeira perfusão e durante uma hora após a mesma.
Em caso de ocorrerem efeitos adversos, deve reduzir a velocidade de perfusão ou suspender a perfusão até que os sintomas desapareçam. Se os sintomas persistirem mesmo após suspender a perfusão, deve começar um tratamento adequado. Em caso de uma reação de choque (choque anafilático com forte queda da tensão arterial), deve interromper imediatamente o tratamento com o medicamento e iniciar o tratamento médico habitual atual para o choque.
Pacientes com um problema renal e outros fatores de risco
Foram comunicados casos de distúrbios da função renal e insuficiência renal aguda em relação com a administração intravenosa de imunoglobulinas. Corre um risco especial se tem certos fatores de risco como alteração da função renal preexistente (insuficiência renal), diabetes (diabetes mellitus) ou volume de sangue reduzido (hipovolemia). Outras circunstâncias que são consideradas fatores de risco são o sobrepeso ou o tratamento simultâneo com medicamentos que têm efeitos nocivos nos rins e/ou se tem mais de 65 anos. Em qualquer caso, deve tomar as seguintes precauções:
- beba bastante para garantir uma ingestão adequada de líquidos antes de começar o tratamento;
- o seu médico deve controlar a quantidade de urina e medir a função renal;
- não utilize simultaneamente certos medicamentos que podem aumentar a quantidade de urina (diuréticos do asa).
A velocidade de perfusão no seu caso deve ser a mais lenta possível e a imunoglobulina deve ser utilizada à concentração mais baixa possível. Se ocorrer um distúrbio da função renal, o seu médico considerará a suspensão do tratamento com imunoglobulina.
Hemólise (destruição anormal dos glóbulos vermelhos)
É comunicado com frequência que as imunoglobulinas aumentam o risco de destruição dos glóbulos vermelhos (hemólise) em adultos e crianças. Se lhe forem administradas doses altas de IgIV no mesmo dia ou durante vários dias e o seu grupo sanguíneo é A, B ou AB e/ou tem uma afecção inflamatória subjacente, pode correr um maior risco de destruição dos glóbulos vermelhos (hemólise).
Nos relatórios pós-comercialização, foi observado que as indicações de doses altas de IgIV em crianças, especialmente a doença de Kawasaki, estão associadas a um maior número de relatórios de reações hemolíticas do que em outras indicações de IgIV em crianças.
Deve procurar um médico se desenvolver palidez (pele pálida), letargia (sensação de fraqueza), urina escura, falta de ar ou palpitações (ritmo cardíaco rápido).
Foram produzidos casos isolados de insuficiência renal associada a hemólise com um desfecho mortal.
Informação sobre a segurança em relação às infecções
Quando os medicamentos são fabricados a partir de sangue ou plasma humanos, são adotadas certas medidas para evitar a transmissão de infecções aos pacientes. Estas medidas incluem:
- seleção meticulosa dos doadores de sangue ou plasma para se certificar de que se exclua os que têm risco de transmitir infecções,
- análise de cada doação e das misturas de plasma para detectar possíveis vírus ou infecções,
- inclusão de passos no processamento do sangue ou do plasma que podem inativar ou eliminar os vírus.
Apesar destas medidas, quando se administram medicamentos preparados a partir de sangue ou plasma humanos, não se pode excluir totally a possibilidade de transmissão de infecções. Isso também é aplicável a vírus desconhecidos ou emergentes e a outros tipos de infecções.
As medidas tomadas são consideradas eficazes para os vírus envoltos como o vírus da imunodeficiência humana (VIH), o vírus da hepatite B e o vírus da hepatite C. As medidas tomadas podem ter um valor limitado para vírus não envoltos como o vírus da hepatite A e/ou o parvovirus B19. As imunoglobulinas não se associaram a infecções pelo vírus da hepatite A nem pelo parvovirus B19, possivelmente devido a que os anticorpos contra estas infecções, que estão contidos no produto, são protectores.
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose única (até um máximo de 2 g/kg); isto é, é essencialmente “isento de sódio”.
Recomenda-se encarecidamente que, cada vez que lhe for administrada uma dose deste medicamento, se tome nota do nome e do número do lote do produto, a fim de manter um registo dos lotes utilizados.
Outros medicamentos e Gamunex
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Deve evitar o uso concomitante de medicamentos que aumentem a eliminação de água do seu corpo (diuréticos do asa) durante o tratamento com Gamunex.
Efeitos sobre as vacinas: Gamunex pode reduzir a eficácia de certos tipos de vacinas (vacinas com vírus vivos atenuados). No caso da rubéola, as papeiras e a varicela, deve transcorrer um período de até 3 meses entre a administração deste medicamento e a administração dessas vacinas. No caso do sarampo, o período pode chegar a ser de até 1 ano.
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Condução e uso de máquinas
Podem ocorrer tonturas ou outras reações que possam afetar a capacidade para conduzir e utilizar máquinas. Se isso ocorrer, deve esperar até que desapareçam estes sintomas antes de conduzir ou utilizar máquinas.
3. Como usar Gamunex
O médico lhe injetará Gamunex nas suas veias (administração intravenosa).
A dose que receberá dependerá da sua doença e peso corporal, e será o seu médico quem a determinará (ver a secção “Informação destinada apenas a profissionais do setor sanitário” que aparece no final deste prospecto).
No início da perfusão, receberá Gamunex a uma velocidade lenta. Depois, dependendo de como se sentir, o médico pode aumentar gradualmente a velocidade de perfusão.
Se interromper o tratamento comGamunex
Se interromper o tratamento com este medicamento, o seu estado clínico pode piorar. Fale com o médico responsável pelo seu tratamento se quiser interromper prematuramente o tratamento com este medicamento.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Em casos raros e isolados, foram comunicados os seguintes efeitos adversos com os preparados de imunoglobulinas. Procure atenção médica imediata se experimentar algum dos seguintes efeitos adversos durante ou após a perfusão:
- Queda repentina da tensão arterial e, em casos isolados, choque anafilático (cujos sinais são erupção cutânea, tensão arterial baixa, ritmo cardíaco rápido ou irregular, sibilância, tosse, espirros e dificuldade para respirar, entre outros), mesmo que não tenha mostrado nenhuma reação alérgica em uma administração anterior.
- Casos de meningite não infecciosa temporária (cujos sinais são dor de cabeça, medo ou intolerância à luz, rigidez no pescoço).
- Casos de diminuição transitória do número de glóbulos vermelhos no sangue (anemia hemolítica/hemólise reversível).
- Casos de reações passageiras na pele.
- Aumento do nível de creatinina sérica (um exame que mede a função renal) e/ou insuficiência renal aguda (cujos sinais são dor lombar, fadiga, diminuição da quantidade de urina).
- Reações tromboembólicas como, por exemplo, infarto do miocárdio (pressão ao redor do peito com sensação de que o coração bate muito rápido), acidente vascular cerebral (fraqueza muscular na face, no braço ou na perna, problemas para falar ou entender o que os outros estão dizendo), embolia pulmonar (falta de ar, dor no peito e fadiga), trombose venosa profunda (dor e inchaço em uma extremidade).
- Casos de lesão pulmonar aguda relacionada com a transfusão (LPART) que causa hipóxia (falta de oxigênio), dificuldade para respirar, respiração rápida, coloração azulada da pele ou das membranas mucosas, febre e tensão arterial baixa.
Nos ensaios clínicos realizados com Gamunex, foram observados os seguintes efeitos adversos:
Os seguintes efeitos adversos foram frequentes (podem afetar até 1 de cada 10 perfusões):
- dor de cabeça
- febre
Os seguintes efeitos adversos foram pouco frequentes (podem afetar até 1 de cada 100 perfusões):
- tonturas
- urticária (erupções cutâneas, vermelhidão, coceira da pele)
- prurido (coceira)
- erupção cutânea
- náuseas
- vómitos
- tensão arterial alta
- inflamação da garganta
- tosse
- nariz entupido
- sibilância
- dor nas articulações
- dor nas costas
- síndrome pseudogripal
- fadiga
- calafrios
- astenia (fraqueza)
- dor muscular
Os seguintes efeitos adversos foram raros (podem afetar até 1 de cada 1.000 perfusões):
- anemia hemolítica (destruição dos glóbulos vermelhos)
- dificuldade para respirar
- sinusite
- descamação da pele
- ansiedade
- diminuição da hemoglobina
- digestão pesada
- contusão
- rubor
- rigidez musculoesquelética
- eritema palmar (vermelhidão das palmas das mãos)
- afonia (perda da voz)
- diminuição do recuento de glóbulos brancos
- dermatite (inflamação da pele) ou dermatite de contato
- dor abdominal
- diarreia
- tensão arterial baixa
- dor no pescoço
- dor musculoesquelética
- dor no peito
- mal-estar geral
- reação no local da injeção
- uretrite (dor ou dificuldade para urinar)
- infecção viral nas vias respiratórias altas (doença causada por uma infecção aguda que afeta as vias respiratórias altas, incluindo o nariz, os seios paranasais e a garganta)
- linfocitose (aumento no número de um tipo concreto de glóbulos brancos)
- hipersensibilidade (reação alérgica)
- sensibilidade dos olhos à luz
- crise hipertensiva (aumento agudo da tensão arterial)
- hiperemia (aumento do fluxo sanguíneo)
- hemoglobinúria (concentrações anormalmente altas na urina da proteína que transporta oxigênio no sangue)
- aumento da tensão arterial
- presença de hemoglobina livre (hemoglobina que circula fora dos glóbulos vermelhos)
- aumento da velocidade de sedimentação dos glóbulos vermelhos (aumento da velocidade de assentamento dos glóbulos vermelhos em um tubo de ensaio)
Que medidas devem ser tomadas em caso de sofrer efeitos adversos
Se ocorrerem efeitos adversos, deve reduzir a velocidade de perfusão ou suspender a perfusão até que os sinais dos efeitos adversos tenham desaparecido. Se os sinais persistirem mesmo após suspender a perfusão, deve administrar um tratamento adequado.
Em caso de uma reação de hipersensibilidade grave com uma queda da tensão arterial e dispneia até o ponto de apresentar uma reação alérgica generalizada grave (choque anafilático), deve suspender imediatamente o uso deste medicamento e iniciar as medidas adequadas.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Gamunex
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e no frasco. O período de validade é de 3 anos.
Conservar em frigorífico (2 - 8°C). Não congelar. Manter o frasco na caixa exterior.
O medicamento pode ser conservado na sua caixa exterior durante um período único de até 6 meses a temperatura ambiente (máximo 25°C). Neste caso, o período de validade do medicamento caduca ao final destes 6 meses, independentemente da data de validade original. A nova data de validade deve ser anotada na caixa exterior. No entanto, a nova data de validade não deve ser posterior à data de validade impressa. Não se pode voltar a refrigerar.
Uma vez aberto o envase individual, o conteúdo deve ser utilizado imediatamente. Deve ser descartado qualquer resto. Não é permitido continuar a conservar o medicamento, nem mesmo na geladeira, devido à possível invasão de germes.
6. Conteúdo do envase e informação adicional
Composição de Gamunex
O princípio ativo é imunoglobulina humana normal (IgIV). Um ml deste medicamento contém 100 mg de proteína com um teor de IgG de pelo menos 98 % em água para preparações injetáveis.
Um frasco de 10 ml contém: 1 g de imunoglobulina humana normal
Um frasco de 50 ml contém: 5 g de imunoglobulina humana normal
Um frasco de 100 ml contém: 10 g de imunoglobulina humana normal
Um frasco de 200 ml contém: 20 g de imunoglobulina humana normal
Um frasco de 400 ml contém: 40 g de imunoglobulina humana normal
O percentagem de subclasses de IgG é aproximadamente de 62,8% (IgG1), 29,7% (IgG2), 4,8% (IgG3) e 2,7% (IgG4).
O teor máximo de IgA é de 84 microgramas/ml.
Os outros componentes são glicina e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Gamunex é uma solução para perfusão. A solução é transparente a ligeiramente opalescente e incolora a cor amarela pálida.
Gamunex é apresentado em tamanhos de envase de 10 ml, 50 ml, 100 ml, 200 ml e 400 ml. A caixa contém um frasco fabricado em vidro com um tampão (clorobutilo), uma etiqueta com uma parte desprendível que se converte em alça e um prospecto.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização:
Grifols Deutschland GmbHColmarer Straße 2260528 FrankfurtAlemanha
Tel.:+49 69/660 593 100
Responsável pela fabricação:
Instituto Grifols, S.A.
Can Guasc, 2 – Parets del Vallès
08150 Barcelona
Espanha
Representante local:
Instituto Grifols, S.A.
Can Guasc, 2 – Parets del Vallès
08150 Barcelona
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes:
Alemanha, Áustria, Bélgica, Chipre, Irlanda, Luxemburgo, Países Baixos, Polónia, Portugal, Reino Unido (Irlanda do Norte): Gamunex 10% 100mg/ml
Dinamarca, Eslováquia, Espanha, Finlândia, França, Hungria, Itália, Noruega, República Checa, Suécia: Gamunex 100mg/ml
Grécia: Gaminex 10% 100mg/ml
Data da última revisão deste prospecto:Setembro 2022.
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/)
? ---------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do sector sanitário:
Utilizar unicamente soluções para perfusão transparentes ou ligeiramente opalescentes e incolores ou de cor amarela pálida que estejam livres de partículas – não agitar. Antes da perfusão, deixar que Gamunex atinja a temperatura ambiente ou a temperatura corporal (por exemplo mediante um banho maria a uma temperatura máxima de 37°C).
Os frascos são fornecidos com uma etiqueta com uma alça desprendível (Fig. 1). Depois de introduzir o equipamento de perfusão (Fig. 2), inverta o frasco e dobre para trás a parte da etiqueta correspondente à alça (Fig. 3). Pressione firmemente com o dedopara criar um dobroem cada lado onde a alça se une ao resto da etiqueta (Fig. 4). Pendure o frasco do portasueros utilizando a alça resultante (Fig. 5).
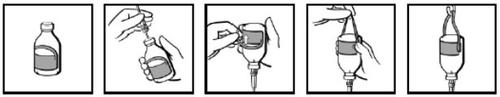
Fig. 1 Fig. 2 Fig. 3 Fig. 4 Fig. 5
Posologia e forma de administração
A dose e a pauta posológica dependem da indicação.
Pode ser necessário individualizar a dose para cada paciente em função da resposta clínica. A dose baseada no peso corporal pode necessitar de um ajuste em pacientes com baixo peso ou com sobrepeso. As seguintes pautas posológicas são indicadas a título orientativo.
A posologia recomendada é resumida na seguinte tabela:
Indicação | Dose | Frequência das perfusões |
Tratamento de reposição | ||
Síndromes de imunodeficiência primária | Dose inicial: 0,4-0,8 g/kg Dose de manutenção: 0,2-0,8 g/kg | Cada 3-4 semanas |
Imunodeficiências secundárias | 0,2-0,4 g/kg | Cada 3-4 semanas |
Profilaxia pré-/pós-exposição ao sarampo: | ||
Profilaxia pós-exposição em pacientes suscetíveis | 0,4 g/kg | O mais cedo possível e dentro dos 6 dias seguintes, podendo ser repetida uma vez após 2 semanas para manter os níveis séricos de anticorpos contra o sarampo > 240 mIU/ml |
Profilaxia pós-exposição em pacientes com IDP/IDS | 0,4 g/kg | Além da terapia de manutenção, administrada como uma dose extra dentro dos 6 dias seguintes à exposição |
Profilaxia pré-exposição em pacientes com IDP/IDS | 0,53 g/kg | Se um paciente recebe uma dose de manutenção inferior a 0,53 g/kg cada 3-4 semanas, esta dose deve ser aumentada uma vez até pelo menos 0,53 g/kg |
Imunomodulação: | ||
Trombocitopenia imune primária | 0,8-1 g/kg ou 0,4 g/kg/d | No dia 1, podendo ser repetida uma vez nos 3 dias seguintes De 2 a 5 dias |
Síndrome de Guillain Barré | 0,4 g/kg/d | Durante 5 dias |
Doença de Kawasaki | 2 g/kg | Em uma dose junto com ácido acetilsalicílico |
Polirradiculoneuropatia desmielinizante inflamatória crónica (PDIC) | Dose inicial: 2 g/kg Dose de manutenção: 1 g/kg | Em doses repartidas ao longo de 2 a 5 dias Cada 3 semanas em doses repartidas durante 1 a 2 dias |
Neuropatia motora multifocal (NMM) | Dose inicial: 2 g/kg Dose de manutenção: 1 g/kg ou 2 g/kg | Em doses repartidas ao longo de 2 a 5 dias consecutivos Cada 2 a 4 semanas ou Cada 4 a 8 semanas em doses repartidas ao longo de 2 a 5 dias |
Exacerbações agudas graves de miastenia gravis | 2 g/kg | Repartidas ao longo de 2 dias consecutivos (dose de 1 g/kg por dia) |
Forma de administração
Via intravenosa.
A imunoglobulina humana normal deve ser administrada por via intravenosa a uma velocidade inicial de 0,6-1,2 ml/kg/h durante 0,5 h. Em caso de reação adversa, a velocidade de administração deve ser reduzida ou a perfusão interrompida. Se for bem tolerada, a velocidade de administração pode ser aumentada gradualmente até um máximo de 4,8-8,4 ml/kg/h.
População pediátrica
A posologia em crianças e adolescentes (0-18 anos) não é diferente da dos adultos, já que a posologia para cada indicação é calculada de acordo com o peso corporal e ajustada ao resultado clínico das doenças antes mencionadas.
Gamunex não deve ser misturado com outras soluções para perfusão nem com outros medicamentos. Se for necessário realizar uma diluição antes da perfusão, pode ser utilizada uma solução de 50mg/ml de glicose. Não diluir com soluções salinas.
Deve-se evitar a administração simultânea de Gamunex e heparina através de um dispositivo de administração de um único lúmen.
As vias por onde se perfunde Gamunex podem ser irrigadas com uma solução de 50mg/ml de glicose ou com solução de cloreto de sódio (9mg/ml) e não devem ser irrigadas com heparina.
A via heparinizada pela qual se tenha administradoGamunex deve ser irrigada com uma solução de 50mg/ml de glicose ou com uma solução de cloreto de sódio (9mg/ml) e não deve ser irrigada com heparina.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médica
Alternativas a GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO em Polónia
Alternativa a GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO em Ukraine
Médicos online para GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de GAMUNEX 100 mg/mL SOLUÇÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.











