
BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL

Como usar BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Butilescopolamina Kalceks 20mg/ml solução injetável EFG
butilescopolamina bromuro
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Butilescopolamina Kalceks e para que se utiliza
- O que precisa saber antes de que lhe administrem Butilescopolamina Kalceks
- Como se lhe administra Butilescopolamina Kalceks
- Possíveis efeitos adversos
- Conservação de Butilescopolamina Kalceks
- Conteúdo do envase e informação adicional
1. O que é Butilescopolamina Kalceks e para que se utiliza
Butilescopolamina Kalceks contém a substância ativa butilescopolamina bromuro. Esta pertence a um grupo de medicamentos denominados antiespasmódicos. Estes medicamentos aliviam os espasmos (contracções parecidas com cãibras) dos órgãos internos e aliviam a dor que se deriva deles.
Este medicamento é utilizado para aliviar os espasmos dos músculos lisos dos tratos digestivo e genitourinário (estômago, intestinos, vias biliares, pâncreas e vias urinárias).
Butilescopolamina Kalceks também pode ser usado em procedimentos de diagnóstico médico.
2. O que precisa saber antes de que lhe administrem Butilescopolamina Kalceks
Não useButilescopolamina Kalceks
- se é alérgico a butilescopolamina bromuro ou a algum dos outros componentes deste medicamento (incluídos na secção 6)
- se padece glaucoma (doença dos olhos)
- se tem a próstata aumentada e apresenta dificuldades ou dor ao urinar
- se apresenta obstrução intestinal
- se tem o intestino anormalmente aumentado (megacólon)
- se tem um aumento da frequência cardíaca
- se padece uma doença chamada miastenia gravis (caracterizada por uma debilidade muscular extrema).
Não deve receber nenhuma injeção de butilescopolamina bromuro no músculo se está tomando medicamentos para evitar a formação de coágulos de sangue (anticoagulantes), porque pode produzir-se um hematoma (cardenal).
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começarem a administrar-lhe este medicamento:
- se apresenta uma dor abdominal de origem desconhecida que persiste ou piora, ou aparece com sintomas, como febre, náuseas, vómitos, alterações nas deposições, dor à palpação no abdômen, diminuição da tensão arterial, desmaio ou presença de sangue nas fezes
- se o intestino deixa de funcionar corretamente (atonía intestinal)
- se padece inflamação do esófago associada ao refluxo ácido (quando o ácido do estômago sobe e entra no esófago)
- se tem uma inflamação grave do cólon que reaparece com frequência (colite ulcerosa)
- se tem problemas de fígado ou rim
- se tem hipertireoidismo (quando a glândula tireoide produz demasiadas hormonas tireoides)
- se tem bronquite crónica (inflamação dos brônquios).
Deve acudir imediatamente ao médico, se após a injeção de butilescopolamina bromuro aparece dor e vermelhidão de um olho com perda de visão. Isso pode ser um sinal de pressão elevada no interior do olho devido a um glaucoma de ângulo estreito até agora não diagnosticado e, portanto, não tratado.
Foram observadas reações alérgicas após a injeção de butilescopolamina bromuro (ver secção 4). Portanto, será vigiado após a injeção de butilescopolamina bromuro e tratado adequadamente em caso de que se produzam essas reações.
Outros medicamentos e Butilescopolamina Kalceks
Informa o seu médico ou farmacêutico se está tomando, tomou recentemente ou pode ter que tomar qualquer outro medicamento, mesmo os adquiridos sem receita médica, incluídas as plantas medicinais.
Especialmente informa o seu médico ou farmacêutico se está tomando algum dos seguintes:
- medicamentos para tratar a depressão chamados antidepressivos tricíclicos ou antidepressivos tetracíclicos
- medicamentos para tratar as alergias (antihistamínicos)
- medicamentos para tratar doenças mentais
- medicamentos para tratar a insuficiência cardíaca ou o asma (betamiméticos)
- medicamentos para tratar as alterações do ritmo cardíaco (quinidina ou disopiramida)
- amantadina (medicamento para o tratamento da doença de Parkinson)
- medicamentos para tratar os distúrbios respiratórios (como o tiotrópio, o ipratrópio e os semelhantes à atropina)
- metoclopramida (utilizados para tratar as náuseas, os vómitos ou os distúrbios gastrointestinais).
Em caso de não estar seguro se alguma das situações anteriores é aplicável a si, fale com o seu médico ou farmacêutico antes de que lhe administrem este medicamento.
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de que lhe administrem este medicamento.
Gravidez
Os dados disponíveis relativos ao uso do produto em mulheres grávidas ou em período de lactação são limitados. Em consequência, por razões de segurança, não se recomenda o uso deste medicamento durante a gravidez.
Durante a gravidez, o medicamento só pode ser utilizado sob o conselho de um médico que avaliará a relação risco/benefício.
Lactação
Durante a lactação, o medicamento só pode ser utilizado sob o conselho de um médico que avaliará a relação risco/benefício.
Condução e uso de máquinas
Algumas pessoas podem experimentar alterações da visão e tontura após serem tratadas com este medicamento. Se experimenta esses efeitos, não conduza nem utilize máquinas até que a visão se normalize ou deixe de se sentir tonto.
Butilescopolamina Kalceks contém sódio
Este medicamento contém menos de 23 mg de sódio (1 mmol); isto é, essencialmente “isento de sódio”.
3. Como se lhe administra Butilescopolamina Kalceks
Butilescopolamina Kalceks lhe será administrado por um médico ou enfermeiro como injeção lenta em uma veia, em um músculo ou debaixo da pele. A dose será determinada pelo médico.
Este medicamento não deve ser administrado de forma contínua a diário ou durante períodos de tempo prolongados sem investigar a causa da dor abdominal.
Adultos e crianças maiores de 12anos
A dose é de 20 a 40 mg (1-2 ampolas) administradas várias vezes ao dia. A dose máxima diária é de 100 mg (5 ampolas).
Uso em crianças
Em casos graves em lactentes e crianças, a dose é 0,3 a 0,6 mg/kg de peso corporal, administrados várias vezes ao dia. A dose máxima diária não deve ultrapassar 1,5 mg/kg de peso corporal.
Se lhe foi administrada uma quantidade excessiva deButilescopolamina Kalceks
Se acredita que lhe deram uma quantidade excessiva informe de imediato o seu médico ou enfermeiro. Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico, ou acuda a um centro médico, ou ligue para o Serviço de Informação Toxicológica, Tel. 91 562 04 20 indicando o medicamento e a quantidade ingerida.
Poderiam produzir-se os seguintes sintomas: secura da boca, vermelhidão cutânea, dificuldade para urinar, batimentos cardíacos rápidos e distúrbios da visão.
Se esqueceu uma dose de Butilescopolamina Kalceks
Não receberá uma dose dupla para compensar a dose esquecida. Só receberá a próxima dose se for necessário de acordo com o seu estado de saúde.
Se se interrompe o uso de Butilescopolamina Kalceks
Seu médico lhe administrará uma injeção apenas nos casos agudos. Se for necessário continuar com o tratamento, seu médico lhe mudará para butilescopolamina bromuro em comprimidos.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Muitas das reações adversas podem ser associadas às propriedades anticolinérgicas de butilescopolamina bromuro, que por lo geral são leves e transitórias.
As reações adversas foram tabuladas utilizando a seguinte convenção de frequências:
Muito frequentes podem afetar mais de 1 de cada 10 pessoas
Frequentes podem afetar até 1 de cada 10 pessoas
Pouco frequentes podem afetar até 1 de cada 100 pessoas
Raros podem afetar até 1 de cada 1 000 pessoas
Muito raros podem afetar até 1 de cada 10 000 pessoas
Frequência não conhecida não pode ser estimada a partir dos dados disponíveis
Distúrbios do sistema imunológico
Frequência não conhecida: choque anafiláctico (reação alérgica grave e repentina, que se manifesta com dificuldade para respirar, insuficiência da circulação sanguínea e inchaço, e que pode chegar a ser mortal), reações anafilácticas, dificuldade para respirar, reações cutâneas (por exemplo, urticária, sarpullido, vermelhidão da pele, picor), outras reações de hipersensibilidade.
Distúrbios psiquiátricos
Frequência não conhecida:confusão mental em pessoas de idade avançada, excitabilidade, irritabilidade.
Distúrbios oculares
Frequentes:distúrbios da acomodação (foco) visual.
Frequência não conhecida: dilatação da pupila, aumento da pressão dentro do olho, redução da secreção lagrimal.
Distúrbios cardíacos
Frequentes:aumento da frequência cardíaca.
Frequência não conhecida:palpitações.
Distúrbios vasculares
Frequentes:tontura.
Frequência não conhecida: diminuição da pressão arterial, rubor.
Distúrbios respiratórios
Frequência não conhecida:espessamento das secreções bronquiais.
Distúrbios gastrointestinais
Frequentes:secura da boca.
Frequência não conhecida:constipação.
Distúrbios da pele e do tecido subcutâneo
Frequência não conhecida: sudorese anormal.
Distúrbios renais e urinários
Frequência não conhecida: dificuldade para urinar.
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Butilescopolamina Kalceks
Mantenha este medicamento fora da vista e do alcance das crianças.
Este medicamento não requer condições especiais de conservação.
Não utilize este medicamento após a data de validade que aparece na caixa e na ampola após CAD. A data de validade é o último dia do mês que se indica.
Período de validade uma vez aberta a ampola: A administração do medicamento deve ter lugar imediatamente.
Período de validade após a diluição: A estabilidade química e física em uso foi demonstrada durante 24 horas a 25°C e 2-8°C.
Desde o ponto de vista microbiológico, o produto deve ser utilizado de imediato, salvo que o método de abertura/diluição posterior evite o risco de contaminação microbiana. Se não for utilizado imediatamente, os tempos e as condições de conservação em uso são responsabilidade do utilizador.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Butilescopolamina Kalceks
- O princípio ativo é butilescopolamina bromuro.
Cada ampola (1 ml) contém 20 mg de butilescopolamina bromuro.
- Os outros componentes são cloreto de sódio, ácido clorídrico concentrado (para ajuste de pH), hidróxido sódio (para ajuste de pH), água para preparações injetáveis.
Aspecto de Butilescopolamina Kalceks e conteúdo do envase
Solução injetável (injetável).
Solução transparente, incolor ou quase incolor, sem partículas visíveis.
Ampolas de vidro de tipo I transparentes de 1 ml.
As ampolas são colocadas em uma bandeja de PVC. As bandejas são envasadas em caixas de cartão.
Tamanhos dos envases: 5 ou 10 ampolas
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Titular da autorização de comercialização
AS KALCEKS
Krustpils iela 71E, Riga, LV-1057,
Letônia
Tel.: +371 67083320
E-mail: [email protected]
Responsável pela fabricação
Akciju sabiedriba “Kalceks”
Krustpils iela 71E, Riga, LV-1057, Letônia
Pode solicitar mais informação sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização
EVER Pharma Therapeutics Spain SL
c/ Toledo 170
28005 Madrid
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
República Checa Butylskopolaminium bromid Kalceks
Áustria Butylscopolaminiumbromid Kalceks 20 mg/ml Injektionslösung
Bélgica Scopolamine butylbromide Kalceks 20 mg/ml solution injectable
Scopolamine butylbromide Kalceks 20 mg/ml oplossing voor injectie
Scopolamine butylbromide Kalceks 20 mg/ml Injektionslösung
Bulgária Scopolamine butylbromide Kalceks 20 ??/?? ??????????? ???????
França SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
Itália Scopolamina butilbromuro Kalceks
Letônia Hyoscine butylbromide Kalceks 20 mg/ml šķidums injekcijām
Polônia Scopolamine butylbromide Kalceks
Portugal Butilescopolamina Kalceks
Noruega Skopolaminbutylbromid Kalceks
Eslováquia Scopolamine butylbromide Kalceks 20 mg/ml injekčný roztok
Espanha Butilescopolamina Kalceks 20 mg/ml solução injetável EFG
Suécia Hyoscine butylbromide Kalceks
Países Baixos Scopolamine butylbromide Kalceks 20 mg/ml oplossing voor injectie
Data da última revisão deste prospecto:Outubro 2022.
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/).
---------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário:
Forma de administração
Injeção intravenosa, intramuscular ou subcutânea.
Instruções de uso, eliminação e outras manipulações
Para um único uso. Uma vez aberta, a solução não utilizada deve ser descartada.
O medicamento deve ser inspecionado visualmente antes de seu uso. Só deve ser utilizado se a solução for transparente e sem partículas.
Pode ser utilizado diluído com dextrose ou com uma solução injetável de cloreto de sódio a 0,9%.
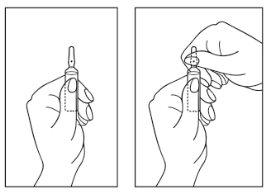
Instruções para a abertura da ampola:
- Gire a ampola com o ponto de cor para cima. Se sobrar algo de solução na parte superior da ampola, bata suavemente com o dedo para que toda a solução desça para a parte inferior da mesma.
- Use ambas as mãos para abrir; enquanto segura a parte inferior da ampola com uma mão, separe com a outra a parte superior da ampola na direção oposta ao ponto de cor (ver as imagens a seguir).
A eliminação do medicamento não utilizado e de todos os materiais que estiveram em contato com ele, será realizada de acordo com a normativa local.

Quanto custa o BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL em Espanha em 2025?
O preço médio do BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL em dezembro de 2025 é de cerca de 4.06 EUR. Os valores podem variar consoante a região, a farmácia e a necessidade de receita. Confirme sempre com uma farmácia local ou fonte online para obter informações atualizadas.
- País de registo
- Preço médio em farmácia4.06 EUR
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVELForma farmacêutica: COMPRIMIDO, 10 mg butilbrometo de escopolaminaSubstância ativa: butylscopolamineFabricante: Opella Healthcare Spain S.L.Não requer receita médicaForma farmacêutica: INJETÁVEL, 20 mg brometo de butilescopolamina/mlSubstância ativa: butylscopolamineFabricante: Opella Healthcare Spain S.L.Requer receita médicaForma farmacêutica: COMPRIMIDO, 10 mgSubstância ativa: butylscopolamineFabricante: Aurovitas Spain, S.A.U.Requer receita médica
Alternativas a BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL em Polónia
Alternativa a BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de BUTILISCOPOLAMINA KALCEKS 20 mg/ml SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.














