
Ticagrelor Holsten

Pergunte a um médico sobre a prescrição de Ticagrelor Holsten

Como usar Ticagrelor Holsten
CARACTERÍSTICAS DO PRODUTO MEDICAMENTOSO
1. NOME DO PRODUTO MEDICAMENTOSO
Ticagrelor Holsten, 60 mg, comprimidos revestidos
2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido revestido contém 60 mg de ticagrelor.
Para uma lista completa de excipientes, ver seção 6.1.
3. FORMA FARMACÊUTICA
Comprimido revestido.
Comprimidos redondos (8,1 x 8,1 mm), convexos de ambos os lados, rosados, com a inscrição "60" de um lado e liso do outro.
4. DADOS CLÍNICOS
4.1 Indicações terapêuticas
O medicamento Ticagrelor Holsten, em combinação com ácido acetilsalicílico (AAS), é indicado para prevenir eventos cardiovasculares em pacientes adultos:
- com síndrome coronária aguda (SCA) ou
- com infarto do miocárdio (IM) na história e alto risco de eventos cardiovasculares (ver seções 4.2 e 5.1).
4.2 Posologia e modo de administração
Posologia
Pacientes que tomam o medicamento Ticagrelor Holsten devem tomar diariamente uma dose de manutenção de AAS de 75-150 mg, a menos que seja contraindicado individualmente.
Síndrome coronária aguda
O tratamento com o medicamento Ticagrelor Holsten deve ser iniciado com uma dose de carga única de 180 mg (2 comprimidos de 90 mg) e continuar com uma dose de 90 mg duas vezes ao dia.
Em pacientes com SCA, a duração do tratamento com o medicamento Ticagrelor Holsten 90 mg duas vezes ao dia deve ser de 12 meses, a menos que haja indicações clínicas para interromper o tratamento (ver seção 5.1).
A interrupção do AAS pode ser considerada após 3 meses em pacientes com SCA que foram submetidos a uma intervenção coronária percutânea (PCI) e que têm um alto risco de sangramento. Nesse caso, a administração de ticagrelor como único agente antiplaquetário deve ser continuada por 9 meses (ver seção 4.4).
Infarto do miocárdio na história
A dose recomendada do medicamento Ticagrelor Holsten é de 60 mg duas vezes ao dia, se necessário, para o tratamento prolongado de pacientes com IM na história, que ocorreu há pelo menos 1 ano, e que têm um alto risco de eventos cardiovasculares (ver seção 5.1). O tratamento pode ser iniciado sem interrupção como uma continuação do tratamento inicial de 1 ano com o medicamento Ticagrelor Holsten 90 mg ou outro inibidor do receptor de ADP em pacientes com SCA e alto risco de eventos cardiovasculares. O tratamento também pode ser iniciado até 2 anos após o IM ou dentro de 1 ano após a interrupção do tratamento com um inibidor anterior do receptor de ADP. Os dados sobre a eficácia e segurança do uso de ticagrelor além de 3 anos de tratamento prolongado são limitados.
Se uma mudança de medicamento for necessária, a primeira dose do medicamento Ticagrelor Holsten deve ser administrada 24 horas após a última dose do outro agente antiplaquetário.
Omissão de dose
Também deve ser evitado o erro de dosagem. Se uma dose do medicamento Ticagrelor Holsten for omitida, o paciente deve tomar apenas um comprimido (a próxima dose) de acordo com o esquema de dosagem adotado.
Grupos especiais de pacientes
Pacientes idosos
Em pacientes idosos, não é necessário ajustar a dose (ver seção 5.2).
Disfunção renal
Não é necessário ajustar a dose em pacientes com disfunção renal (ver seção 5.2).
Disfunção hepática
Não foram realizados estudos sobre o uso de ticagrelor em pacientes com disfunção hepática grave e, portanto, seu uso é contraindicado nesses pacientes (ver seção 4.3). Existem apenas informações limitadas sobre o uso do medicamento em pacientes com disfunção hepática moderada. Portanto, é recomendável ter cautela nesses pacientes (ver seções 4.2 e 5.2).
Crianças e adolescentes
A segurança e eficácia do uso de ticagrelor em crianças com menos de 18 anos não foram estabelecidas.
Modo de administração
Administração oral.
O medicamento Ticagrelor Holsten pode ser tomado com ou sem alimentos.
Em pacientes que têm dificuldade em engolir o comprimido/inteiro, os comprimidos podem ser esmagados em um pó fininho, misturados com metade de um copo de água e tomados imediatamente. O copo deve ser então enxaguado com água (outros meios de 1/2 copo de água) e o conteúdo tomado novamente.
A mistura de comprimido esmagado com água também pode ser administrada por uma sonda nasogástrica (CH8 ou maior). É importante enxaguar a sonda nasogástrica com água (meio copo: mínimo de 50 ml a máximo de 125 ml) após a administração da mistura.
4.3 Contraindicações
- Hipersensibilidade à substância ativa ou a qualquer um dos excipientes listados na seção 6.1 (ver seção 4.8).
- 6.1 (ver seção 4.8).
- Sangramento patológico ativo.
- Hemorragia cerebral na história (ver seção 4.8).
- Disfunção hepática grave (ver seções 4.2, 4.4 e 5.2).
- Uso concomitante de ticagrelor e inibidores fortes da enzima CYP3A4 (por exemplo, cetoconazol, claritromicina, nefazodona, ritonavir e atazanavir), pois pode levar a um aumento significativo da exposição ao ticagrelor (ver seção 4.5).
4.4 Advertências e precauções especiais de uso
Risco de sangramento
Em pacientes com risco aumentado de sangramento, deve-se considerar a relação risco-benefício da prevenção de eventos cardiovasculares (ver seções 4.8 e 5.1). Em caso de indicações clínicas para o uso de ticagrelor, deve-se ter cautela em pacientes com:
- Pacientes com tendência a sangrar (por exemplo, devido a lesões recentes, cirurgias, distúrbios de coagulação, sangramentos ativos ou recentes no trato gastrointestinal) ou com risco aumentado de lesão. O uso de ticagrelor é contraindicado em pacientes com sangramento patológico ativo, hemorragia cerebral na história e disfunção hepática grave (ver seção 4.3).
- Pacientes que tomam concomitantemente medicamentos que podem aumentar o risco de sangramento (por exemplo, anti-inflamatórios não esteroides (AINE), anticoagulantes orais e/ou fibrinolíticos) administrados dentro de 24 horas antes da dose de ticagrelor.
Em dois estudos randomizados controlados (TICO e TWILIGHT) com pacientes com SCA que foram submetidos a uma intervenção coronária percutânea (PCI) com stent liberador de fármaco, foi demonstrado que a interrupção do AAS após 3 meses de terapia antiplaquetária dupla com ticagrelor e AAS, seguida da continuação do tratamento com ticagrelor como único agente antiplaquetário por 9 e 12 meses, reduziu o risco de sangramento e não aumentou o risco observado de eventos cardiovasculares graves (MACE) em comparação com a continuação da terapia antiplaquetária dupla (ver seção 4.2). A decisão de interromper o AAS após 3 meses e continuar o tratamento com ticagrelor como único agente antiplaquetário por 9 meses em pacientes com risco aumentado de sangramento deve ser tomada com base na avaliação clínica, considerando o risco de sangramento em relação ao risco de eventos trombóticos (ver seção 4.2).
A transfusão de plaquetas não reverteu o efeito antiplaquetário do ticagrelor em voluntários saudáveis e é improvável que seja clinicamente benéfica em pacientes com sangramentos.
Como a administração de desmopressina com ticagrelor não reduz o tempo de sangramento padrão, é duvidoso que seja eficaz no tratamento de incidentes clínicos de sangramento (ver seção 4.5).
O tratamento antifibrinolítico (ácido aminocapróico ou ácido tranexâmico) e/ou o tratamento com fator VIIa recombinante podem aumentar a hemostase. O ticagrelor pode ser readministrado se a causa do sangramento for identificada e controlada.
Cirurgias
Os pacientes devem ser instruídos a informar seus médicos e dentistas sobre o uso de ticagrelor antes de qualquer cirurgia planejada ou administração de novos medicamentos.
Em pacientes que participaram do estudo PLATO e foram submetidos a uma ponte de coronária (CABG), mais sangramentos ocorreram no grupo tratado com ticagrelor do que no grupo tratado com clopidogrel, se o medicamento foi interrompido 1 dia antes da cirurgia, mas se o medicamento foi interrompido 2 ou mais dias antes da cirurgia, o número de sangramentos graves foi semelhante nos dois grupos (ver seção 4.8). Se o paciente precisar ser submetido a uma cirurgia planejada e o efeito antiplaquetário não for desejado, o ticagrelor deve ser interrompido 5 dias antes da cirurgia (ver seção 5.1).
Pacientes pós-ACV isquêmico
Pacientes com SCA pós-ACV isquêmico podem ser tratados com ticagrelor por até 12 meses (estudo PLATO).
No estudo PEGASUS, não foram incluídos pacientes com IM na história e ACV isquêmico na história. Portanto, devido à falta de dados, não se recomenda o tratamento desses pacientes por mais de 1 ano.
Disfunção hepática
O uso de ticagrelor em pacientes com disfunção hepática grave é contraindicado (ver seções 4.2 e 4.3). Existem apenas experiências limitadas com o uso de ticagrelor em pacientes com disfunção hepática moderada, portanto, é recomendável ter cautela nesses pacientes (ver seções 4.2 e 5.2).
Pacientes com risco de eventos de bradicardia
A monitorização de parâmetros de ECG em estudo Holter mostrou uma frequência aumentada de pausas ventriculares, principalmente assintomáticas, durante o tratamento com ticagrelor em comparação com clopidogrel. Pacientes com risco aumentado de eventos de bradicardia (por exemplo, pacientes sem marca-passo com síndrome do nó sinusal, bloqueio atrioventricular de 2º ou 3º grau, ou com sincope relacionada à bradicardia) foram excluídos dos principais estudos de segurança e eficácia do ticagrelor. Portanto, devido à experiência clínica limitada, o ticagrelor deve ser usado com cautela nesse grupo de pacientes (ver seção 5.1).
Além disso, é recomendável ter cautela ao usar ticagrelor concomitantemente com medicamentos que causem bradicardia. No entanto, não houve evidências de efeitos colaterais clinicamente significativos no estudo PLATO após a administração concomitante com um ou mais medicamentos que causem bradicardia (por exemplo, 96% de beta-bloqueadores, 33% de antagonistas de cálcio diltiazem e verapamil e 4% de digoxina) (ver seção 4.5).
No estudo PLATO, em uma subpopulação submetida a estudo Holter, em pacientes que tomaram ticagrelor, pausas ventriculares >3 segundos foram observadas com mais frequência do que em pacientes que tomaram clopidogrel, na fase aguda da SCA. O aumento da frequência de pausas ventriculares detectadas pelo estudo Holter durante o tratamento com ticagrelor foi mais pronunciado em pacientes com insuficiência cardíaca crônica do que na população geral na fase aguda da SCA, mas não na observação de 1 mês de tratamento com ticagrelor, nem em comparação com clopidogrel.
Não foram observadas consequências clínicas adversas associadas a essa discrepância (incluindo sincope ou implantação de marca-passo) nesse grupo de pacientes (ver seção 5.1).
Após a comercialização do medicamento, foram relatados casos de bradicardia e bloqueio AV (ver seção 4.8), principalmente em pacientes com SCA, onde a isquemia do miocárdio e os medicamentos concomitantes que reduzem a frequência cardíaca ou afetam a condução cardíaca são fatores potenciais de confusão. Antes de ajustar o tratamento, é necessário avaliar o estado clínico do paciente e os medicamentos concomitantes como causas potenciais.
Dispneia
Pacientes tratados com ticagrelor relataram dispneia. A dispneia é geralmente leve a moderada e frequentemente resolve sem a necessidade de interrupção do medicamento. Em pacientes com asma/DOCP, pode haver um aumento do risco de dispneia durante o tratamento com ticagrelor. O ticagrelor deve ser usado com cautela em pacientes com asma e/ou DOCP na história. O mecanismo da dispneia não foi elucidado. Se o paciente relatar novos episódios de dispneia, aumento da duração ou piora dos sintomas de dispneia durante o tratamento com ticagrelor, uma avaliação diagnóstica completa deve ser realizada e, se o paciente não tolerar bem esse estado, o tratamento com ticagrelor deve ser interrompido. Mais informações estão disponíveis na seção 4.8.
Apnéia central do sono
Após a comercialização do medicamento, foram relatados casos de apnéia central do sono, incluindo respiração de Cheyne-Stokes. Se houver suspeita de apnéia central do sono, uma avaliação clínica adicional deve ser considerada.
Aumento da creatinina
Durante o tratamento com ticagrelor, pode haver um aumento da creatinina. O mecanismo desse efeito não foi estabelecido.
Devem ser realizados exames de controle da função renal de acordo com a prática clínica. Em pacientes com SCA, é recomendável controlar a função renal também após 1 mês de tratamento com ticagrelor, com atenção especial para pacientes com 75 anos ou mais, pacientes com disfunção renal moderada a grave e aqueles que tomam antagonistas do receptor de angiotensina (ARB).
Aumento da uricemia
Durante o tratamento com ticagrelor, pode ocorrer hiperuricemia (ver seção 4.8). É recomendável ter cautela em pacientes com hiperuricemia ou gota na história.
Como medida de precaução, não se recomenda o uso de ticagrelor em pacientes com nefropatia por urato.
Púrpura trombocitopênica trombótica (TTP)
Durante o tratamento com ticagrelor, foram relatados casos muito raros de TTP.
Caracteriza-se por trombocitopenia e hemólise microangiopática com sintomas neurológicos, disfunção renal ou febre. A TTP é uma doença potencialmente fatal que requer tratamento rápido, incluindo plasmaférese.
Alterações nos testes de função plaquetária para diagnosticar trombocitopenia induzida por heparina (TIH)
No teste funcional de ativação plaquetária induzida por heparina (HIPA) usado para diagnosticar TIH, os anticorpos contra o complexo fator plaquetário 4/heparina no soro do paciente ativam plaquetas de doadores saudáveis na presença de heparina.
Em pacientes que tomam ticagrelor, foram relatados resultados falsos negativos nos testes funcionais de plaquetas (incluindo o teste HIPA) usados para diagnosticar TIH. Isso está relacionado à inibição do receptor P2Y12 em plaquetas saudáveis do doador pelo ticagrelor presente no soro/ plasma do paciente. As informações sobre o tratamento concomitante com ticagrelor são necessárias para interpretar os resultados dos testes funcionais de plaquetas usados para diagnosticar TIH.
Em pacientes que desenvolveram TIH, deve-se avaliar a relação risco-benefício do tratamento contínuo com ticagrelor, considerando tanto o estado protrombótico da TIH quanto o risco aumentado de sangramento durante o tratamento concomitante com anticoagulante e ticagrelor.
Outros
Com base na relação observada no estudo PLATO entre a dose de manutenção de AAS e a eficácia relativa do ticagrelor em comparação com clopidogrel, não se recomenda o uso concomitante de ticagrelor e AAS em doses de manutenção altas (>300 mg) (ver seção 5.1).
Interrupção prematura do tratamento
A interrupção prematura de qualquer tratamento antiplaquetário, incluindo o medicamento Ticagrelor Holsten, pode resultar em um aumento do risco de morte por causas cardiovasculares, IM ou ACV devido à doença subjacente. Portanto, deve-se evitar a interrupção prematura do tratamento.
Sódio
O medicamento Ticagrelor Holsten contém menos de 1 mmol de sódio (23 mg) por dose, ou seja, é essencialmente "livre de sódio".
4.5 Interações com outros medicamentos e outras formas de interação
O ticagrelor é principalmente um substrato da enzima CYP3A4 e também um inibidor leve dessa enzima.
O ticagrelor também é um substrato da glicoproteína P (P-gp) e um inibidor fraco da P-gp e pode aumentar a exposição a substratos da P-gp.
Efeito de outros medicamentos no ticagrelor
Inibidores da CYP3A4
- Inibidores fortes da CYP3A4 - a administração concomitante de cetoconazol com ticagrelor resultou em um aumento de 2,4 vezes na C e 7,3 vezes na AUC do ticagrelor. A C e a AUC do metabolito ativo foram reduzidas em 89% e 56%, respectivamente. É provável que outros inibidores fortes da CYP3A4 (claritromicina, nefazodona, ritonavir e atazanavir) causem um efeito semelhante e, portanto, a administração concomitante de inibidores fortes da CYP3A4 com ticagrelor é contraindicada (ver seção 4.3).
- Inibidores moderados da CYP3A4 - a administração concomitante de diltiazem e ticagrelor resultou em um aumento de 69% na C do ticagrelor e 2,7 vezes na AUC, além de uma redução de 38% na C do metabolito ativo, sem afetar sua AUC. O ticagrelor não afetou a concentração de diltiazem no plasma. Outros inibidores moderados da CYP3A4 (por exemplo, amprenavir, aprepitante, eritromicina e fluconazol) podem causar um efeito semelhante e também podem ser administrados concomitantemente com ticagrelor.
- Foi observado um aumento de 2 vezes na exposição ao ticagrelor após a ingestão diária de grandes quantidades de suco de toranja (3 x 200 ml). Não se espera que esse aumento na exposição ao ticagrelor seja clinicamente significativo na maioria dos pacientes.
Indutores da CYP3A
A administração concomitante de rifampicina e ticagrelor reduziu a C e a AUC do ticagrelor em 73% e 86%, respectivamente. A C do metabolito ativo não foi alterada, e sua AUC foi reduzida em 46%. É provável que outros indutores da CYP3A (por exemplo, fenitoína, carbamazepina e fenobarbital) também reduzam a exposição ao ticagrelor.
A administração concomitante de ticagrelor e indutores fortes da CYP3A pode reduzir a concentração e a eficácia do ticagrelor, portanto, a administração concomitante deles com ticagrelor não é recomendada.
Ciclosporina (inibidor da P-gp e CYP3A)
A administração concomitante de ciclosporina (600 mg) e ticagrelor aumentou 2,3 vezes a C do ticagrelor e 2,8 vezes a AUC, além de aumentar a AUC do metabolito ativo em 32% e reduzir a C em 15%.
Não há dados sobre a administração concomitante de ticagrelor e outras substâncias ativas que sejam inibidores fortes da glicoproteína P (P-gp) e inibidores moderados da CYP3A4 (por exemplo, verapamil, quinidina), que podem aumentar a exposição ao ticagrelor. Se não for possível evitar o tratamento concomitante, sua administração concomitante requer cautela.
Outros
Estudos clínicos de interação demonstraram que a administração concomitante de ticagrelor com heparina, enoxaparina e AAS ou desmopressina não afetou a farmacocinética do ticagrelor ou seu metabolito ativo ou a agregação plaquetária induzida por ADP em comparação com a administração de ticagrelor isolado. Se clinicamente indicado, medicamentos que alteram a hemostase devem ser administrados com cautela em combinação com ticagrelor.
Em pacientes com SCA tratados com morfina, foi observado um atraso e uma redução na exposição ao inibidor oral da P2Y, incluindo ticagrelor e seu metabolito ativo (redução de 35% na exposição ao ticagrelor). Essa interação pode estar relacionada à redução da motilidade gastrointestinal e também se aplica a outros opioides. O significado clínico disso é desconhecido, mas os dados sugerem a possibilidade de redução da eficácia do ticagrelor em pacientes que recebem ticagrelor e morfina concomitantemente.
Em pacientes com SCA que não podem interromper a morfina e em quem a inibição rápida da P2Y é considerada criticamente importante, pode-se considerar o uso de um inibidor não oral da P2Y.
Efeito do ticagrelor sobre outros medicamentos
Medicamentos metabolizados pela CYP3A4
- Simvastatina - a administração concomitante de ticagrelor com simvastatina resultou em um aumento de 81% na C da simvastatina e 56% na AUC, além de um aumento de 64% na C do ácido simvastatínico e 52% na AUC. A administração concomitante de ticagrelor e simvastatina em doses maiores que 40 mg ao dia pode resultar em efeitos colaterais da simvastatina e, portanto, deve ser considerada na avaliação dos benefícios potenciais dessa combinação. Não foi observado efeito da simvastatina sobre a concentração de ticagrelor no plasma. O ticagrelor pode ter um efeito semelhante sobre o uso de lovastatina. Não se recomenda o uso concomitante de ticagrelor com simvastatina ou lovastatina em doses maiores que 40 mg.
- Atorvastatina - a administração concomitante de atorvastatina e ticagrelor resultou em um aumento de 23% na C e 36% na AUC do ácido atorvastatínico. Um aumento semelhante na AUC e C foi observado para todos os metabolitos do ácido atorvastatínico. Acredita-se que isso não seja clinicamente significativo.
- Não se pode excluir um efeito semelhante sobre outras estatinas metabolizadas pela CYP3A4. No entanto, no estudo PLATO, os pacientes receberam várias estatinas e, em 93% de todos os pacientes que participaram desse estudo, não houve preocupações de segurança relacionadas ao uso de estatinas.
O ticagrelor é um inibidor moderado da CYP3A4. Não se recomenda o uso concomitante de ticagrelor e substratos da CYP3A4 com uma janela terapêutica estreita (por exemplo, cisaprida e alcaloides do ergot), pois o ticagrelor pode aumentar a exposição a esses medicamentos.
Substratos da P-gp (incluindo digoxina, ciclosporina)
A administração concomitante de ticagrelor com digoxina aumentou a C e a AUC da digoxina em 75% e 28%, respectivamente. As concentrações mínimas da digoxina aumentaram em cerca de 30% após a administração concomitante com ticagrelor, com concentrações máximas individuais aumentando até 2 vezes. A presença da digoxina não afetou a C e a AUC do ticagrelor e seu metabolito ativo. Portanto, é recomendável monitorização clínica apropriada e/ou monitorização laboratorial durante o uso concomitante de medicamentos com uma janela terapêutica estreita, dependentes da P-gp, como a digoxina e o ticagrelor.
O ticagrelor não afetou a concentração de ciclosporina no sangue. Não foi estudado o efeito do ticagrelor sobre outros substratos da P-gp.
Medicamentos metabolizados pela CYP2C9
A administração concomitante de ticagrelor e tolbutamida não resultou em alterações na concentração no plasma de nenhum desses medicamentos, o que sugere que o ticagrelor não é um inibidor da CYP2C9 e é improvável que altere o metabolismo de medicamentos, como a varfarina ou a tolbutamida, por meio da CYP2C9.
Rosuvastatina
O ticagrelor pode afetar a excreção renal da rosuvastatina, aumentando o risco de acúmulo da rosuvastatina. Embora o mecanismo não seja conhecido, em alguns casos, a administração concomitante de ticagrelor e rosuvastatina resultou em deterioração da função renal, aumento da atividade da CPK (creatina fosfoquinase) e rabdomiólise.
Anticoncepcionais orais
A administração concomitante de ticagrelor e levonorgestrel e etinilestradiol resultou em um aumento de cerca de 20% na exposição ao etinilestradiol, mas não afetou a farmacocinética do levonorgestrel. Não se espera um efeito clinicamente significativo sobre a eficácia dos anticoncepcionais orais quando o levonorgestrel e o etinilestradiol são administrados concomitantemente com ticagrelor.
Medicamentos que causam bradicardia
Em relação às pausas ventriculares e bradicardia observadas, é recomendável ter cautela ao usar ticagrelor concomitantemente com medicamentos que causam bradicardia (ver seção 4.4). No entanto, no estudo PLATO, não foram observadas evidências de efeitos colaterais clinicamente significativos após a administração concomitante com um ou mais medicamentos que causam bradicardia (por exemplo, 96% de beta-bloqueadores, 33% de antagonistas de cálcio diltiazem e verapamil e 4% de digoxina).
Uso concomitante com outros medicamentos
No estudo clínico, o ticagrelor foi administrado concomitantemente com AAS, inibidores da bomba de prótons, estatinas, beta-bloqueadores, inibidores da enzima conversora de angiotensina (ECA) e antagonistas do receptor de angiotensina, usados por um longo período devido à necessidade de tratar doenças concomitantes, bem como com heparina, heparina de baixo peso molecular e inibidores intravenosos da glicoproteína IIb/IIIa por um curto período (ver seção 5.1). Não foram observadas interações clinicamente significativas com esses medicamentos.
A administração concomitante de ticagrelor e heparina, enoxaparina ou desmopressina não afetou o tempo de tromboplastina parcial ativada (aPTT), tempo de coagulação ativado (ACT) ou a determinação da atividade do fator Xa. No entanto, devido a possíveis interações farmacodinâmicas, é recomendável ter cautela ao usar ticagrelor concomitantemente com medicamentos que alteram a hemostase.
Em relação às sangramentos observados durante o uso de inibidores seletivos da recaptação de serotonina (ISRS) (por exemplo, paroxetina, sertralina e citalopram), é recomendável ter cautela ao usar ISRS com ticagrelor, pois isso pode aumentar o risco de sangramento.
4.6 Efeitos sobre a fertilidade, gravidez e amamentação
Mulheres em idade fértil
Mulheres em idade fértil devem usar métodos anticoncepcionais adequados para evitar a gravidez durante o tratamento com ticagrelor.
Gravidez
Não há ou é limitada a quantidade de dados sobre o uso de ticagrelor durante a gravidez. Estudos em animais mostraram efeitos prejudiciais na reprodução (ver seção 5.3). Não se recomenda o uso de ticagrelor durante a gravidez.
Amamentação
Dados farmacodinâmicos e toxicológicos de estudos em animais mostraram que o ticagrelor e seus metabolitos ativos são excretados no leite (ver seção 5.3). Não se pode excluir o risco para recém-nascidos/lactentes. Deve-se tomar a decisão de interromper a amamentação ou de terminar/interromper o tratamento com ticagrelor, considerando os benefícios da amamentação para a criança e os benefícios do tratamento para a mulher.
Fertilidade
Nos animais, o ticagrelor não afetou a fertilidade de machos ou fêmeas (ver seção 5.3).
4.7 Efeitos sobre a capacidade de dirigir e operar máquinas
O ticagrelor não tem ou tem um efeito insignificante sobre a capacidade de dirigir e operar máquinas. Foram relatados casos de tontura e confusão em pacientes tratados com ticagrelor. Portanto, os pacientes que experimentam esses sintomas devem ter cautela ao dirigir ou operar máquinas.
4.8 Efeitos colaterais
Resumo do perfil de segurança
O perfil de segurança do ticagrelor foi avaliado com base nos resultados de dois grandes estudos de fase 3 (PLATO e PEGASUS), que incluíram mais de 39.000 pacientes (ver seção 5.1).
No estudo PLATO, em pacientes que receberam ticagrelor, houve uma frequência maior de interrupção do tratamento devido a eventos adversos do que no grupo que recebeu clopidogrel (7,4% versus 5,4%).
No estudo PEGASUS, em pacientes que receberam ticagrelor, houve uma frequência maior de interrupção do tratamento devido a eventos adversos em comparação com pacientes tratados com AAS em monoterapia (16,1% no grupo tratado com ticagrelor 60 mg em combinação com AAS versus 8,5% no grupo que recebeu AAS em monoterapia). As reações adversas mais comuns relatadas em pacientes tratados com ticagrelor foram sangramento e dispneia (ver seção 4.4).
Tabela de reações adversas
As seguintes reações adversas foram identificadas com base em estudos ou relatadas após a comercialização do ticagrelor (Tabela 1).
Reações adversas listadas de acordo com a classificação de sistemas e órgãos (SOC) MedDRA. Dentro de cada grupo SOC, as reações adversas são classificadas por frequência de ocorrência.
A frequência é definida da seguinte forma: muito comum (≥1/10), comum (≥1/100 a <1>Tabela 1 – Reações adversas apresentadas por frequência de ocorrência e classificação de sistemas e órgãos (SOC)
4.9 Sobredosagem
O ticagrelor é bem tolerado após a administração de uma dose única de até 900 mg. Em estudos com doses únicas crescentes, os efeitos tóxicos no trato gastrointestinal foram dependentes da dose. Outros efeitos adversos clinicamente significativos que podem ocorrer após a sobredosagem incluem falta de ar e pausas ventriculares (ver ponto 4.8).
Em caso de sobredosagem, podem ocorrer os efeitos adversos potenciais mencionados acima e deve-se considerar a monitorização do eletrocardiograma (ECG).
Atualmente, não há um antídoto conhecido que reverta os efeitos do ticagrelor, e o ticagrelor não é removido durante a diálise (ver ponto 5.2). O tratamento da sobredosagem deve ser conduzido de acordo com a prática médica padrão local. O efeito esperado da sobredosagem de ticagrelor é o risco de sangramento prolongado, relacionado à inibição das plaquetas. É improvável que a transfusão de plaquetas seja clinicamente benéfica em pacientes com sangramentos (ver ponto 4.4). Se ocorrer sangramento, deve-se iniciar o tratamento de suporte apropriado.
5. Propriedades farmacológicas
5.1 Propriedades farmacodinâmicas
Grupo farmacoterapêutico: medicamentos que inibem a agregação plaquetária, excluindo a heparina, código ATC:
B01AC24
Mecanismo de ação
O Ticagrelor Holsten contém ticagrelor, que pertence ao grupo químico das ciclopentil-triazol-pirimidinas (CPTP).
O ticagrelor é um antagonista oral, direto, seletivo e reversível do receptor P2Y12, que impede a ativação e agregação plaquetária dependente do ADP relacionada ao receptor P2Y12.
O ticagrelor não impede a ligação do ADP, mas após a ligação ao receptor P2Y12, impede a transdução de sinal estimulada pelo ADP. Como as plaquetas participam da inicição e/ou progressão de complicações trombóticas da aterosclerose, demonstrou-se que a inibição da função plaquetária reduz o risco de eventos cardiovasculares, como morte, infarto do miocárdio ou acidente vascular cerebral.
O ticagrelor também aumenta as concentrações locais de adenozina endógena devido à inibição do transportador de nucleosídeos equilibrado 1 (ENT-1, do inglês equilibrative nucleoside transporter 1).
Verificou-se que o ticagrelor potencializa as ações dependentes de adenozina em voluntários saudáveis e pacientes com SCA: vasodilatação (medida como aumento do fluxo coronário em voluntários saudáveis e pacientes com SCA; cefaleia), inibição da agregação plaquetária (em sangue total humano in vitro) e falta de ar. No entanto, a relação entre o aumento observado da adenozina e os efeitos clínicos (por exemplo, morbidade-mortalidade) não foi claramente estabelecida.
Efeitos farmacodinâmicos
Início da ação
Em pacientes com doença coronária estável que estão tomando ácido acetilsalicílico, o ticagrelor demonstra um início rápido da ação farmacológica, com uma inibição média da agregação plaquetária (IPA) de cerca de 41% após 30 minutos da administração de uma dose de carga de 180 mg de ticagrelor, com efeito máximo de IPA de 89% após 2 a 4 horas da administração do medicamento, mantendo-se de 2 a 8 horas após a administração. Em 90% dos pacientes, o maior grau de inibição plaquetária, superior a 70%, é observado após 2 horas da administração do medicamento.
Fim da ação
Se for planeada uma cirurgia de CABG, o risco de sangramento associado ao uso de ticagrelor é maior em comparação com o clopidogrel após a interrupção do tratamento por menos de 96 horas antes da cirurgia.
Dados de mudança de terapia
A mudança de clopidogrel na dose de 75 mg para ticagrelor na dose de 90 mg duas vezes por dia resulta em um aumento de 26,4% na IPA em números absolutos, e a mudança de ticagrelor para clopidogrel resulta em uma diminuição de 24,5% na IPA em números absolutos. Os pacientes podem mudar de clopidogrel para ticagrelor sem perturbar a ação antiplaquetária (ver ponto 4.2).
Eficácia e segurança em estudos clínicos
Os dados clínicos que comprovam a eficácia e segurança do ticagrelor provêm de dois estudos de fase 3:
- do estudo PLATO [ Inibição da Plaquetas e Resultados dos Pacientes], no qual o ticagrelor foi comparado com o clopidogrel, com ambos os medicamentos administrados em combinação com AAS (ácido acetilsalicílico) e outros tratamentos padrão;
- do estudo PEGASUS TIMI-54 [ Prevenção com Ticagrelor de Eventos Trombóticos Secundários em Pacientes com Síndrome Coronária Aguda de Alto Risco], no qual o ticagrelor em combinação com AAS foi comparado com AAS em monoterapia.
Estudo PLATO (síndrome coronária aguda)
O estudo PLATO incluiu 18.624 pacientes com síndrome coronária aguda que se apresentaram dentro de 24 horas após o início dos sintomas de angina instável (UA), infarto do miocárdio sem elevação do segmento ST (NSTEMI) ou infarto do miocárdio com elevação do segmento ST (STEMI) e que foram tratados previamente com medicamentos, ou submetidos a uma intervenção coronária percutânea (PCI), ou submetidos a uma cirurgia de CABG.
Eficácia clínica
Em combinação com uma dose diária de AAS, o ticagrelor na dose de 90 mg duas vezes por dia demonstrou superioridade em relação ao clopidogrel na dose de 75 mg por dia na prevenção do ponto final composto de morte por causas cardiovasculares, infarto do miocárdio ou acidente vascular cerebral, com a diferença resultante principalmente da redução do número de mortes por causas cardiovasculares e infartos do miocárdio. Os pacientes receberam clopidogrel na dose de carga de 300 mg (em pacientes submetidos a uma intervenção coronária percutânea, a dose de carga de 600 mg era possível) ou ticagrelor na dose de carga de 180 mg.
Esse resultado foi alcançado precocemente (redução absoluta do risco [ARR] de 0,6% e redução relativa do risco [RRR] de 12% em 30 dias), e a eficácia do tratamento se manteve ao longo de todo o período de 12 meses, alcançando uma ARR de 1,9% em um ano e RRR de 16%. Esses resultados indicam que o período de tratamento adequado para os pacientes com ticagrelor na dose de 90 mg duas vezes por dia é de 12 meses (ver ponto 4.2).
O tratamento de 54 pacientes com SCA com ticagrelor em vez de clopidogrel evitou 1 evento cardiovascular; o tratamento de 91 pacientes evitou 1 morte por causas cardiovasculares (ver figura 1 e tabela 4).
Os melhores resultados do tratamento com ticagrelor em comparação com o clopidogrel são consistentemente observados em muitos subgrupos de pacientes, incluindo massa corporal, sexo, diabetes na história, ataques isquêmicos transitórios ou acidente vascular cerebral não relacionado a hemorragia ou revascularização; tratamento concomitante com heparina, inibidores da glicoproteína IIb/IIIa e inibidores da bomba de prótons (ver ponto 4.5); diagnóstico clínico final (STEMI, NSTEMI ou UA) e plano de tratamento pretendido no momento da randomização (tratamento invasivo ou conservador).
Com uma pequena significância, o efeito do tratamento diferiu dependendo da região, pelo que a razão de risco (HR) para o ponto final primário indica benefícios com o uso de ticagrelor em todo o mundo, com exceção da América do Norte, que representa cerca de 10% da população total do estudo, onde o resultado da HR é mais favorável ao clopidogrel (presença de interação p = 0,045).
Análises fatoriais sugerem a possibilidade de uma relação com a dose de AAS, o que significa que a eficácia do ticagrelor diminuiu com o aumento das doses de AAS. As doses de AAS para uso contínuo com ticagrelor devem ser de 75 a 150 mg (ver pontos 4.2 e 4.4).
A figura 1 mostra a estimativa de risco de ocorrência do primeiro evento do ponto final composto de morte por causas cardiovasculares, infarto do miocárdio ou acidente vascular cerebral.
Figura 1 – Análise do ponto final clínico composto de morte por causas cardiovasculares, infarto do miocárdio e acidente vascular cerebral (PLATO)
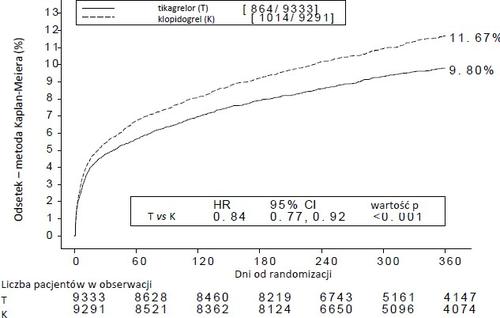
O ticagrelor reduziu a frequência do ponto final composto primário em comparação com o clopidogrel, em ambos os grupos de pacientes UA/NSTEMI e STEMI (tabela 4). Por essa razão, o medicamento Ticagrelor Holsten na dose de 90 mg duas vezes por dia, em combinação com AAS em dose baixa, pode ser usado em pacientes com SCA (angina instável, infarto do miocárdio sem elevação do segmento ST [NSTEMI] ou infarto do miocárdio com elevação do segmento ST [STEMI]), incluindo pacientes tratados medicamente e pacientes submetidos a uma intervenção coronária percutânea (PCI) ou cirurgia de CABG.
Tabela 4 - Análise dos pontos finais primários e secundários de eficácia (PLATO)
| Ticagrelor 90 mg duas vezes por dia (% de pacientes em que ocorreu o evento) N=9333 | Clopidogrel 75 mg por dia (% de pacientes em que ocorreu o evento) N=9291 | ARRa (%/ano) | RRRa (%) (IC 95%) | Valor de p |
| em que ocorreu o evento) N=9333 | em que ocorreu o evento) N=9291 | ||||
| Morte por causas cardiovasculares, IM (exceto IM silencioso) ou acidente vascular cerebral | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| Plano de tratamento invasivo | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| Plano de tratamento conservador | 11,3 | 13,2 | 2,3 | 15 (0,3, 27) | 0,0444 |
| Morte por causas cardiovasculares | 3,8 | 4,8 | 1,1 | 21 (9, 31) | 0,0013 |
| IM (exceto IM silencioso)b | 5,4 | 6,4 | 1,1 | 16 (5, 25) | 0,0045 |
| Acidente vascular cerebral | 1,3 | 1,1 |
|
| 0,2249 |
| Morte por qualquer causa, IM (exceto IM silencioso) ou acidente vascular cerebral | 9,7 | 11,5 | 2,1 | 16 (8, 23) | 0,0001 |
| Morte por causas cardiovasculares, IM total, acidente vascular cerebral, SRI, RI, TIA ou outros ATE | 13,8 | 15,7 | 2,1 | 12 (5, 19) | 0,0006 |
| Morte por qualquer causa | 4,3 | 5,4 | 1,4 | 22 (11, 31) | 0,0003 |
| Oclusão do stent | 1,2 | 1,7 | 0,6 | 32 (8, 49) | 0,0123 |
Análise genética subestudo no estudo PLATO
A genotipagem para CYP2C19 e ABCB1, realizada no estudo PLATO em 10.285 pacientes, permitiu determinar a relação entre os genótipos e os resultados do estudo PLATO.
A superioridade do ticagrelor em relação ao clopidogrel na redução do número de eventos cardiovasculares graves não foi significativamente dependente do genótipo CYP2C19 ou ABCB1. Semelhante ao estudo PLATO como um todo, o número total de sangramentos graves de acordo com a definição do PLATO não diferiu entre o grupo ticagrelor e o grupo clopidogrel, independentemente do genótipo CYP2C19 ou ABCB1. Sangramentos graves de acordo com a definição do PLATO, não relacionados à CABG, ocorreram com mais frequência no grupo ticagrelor em comparação com o clopidogrel em pacientes com perda de um ou mais alelos funcionais CYP2C19, mas semelhante ao grupo clopidogrel em pacientes sem perda de alelos funcionais.
Avaliação combinada de eficácia e segurança
A avaliação combinada de eficácia e segurança (morte por causas cardiovasculares, infarto do miocárdio, acidente vascular cerebral ou sangramento grave de acordo com a definição do PLATO) indica que os benefícios da eficácia do ticagrelor, em comparação com o clopidogrel, não são perdidos devido ao número de sangramentos graves (ARR 1,4%, RRR 8%, HR 0,92; p = 0,0257) ao longo de um período de 12 meses após a ocorrência da SCA.
Segurança clínica
Subgrupo com estudo de Holter
Com o objetivo de investigar a ocorrência de pausas ventriculares e outras arritmias durante o estudo PLATO, os investigadores monitoraram um subgrupo de cerca de 3000 pacientes com um monitor de Holter, dos quais cerca de 2000 tiveram gravações realizadas na fase aguda da SCA e após um mês. A variável observada foi a ocorrência de pausas ventriculares ≥ 3 segundos. Um número maior de pausas ventriculares foi observado no grupo ticagrelor (6,0%) do que no grupo clopidogrel (3,5%) na fase aguda da SCA; e após um mês – 2,2% e 1,6%, respectivamente (ver ponto 4.4). O aumento da frequência de pausas ventriculares na fase aguda da SCA foi observado com mais frequência em pacientes tratados com ticagrelor com insuficiência cardíaca congestiva na história (9,2% versus 5,4% de pacientes sem insuficiência cardíaca congestiva na história; no caso do clopidogrel, 4,0% de pacientes com insuficiência cardíaca congestiva na história e 3,6% de pacientes sem insuficiência cardíaca congestiva na história). Essa discrepância não ocorreu após 1 mês: 2% versus 2,1% nos pacientes que receberam ticagrelor, respectivamente, com ou sem insuficiência cardíaca congestiva na história; e 3,8% versus 1,4% nos pacientes que receberam clopidogrel. Não houve consequências clínicas adversas associadas a essas anormalidades (incluindo a necessidade de um marcapasso) nesse subgrupo de pacientes.
Estudo PEGASUS (infarto do miocárdio na história)
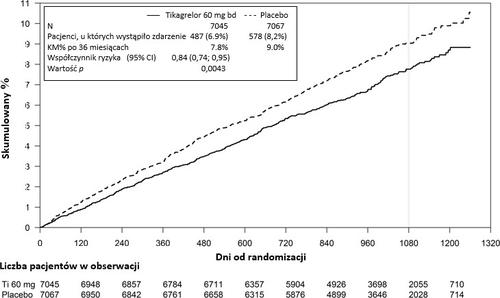
O estudo PEGASUS TIMI-54 foi um estudo randomizado, duplo-cego, controlado por placebo, multicêntrico, que avaliou a prevenção de eventos cardiovasculares com o uso de ticagrelor em 2 doses (90 mg ou 60 mg duas vezes por dia) em combinação com AAS em dose baixa (75-150 mg) em comparação com AAS em monoterapia em pacientes com infarto do miocárdio na história e com fatores de risco adicionais para eventos cardiovasculares.
Os pacientes foram elegíveis para participar do estudo se tivessem pelo menos 50 anos de idade, tivessem tido um infarto do miocárdio no passado (entre 1 e 3 anos antes da randomização) e tivessem pelo menos um dos seguintes fatores de risco para eventos trombóticos de origem aterosclerótica: idade ≥ 65 anos, diabetes que requer tratamento medicamentoso, segundo infarto do miocárdio, características de doença coronária multivascular ou insuficiência renal crônica não terminal.
Os pacientes não foram elegíveis para participar do estudo se estivessem planejando usar um antagonista do receptor P2Y12, dipiridamol, cilostazol ou tratamento anticoagulante durante o estudo; se tivessem uma condição hemorrágica ou tivessem tido um acidente vascular cerebral isquêmico ou hemorrágico, tumor cerebral ou malformação vascular cerebral na história; se tivessem tido um sangramento gastrointestinal nos 6 meses anteriores ou tivessem sido submetidos a uma cirurgia importante nos 30 dias anteriores.
Eficácia clínica
Figura 2 – Análise do ponto final clínico composto de morte por causas cardiovasculares, infarto do miocárdio e acidente vascular cerebral (PEGASUS)
5.2 Propriedades farmacocinéticas
O ticagrelor apresenta farmacocinética linear, e a exposição ao ticagrelor e ao seu metabolito ativo (AR-C124910XX) é aproximadamente dependente da dose, na faixa de até 1260 mg.
Absorção
A absorção do ticagrelor é rápida, com mediana do tempo de pico (tmax) de aproximadamente 1,5 hora. A formação do principal metabolito circulante AR-C124910XX (também ativo) a partir do ticagrelor é rápida, com mediana de tmax de aproximadamente 2,5 horas. Após a administração de uma dose única oral de 90 mg de ticagrelor em jejum a voluntários saudáveis, a concentração máxima (C) foi de 529 ng/ml e a área sob a curva (AUC) foi de 3451 ng*h/ml. Para o metabolito, os fatores de conversão para a substância original foram de 0,28 para C e 0,42 para AUC.
A farmacocinética do ticagrelor e do AR-C124910XX em pacientes com infarto do miocárdio na história foi basicamente semelhante à observada na população de pacientes com SCA. De acordo com a análise farmacocinética da população no estudo PEGASUS, a mediana da concentração de picos do ticagrelor foi de 391 ng/ml e a AUC foi de 3801 ng*h/ml no estado de equilíbrio após a administração de ticagrelor na dose de 60 mg. No caso da dose de 90 mg de ticagrelor, a concentração de picos foi de 627 ng/ml e a AUC foi de 6255 ng*h/ml no estado de equilíbrio.
A biodisponibilidade absoluta do ticagrelor foi estimada em 36%. O consumo de uma refeição rica em gordura resultou em um aumento de 21% na AUC do ticagrelor e uma diminuição de 22% na concentração de picos do metabolito ativo, mas não alterou a concentração de picos do ticagrelor e a AUC do metabolito ativo. Acredita-se que essas pequenas alterações tenham mínimo significado clínico, portanto, o ticagrelor pode ser administrado durante ou fora das refeições. Tanto o ticagrelor quanto o metabolito ativo são substratos da glicoproteína P (P-gp).
O ticagrelor em forma de tabletes esmagados misturados com água, administrados por via oral ou por sonda nasogástrica, tem biodisponibilidade comparável à da tablete administrada inteira em termos de AUC e C para o ticagrelor e o metabolito ativo. A exposição inicial (0,5 e 1 hora após a administração) do ticagrelor administrado em forma de tablete esmagado misturado com água foi maior do que a da tablete administrada inteira, com um perfil de concentrações basicamente idêntico em momentos posteriores (de 2 a 48 horas).
Distribuição
O volume de distribuição no estado de equilíbrio é de 87,5 l. O ticagrelor e o metabolito ativo se ligam fortemente às proteínas plasmáticas humanas (>99,0%).
Metabolismo
A CYP3A4 é o principal enzima responsável pelo metabolismo do ticagrelor e pela formação do metabolito ativo, e suas interações com outros substratos do izoenzima CYP3A incluem tanto ativação quanto inibição.
O principal metabolito do ticagrelor, AR-C124910XX, também é ativo, como determinado em estudos in vitro, nos quais se liga ao receptor plaquetário ADP P2Y.
A exposição sistêmica ao metabolito ativo representa aproximadamente 30-40% da exposição ao ticagrelor.
Eliminação
A principal via de eliminação do ticagrelor é o metabolismo hepático. Após a administração de ticagrelor marcado com radioatividade, a recuperação média da radioatividade foi de aproximadamente 84% (57,8% nas fezes e 26,5% na urina). O ticagrelor e o metabolito ativo recuperados na urina representaram menos de 1% da dose administrada em ambos os casos. A principal via de eliminação do metabolito ativo é provavelmente a excreção na bile. O período médio de meia-vida é de aproximadamente 7 horas para o ticagrelor e 8,5 horas para o metabolito ativo.
Grupos especiais de pacientes
Pacientes idosos
Em análises farmacocinéticas da população, em pacientes idosos (≥75 anos) com SCA, foi observada uma exposição maior ao ticagrelor (aproximadamente 25% para C e AUC) e ao metabolito ativo em comparação com pacientes mais jovens. Acredita-se que essas diferenças não sejam clinicamente significativas (ver seção 4.2).
Crianças e adolescentes
Existem dados limitados sobre crianças e adolescentes com anemia falciforme (ver seção 4.2 e 5.1).
No estudo HESTIA 3, pacientes com idades de 2 a menos de 18 anos, pesando de ≥12 a ≤24 kg, de >24 a ≤48 kg e >48 kg receberam ticagrelor na forma de tabletes de 15 mg que se desfazem na boca, nas doses de 15, 30 e 45 mg duas vezes ao dia, respectivamente. A análise farmacocinética da população mostrou que a AUC média variou de 1095 ng*h/ml a 1458 ng*h/ml, e a concentração de picos média foi de 143 ng/ml a 206 ng/ml no estado de equilíbrio.
Sexo
Em mulheres, foi observada uma exposição maior ao ticagrelor e ao metabolito ativo do que em homens. Acredita-se que essas diferenças não sejam clinicamente significativas.
Disfunção renal
Em pacientes com disfunção renal grave (clearance de creatinina <30 ml min), a exposição ao ticagrelor foi aproximadamente 20% menor, e metabolito ativo 17% maior do que em pacientes com função renal normal.
Em pacientes com doença renal terminal em diálise, os valores de AUC e C do ticagrelor na dose de 90 mg administrada no dia sem diálise foram 38% e 51% maiores do que em pacientes com função renal normal. Um aumento semelhante na exposição foi observado quando o ticagrelor foi administrado antes da diálise (respectivamente, 49% e 61%), o que sugere que o ticagrelor não é dializável. A exposição ao metabolito ativo aumentou em menor grau (AUC em 13-14% e C em 17-36%). A ação do ticagrelor na inibição da agregação plaquetária foi independente da diálise em pacientes com doença renal terminal e semelhante à de pacientes com função renal normal (ver seção 4.2).
Disfunção hepática
A C e a AUC do ticagrelor foram respectivamente 12% e 23% maiores em pacientes com disfunção hepática leve em comparação com indivíduos saudáveis correspondentes, mas a ação do ticagrelor na inibição da agregação plaquetária foi semelhante em ambos os grupos. Não há necessidade de ajuste de dose em pacientes com disfunção hepática moderada. Não foram realizados estudos sobre o uso do ticagrelor em pacientes com insuficiência hepática grave, e não há informações disponíveis sobre sua farmacocinética em pacientes com disfunção hepática moderada. Em pacientes com aumento inicial moderado ou grave dos resultados de testes hepáticos, a concentração de ticagrelor no soro foi média semelhante ou ligeiramente maior do que em pacientes sem aumento inicial desses parâmetros. Não é necessário ajuste de dose em pacientes com disfunção hepática moderada (ver seções 4.2 e 4.4).
Diferenças raciais
Em pacientes de origem asiática, é observada uma biodisponibilidade média 39% maior em comparação com pacientes de raça caucasiana. Em pacientes que se autodeclaram de raça negra, a biodisponibilidade do ticagrelor é 18% menor do que em pacientes de raça caucasiana. Em estudos de farmacologia clínica em japoneses, foi observada uma exposição maior ao ticagrelor (aproximadamente 40% - e 20% após ajuste para peso corporal) em comparação com indivíduos de raça caucasiana. A exposição em pacientes que se autodeclaram de raça latina foi semelhante à de pacientes de raça caucasiana.
5.3 Dados pré-clínicos de segurança
Os dados pré-clínicos provenientes de estudos farmacológicos convencionais do ticagrelor e seu principal metabolito, que abordam a segurança farmacoterapêutica, estudos de toxicidade após administração única e múltipla, e potencial genotóxico, não revelaram riscos inaceitáveis para a segurança humana.
Após exposição equivalente às condições clínicas em várias espécies de animais, foi observada irritação gastrointestinal (ver seção 4.8).
Em fêmeas de ratos que receberam ticagrelor em doses altas, foi observado um aumento no número de casos de tumores uterinos (adenocarcinomas) e um aumento no número de casos de adenomas hepáticos. O mecanismo de formação de tumores uterinos em ratos provavelmente envolve uma perturbação do equilíbrio hormonal, que pode levar à formação de tumores em ratos. O mecanismo de formação de adenomas hepáticos é provavelmente específico para roedores e envolve um aumento na atividade enzimática hepática. Portanto, acredita-se que esses casos de carcinogênese tenham pouca relevância para humanos.
Em ratos, foram observadas pequenas anomalias de desenvolvimento após a administração de doses tóxicas às fêmeas grávidas (margem de segurança de 5,1). Em fetos de coelhos, foi observado um pequeno atraso no amadurecimento hepático e no desenvolvimento do sistema esquelético quando as fêmeas grávidas receberam doses altas sem sinais de toxicidade nas fêmeas grávidas (margem de segurança de 4,5).
Estudos em ratos e coelhos mostraram efeitos tóxicos na reprodução, com um pequeno decréscimo no ganho de peso das fêmeas grávidas e uma diminuição na sobrevivência e peso ao nascer dos neonatos, bem como um crescimento retardado. O ticagrelor causou ciclos irregulares (na maioria das vezes prolongados) em fêmeas de ratos, mas não afetou a fertilidade total em machos e fêmeas de ratos. Estudos farmacocinéticos realizados com ticagrelor marcado com radioatividade mostraram que tanto a substância ativa quanto seus metabolitos são excretados no leite de ratos (ver seção 4.6).
6. DADOS FARMACÊUTICOS
6.1 Lista de excipientes
Núcleo do tablete
Hipromelose (E464)
Manitol (E421)
Celulose microcristalina (E460)
Carboximetilcelulose sódica
Estearato de magnésio (E470b)
Revestimento do tablete
Hipromelose (E464)
Dióxido de titânio (E171)
Macrogol 400 (E1521)
Talco (E553b)
Óxido de ferro vermelho (E172)
6.2 Incompatibilidades farmacêuticas
Não se aplica.
6.3 Prazo de validade
3 anos
6.4 Precauções especiais de armazenamento
Este medicamento não requer condições especiais de armazenamento em temperatura definida; armazenar no embalagem original para proteger da luz.
6.5 Tipo de embalagem e conteúdo
Blister transparente de PVC/PVDC/Alumínio e/ou blister transparente de PVC/PE/PVDC/Alumínio em caixa de cartão.
Blister de folha (com símbolos de sol/lua ou sem) em caixas de cartão com 14, 15, 20, 28, 30, 56, 60, 90, 98, 100, 168, 195, 196 e 200 comprimidos revestidos.
Nem todos os tamanhos de embalagem precisam estar disponíveis no mercado.
6.6 Precauções especiais para eliminação
Qualquer resíduo não utilizado do medicamento ou seus dejetos deve ser eliminado de acordo com as regulamentações locais.
7. TITULAR DA AUTORIZAÇÃO DE COMERCIALIZAÇÃO
AUTORIZAÇÃO DE COMERCIALIZAÇÃO
Holsten Pharma GmbH
Hahnstraße 31-35
60528 Frankfurt am Main
Alemanha
8. NÚMEROS DE AUTORIZAÇÃO DE COMERCIALIZAÇÃO
Número de autorização:
9. DATA DE CONCESSÃO DA PRIMEIRA AUTORIZAÇÃO DE COMERCIALIZAÇÃO
E DATA DE RENOVAÇÃO DA AUTORIZAÇÃO
Data de concessão da primeira autorização de comercialização:
10. DATA DE APROVAÇÃO OU REVISÃO DA BULA
DO MEDICAMENTO
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorGenepharm S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Ticagrelor HolstenForma farmacêutica: Comprimidos, 60 mgSubstância ativa: ticagrelorRequer receita médicaForma farmacêutica: Comprimidos, 90 mgSubstância ativa: ticagrelorRequer receita médicaForma farmacêutica: Comprimidos, 60 mgSubstância ativa: ticagrelorFabricante: Krka, d.d., Novo mestoRequer receita médica
Alternativas a Ticagrelor Holsten noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Ticagrelor Holsten em Hiszpania
Alternativa a Ticagrelor Holsten em Ukraina
Médicos online para Ticagrelor Holsten
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Ticagrelor Holsten – sujeita a avaliação médica e regras locais.














