
Pediaven G25

Pergunte a um médico sobre a prescrição de Pediaven G25

Como usar Pediaven G25
Folheto informativo para o utilizador
Pediaven G25, solução para infusão
produto composto
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
Deve conservar este folheto, para que possa relê-lo se necessário.
Em caso de dúvidas, deve consultar um médico ou enfermeiro.
Se o doente apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é Pediaven G25 e para que é usado
- 2. Informações importantes antes de usar Pediaven G25
- 3. Como usar Pediaven G25
- 4. Efeitos secundários possíveis
- 5. Como conservar Pediaven G25
- 6. Conteúdo da embalagem e outras informações
1. O que é Pediaven G25 e para que é usado
Pediaven G25 é uma mistura nutricional que contém uma solução de aminoácidos (componentes necessários para a produção de proteínas) e glicose (carboidratos) com sais (eletrólitos e oligoelementos) disponível em um saco de plástico com duas câmaras, cada uma com uma capacidade de 500 ml.
Este medicamento é uma solução destinada a ser administrada por via intravenosa (infusão intravenosa).
Pode ser usado em lactentes, crianças e jovens que não podem receber alimentação por via oral.
2. Informações importantes antes de usar Pediaven G25
Quando não usar Pediaven G25:
se o doente for alérgico a substâncias ativas ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6);
se o doente tiver distúrbios metabólicos congénitos de aminoácidos (se o organismo utilizar certos aminoácidos de forma inadequada);
se o doente tiver doença hepática ou renal grave sem possibilidade de diálise;
se o doente tiver hiperglicemia grave (nível alto de açúcar no sangue) e a situação for descontrolada;
se a concentração no sangue do doente (no soro) de um dos sais (eletrólitos) presentes neste medicamento for elevada;
se o doente estiver em estado geral instável, por exemplo, após lesão grave ou em caso de diabetes descontrolada, acidose metabólica (problema causado por uma grande quantidade de substâncias ácidas no sangue), infecção grave (choque séptico), choque agudo ou coma;
se o doente estiver em estado de desnutrição grave e houver risco de ocorrência de "síndrome de choque alimentar".
Outras situações gerais em que não usar Pediaven G25:
se o doente tiver líquido nos pulmões (edema pulmonar agudo);
se o doente tiver excesso de líquido no organismo (hiperhidratação);
se o doente tiver insuficiência cardíaca não tratada;
se o doente tiver quantidade insuficiente de líquido no organismo (desidratação hipotônica).
Não deve ser administrado Pediaven G25 se alguma das situações acima se aplicar ao doente.
Em caso de dúvidas, deve consultar um médico ou enfermeiro antes de administrar Pediaven G25 ao doente.
Precauções e advertências
Informações importantes antes de iniciar o tratamento com Pediaven G25:
Pediaven G25 deve ser usado com grande precaução quando for necessário restringir a ingestão de líquidos, por exemplo, em certas doenças cardíacas, pulmonares ou renais.
Deve informar o médico se, durante o tratamento, o doente apresentar algum efeito secundário, como arrepios, suor, febre, erupções cutâneas ou problemas respiratórios. A infusão deve ser interrompida.
Durante o uso em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração. A exposição de Pediaven G25 à luz, especialmente após a adição de oligoelementos e (ou) vitaminas, leva à formação de peróxidos e outros produtos de degradação, o que pode ser limitado protegendo da luz.
Nível elevado de magnésio no sangue
A quantidade de magnésio contida em Pediaven G25 pode causar um nível elevado de magnésio no sangue.
Isso pode se manifestar da seguinte forma: fraqueza, reflexos lentos, náuseas, vômitos, nível baixo de cálcio no sangue, problemas respiratórios, pressão arterial baixa e ritmo cardíaco irregular. Esses sintomas podem ser difíceis de detectar e, portanto, o médico pode monitorar os parâmetros sanguíneos do doente, especialmente se houver risco de nível elevado de magnésio no sangue, especialmente distúrbios renais. Se o nível de magnésio no sangue for elevado, a infusão será interrompida ou reduzida.
O médico monitorará o estado do doente durante todo o tratamento e pode alterar a dose administrada ou prescrever medicamentos adicionais, se necessário (principalmente vitaminas, gorduras ou eletrólitos).
Pediaven G25 e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o doente está tomando atualmente ou recentemente, incluindo medicamentos sem prescrição médica.
3. Como usar Pediaven G25
Dosagem
Pediaven G25 deve ser sempre usado de acordo com as recomendações do médico. O médico decidirá a dose e a duração do tratamento, com base na idade do doente, peso corporal, necessidades metabólicas e energéticas, estado clínico e capacidade de metabolizar a alimentação oral e enteral (fornecimento de nutrientes por meio de um tubo inserido no trato gastrointestinal).
Se a alimentação for feita exclusivamente por via intravenosa (administração na veia), o médico pode prescrever a administração de vitaminas e gorduras ao mesmo tempo. Se vitaminas forem adicionadas ao medicamento, o saco deve ser protegido da luz.
Via de administração
Pediaven G25 é administrado exclusivamente por pessoal médico e apenas por via intravenosa, na veia central (na grande veia).
Durante o uso em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver ponto 2).
Uso de dose maior do que a recomendada de Pediaven G25
Pediaven G25 deve ser sempre usado de acordo com as recomendações do médico. Em caso de dúvidas de que o doente tenha tomado uma dose maior do que a recomendada de Pediaven G25, deve informar o médico imediatamente.
Omissão da administração de Pediaven G25
Pediaven G25 deve ser sempre usado de acordo com as recomendações do médico. Deve informar o médico imediatamente se o doente não receber a infusão de Pediaven G25. Não deve ser administrada uma dose dupla para compensar a dose omitida e não deve exceder a velocidade de infusão recomendada.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar um médico.
4. Efeitos secundários possíveis
Como qualquer medicamento, Pediaven G25 pode causar efeitos secundários, embora não todos os doentes os apresentem.
Deve entrar em contato com o médico imediatamente, que interromperá a infusão, se o doente apresentar os seguintes sintomas:
sintomas incomuns ou sinais de reação alérgica, como suor, febre, arrepios, dor de cabeça, erupções cutâneas ou problemas respiratórios.
Podem ocorrer efeitos secundários relacionados à administração de nutrientes parenterais (alimentação por via intravenosa), especialmente no início do tratamento, que incluem:
aumento do nível de açúcar no sangue (hiperglicemia);
distúrbios gastrointestinais (náuseas, vômitos);
ingestão excessiva de aminoácidos pode causar acidose metabólica (distúrbio do equilíbrio de substâncias ácidas e básicas no organismo). Pode ocorrer hiperazotemia (quantidade excessiva de compostos azotados no sangue), especialmente se o doente tiver problemas renais, hepáticos ou respiratórios;
distúrbios temporários da função hepática;
reações alérgicas a certos aminoácidos.
Uso inadequado (sobredosagem ou infusão demasiado rápida) pode levar à ocorrência de sintomas de hiperglicemia e hiperolemia (aumento do volume de sangue nas veias).
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, incluindo qualquer efeito secundário não mencionado no folheto, deve informar o médico ou farmacêutico. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos, Produtos Médicos e Produtos Biocidas
Rua Jerónimo, 181C
02-222 Varsóvia
telefone: +48 22 49 21 301
fax: +48 22 49 21 309
e-mail: [email protected]
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar Pediaven G25
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não use este medicamento após a data de validade impressa na etiqueta após EXP. A data de validade é o último dia do mês indicado.
Conservar a uma temperatura abaixo de 25°C. Não congelar. Conservar no saco externo. Use imediatamente após a mistura do conteúdo das duas câmaras.
Durante o uso em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver ponto 2).
Prazo de validade do medicamento após mistura com substâncias adicionais
Após a mistura das duas câmaras, podem ser adicionados outros componentes através do porto de administração de substâncias adicionais. O medicamento deve ser usado imediatamente após a adição de outros componentes.
Não use este medicamento se a embalagem estiver danificada ou se houver sinais de deterioração.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Pediaven G25
As substâncias ativas do medicamento são:
| Substâncias ativas | Solução de aminoácidos 500 ml | Solução de glicose 500 ml | Solução após mistura, pronta para uso 1000 ml |
| alanina | 2,41 g | 2,41 g | |
| arginina | 1,57 g | 1,57 g | |
| ácido aspártico | 1,57 g | 1,57 g | |
| acetilcisteína (equivalente a cisteína) | 0,51 g (0,38 g) | 0,51 g (0,38 g) | |
| ácido glutâmico | 2,72 g | 2,72 g | |
| glicina | 0,80 g | 0,80 g | |
| histidina | 0,80 g | 0,80 g | |
| isoleucina | 1,19 g | 1,19 g | |
| leucina | 2,68 g | 2,68 g | |
| lisina monohidratada (equivalente a lisina anidra) | 2,4 g (2,14 g) | 2,4 g (2,14 g) | |
| metionina | 0,50 g | 0,50 g | |
| fenilalanina | 1,03 g | 1,03 g | |
| prolina | 2,14 g | 2,14 g | |
| serina | 1,45 g | 1,45 g | |
| taurina | 0,11 g | 0,11 g | |
| treonina | 1,38 g | 1,38 g | |
| tripotofano | 0,54 g | 0,54 g | |
| tirosina | 0,19 g | 0,19 g | |
| valina | 1,38 g | 1,38 g | |
| fosfato de potássio | 1,74 g | 1,74 g | |
| dióxido de selênio | 0,11 mg | 0,11 mg | |
| glicose monohidratada (equivalente a glicose anidra) | 275,0 g (250,0 g) | 275,0 g (250,0 g) | |
| gluconato de cálcio | 3,59 g | 3,59 g | |
| lactato de magnésio dihidratado | 1,43 g | 1,43 g | |
| cloreto de sódio | 2,34 g | 2,34 g | |
| cloreto de potássio | 1,49 g | 1,49 g | |
| acetato de zinco dihidratado | 13,43 mg | 13,43 mg | |
| sulfato de cobre pentahidratado | 2,00 mg | 2,00 mg | |
| fluoreto de sódio | 2,21 mg | 2,21 mg | |
| cloreto de manganês tetrahidratado | 0,72 mg | 0,72 mg | |
| iodeto de potássio | 0,13 mg | 0,13 mg | |
| cloreto de cromo hexahidratado | 0,21 mg | 0,21 mg |
| sulfato ferroso heptahidratado | 4,98 mg | 4,98 mg | |
| cloreto de cobalto hexahidratado | 1,21 mg | 1,21 mg | |
| molibdato de amônio tetrahidratado | 0,18 mg | 0,18 mg |
Os componentes não ativos (excipientes) são: ácido acético glacial (para ajustar o pH), ácido clorídrico (para ajustar o pH), água para injeção.
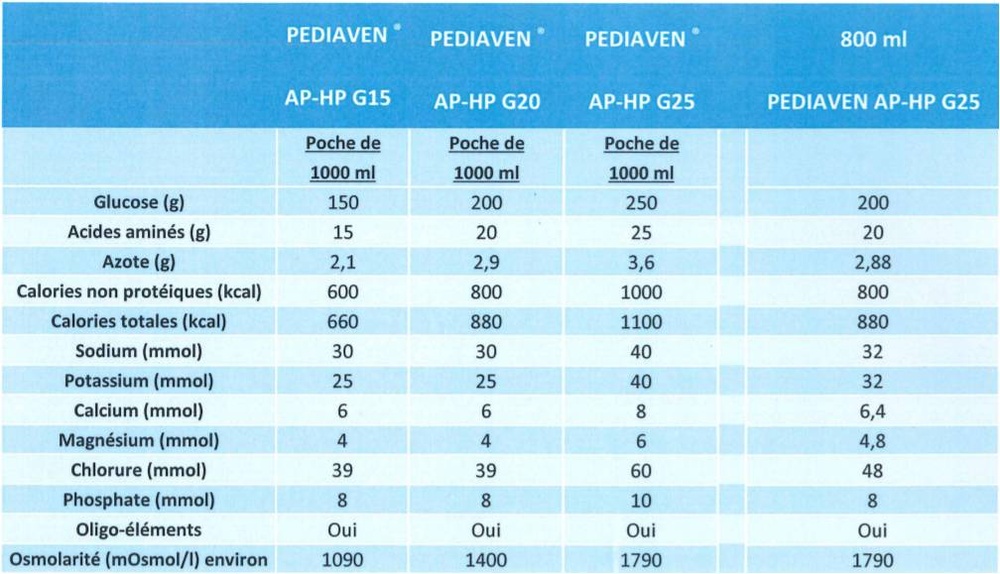
Osmolalidade da solução: 1790 mOsmol/l
pH da solução: 4,8 – 5,5
Valor nutricional em 1000 ml
glicose
aminoácidos
azoto total
energia total
energia não proteica
250 g
25 g
3,56 g
1100 kcal
1000 kcal
Como é Pediaven G25 e o que o pacote contém
Este medicamento é uma solução para infusão, transparente, incolor a ligeiramente amarelada, livre de partículas sólidas. Está disponível em um saco de duas câmaras (cada câmara contém 500 ml de solução).
Tamanho da embalagem: 4 sacos × 1000 ml.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Fresenius Kabi Polska Sp. z o.o.
Avenida Jerónimo, 134
02-305 Varsóvia
Fabricante
Fresenius Kabi Áustria GmbH
Rua Hafner, 36
8055 Graz
Áustria
Para obter informações mais detalhadas, deve contatar o titular da autorização de comercialização:
Fresenius Kabi Polska Sp. z o.o.
Avenida Jerónimo, 134
02-305 Varsóvia
telefone: +48 22 345 67 89
Este medicamento está autorizado para comercialização nos países membros do Espaço Económico Europeu sob os seguintes nomes:
Áustria
Pediaven G25%
Bélgica
Kidiamix G25%
Estônia
Pediaven G25
França
Kidiaven G25%
Espanha
Pediaven G25
Países Baixos
Kidiamix G25%
Lituânia
Pediaven G25%
Letônia
Pediaven G25%
Polônia
Pediaven G25
Portugal
Pediaven G25
Itália
Kidiamix G25%
Data da última atualização do folheto:21.01.2020
--------------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico:
Precauções e advertências para a administração
Pediaven G25, solução para infusão, é uma solução hipertônica.
Como o uso de veia central para infusão está associado a um risco de infecção, é importante seguir estritamente as normas de assepsia para evitar qualquer infecção, especialmente durante a colocação do cateter.
Para evitar o risco associado à administração de infusão com velocidade maior do que a recomendada, é importante realizar a infusão com velocidade regular e controlada.
Deve ser monitorizada a osmolalidade e a concentração de glicose no soro, bem como o equilíbrio hídrico-eletrolítico, o equilíbrio ácido-básico e a função hepática.
Em caso de ocorrência de qualquer sinal ou sintoma de reação anafilática (especialmente febre, arrepios, suor, erupções cutâneas ou dificuldade respiratória), a infusão deve ser interrompida imediatamente.
Pediaven G25 não deve ser administrado por via venosa periférica devido à sua alta osmolalidade.
Durante a administração, é necessária uma monitorização clínica e laboratorial, especialmente no início da infusão. A monitorização deve ser intensificada nos seguintes casos:
insuficiência hepática grave,
insuficiência renal grave,
acidose metabólica (distúrbio causado por uma grande quantidade de substâncias ácidas no sangue),
diabetes ou intolerância à glicose.
Extravasamento
Como em todos os medicamentos administrados por via intravenosa, durante a infusão de Pediaven G25 pode ocorrer extravasamento (ver ponto 4. Efeitos secundários possíveis).
Deve ser verificada regularmente a área de inserção do cateter para detectar sinais de extravasamento.
Em caso de ocorrência de extravasamento, a infusão deve ser interrompida imediatamente, mas o cateter ou a cânula deve ser deixado no lugar para permitir o tratamento imediato do doente, e o líquido remanescente deve ser aspirado antes de remover o cateter ou a cânula.
O tratamento do extravasamento pode incluir medidas não farmacológicas, farmacológicas e (ou) cirúrgicas. Em caso de extravasamento grave, deve ser consultado um cirurgião.
Não deve ser administrada infusão novamente na mesma veia central.
Método de administração
Infusão intravenosa, na veia central.
Para garantir a nutrição parenteral completa, é recomendada a administração concomitante de vitaminas (quantidade máxima que pode ser adicionada ao medicamento, ver Características do Produto Médico) e gorduras (administração apenas por meio de um conector Y, não diretamente no saco), a menos que seja contraindicado.
No entanto, Pediaven G25 já contém oligoelementos. Em alguns casos, dependendo das necessidades do doente, soluções farmacológicas ou destinadas à nutrição parenteral podem ser adicionadas ao saco, mas apenas após verificação da compatibilidade da mistura (ver ponto "Compatibilidade farmacêutica").
Durante o uso em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração.
Velocidade de infusão
A dose deve ser determinada individualmente, com base na idade do doente, peso corporal, necessidades metabólicas e energéticas, estado clínico do doente.
O médico realizará uma avaliação clínica e biológica regular do estado nutricional e da situação metabólica do doente, especialmente se a nutrição parenteral durar mais de 14 dias.
Recomendações gerais para a dose: a necessidade de glicose em crianças é de cerca de 10-15 g/kg de peso corporal por dia, com uma velocidade de infusão de 1–1,2 g/kg de peso corporal por hora, e a necessidade de azoto é de cerca de 200-300 mg/kg de peso corporal por dia.
A velocidade de infusão não deve exceder:
em lactentes (1 mês de vida – 2 anos): 6 ml/kg de peso corporal por hora (o que equivale a 1,4 g de glicose/kg de peso corporal por hora),
em crianças (2–11 anos): 5 ml/kg de peso corporal por hora (o que equivale a 1,2 g de glicose/kg de peso corporal por hora),
em jovens (11–18 anos): 2 ml/kg de peso corporal por hora (o que equivale a 0,5 g de glicose/kg de peso corporal por hora).
Precauções especiais para a preparação do medicamento para uso
Antes de usar, deve remover o saco externo e verificar se o saco interno está intacto (selado). Não use se a embalagem estiver danificada.
Use apenas se as soluções de aminoácidos e glicose estiverem transparentes, incolores a ligeiramente amareladas, livres de partículas sólidas. O conteúdo das duas câmaras separadas deve ser misturado antes do uso, e também antes da adição de outros componentes através do porto de administração de substâncias adicionais.
A exposição de soluções para nutrição parenteral à luz, especialmente após a adição de oligoelementos e (ou) vitaminas, pode levar à formação de peróxidos e outros produtos de degradação. Durante o uso em crianças com menos de 2 anos, Pediaven G25 deve ser protegido da luz até o final da administração.
Mistura das duas câmaras antes do uso
- 1. Remover o saco externo e colocar o saco em uma superfície plana.
- 2. Rolando suavemente o saco, começando pela parte superior (perto da alça), pressionando até que a solda vertical se rompa. Inverter o saco várias vezes, o que deve garantir a mistura completa dos componentes da mistura.
Apenas para uso único. O medicamento não utilizado deve ser descartado.
Deve ser seguido estritamente as condições de assepsia validadas para a manipulação do medicamento e do cateter, bem como para a perfusão.
Prazo de validade do medicamento após mistura
Foi demonstrada a estabilidade química e física do saco de duas câmaras após a mistura por 24 horas a 25°C. Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente. Se o medicamento não for usado imediatamente, o período de conservação durante o uso e as condições de conservação antes da administração são de responsabilidade do usuário.
Compatibilidade farmacêutica
A Pediaven G25 pode ser adicionada ou administrada através da mesma linha de infusão apenas com soluções farmacológicas ou destinadas à nutrição parenteral, cuja compatibilidade foi estabelecida.
As informações sobre o volume de substâncias adicionais e sua compatibilidade com Pediaven G25 estão disponíveis na Característica do Produto Médico, ponto 6.6 Precauções especiais para a eliminação e preparação do produto médico para uso. Existe o risco de precipitação de sais de cálcio.
Todas as adições devem ser feitas em condições de assepsia.
Precauções especiais para a eliminação e preparação do produto médico para uso
Durante o uso em crianças com menos de 2 anos, proteger da luz até o final da administração. A exposição de Pediaven G25 à luz, especialmente após a adição de oligoelementos e (ou) vitaminas, leva à formação de peróxidos e outros produtos de degradação, o que pode ser limitado protegendo da luz.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorFresenius Kabi Austria GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Pediaven G25Forma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Pediaven G25 noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Pediaven G25 em Espanha
Alternativa a Pediaven G25 em Ukraine
Médicos online para Pediaven G25
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Pediaven G25 – sujeita a avaliação médica e regras locais.














