
Pediaven G15

Pergunte a um médico sobre a prescrição de Pediaven G15

Como usar Pediaven G15
Folheto informativo: informação para o utilizador
Pediaven G15, solução para infusão
produto composto
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
Deve guardar este folheto, para que possa relê-lo se necessário.
Em caso de dúvidas, deve consultar o médico ou a enfermeira.
Se o doente apresentar algum efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou a enfermeira. Ver ponto 4.
Sumário do folheto
- 1. O que é Pediaven G15 e para que é utilizado
- 2. Informações importantes antes de tomar Pediaven G15
- 3. Como tomar Pediaven G15
- 4. Efeitos secundários possíveis
- 5. Como conservar Pediaven G15
- 6. Conteúdo da embalagem e outras informações
1. O que é Pediaven G15 e para que é utilizado
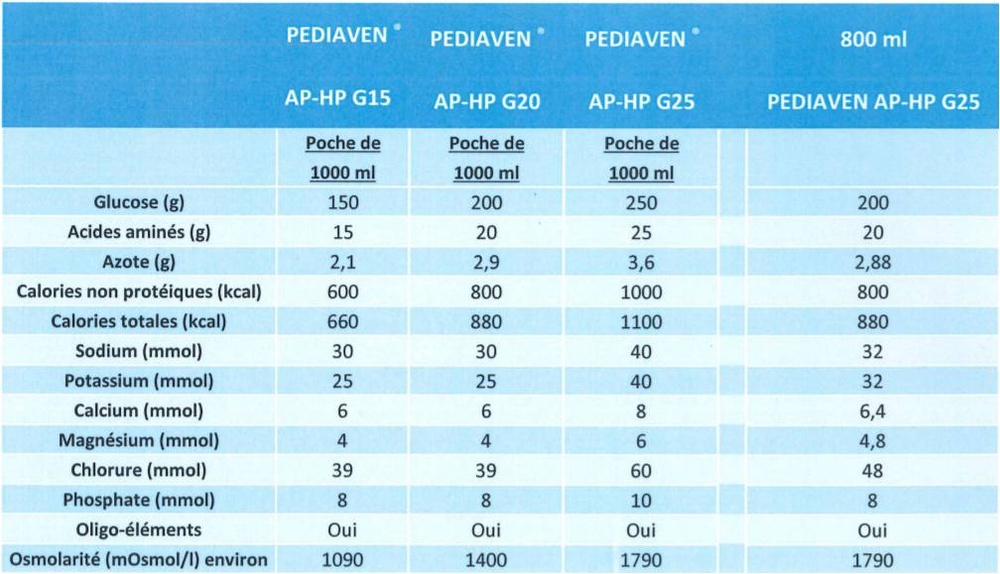
Pediaven G15 é uma solução nutricional que contém uma solução de aminoácidos (componentes necessários para a produção de proteínas) e glicose (carboidratos) com sais (eletrólitos e oligoelementos) disponível em um saco de plástico que contém duas câmaras, cada uma com uma capacidade de 500 ml.
Este medicamento é uma solução destinada a ser administrada por via intravenosa (infusão intravenosa).
Pode ser utilizado em lactentes, crianças e adolescentes que não podem receber alimentação por via oral.
2. Informações importantes antes de tomar Pediaven G15
Quando não tomar Pediaven G15:
se o doente for alérgico a substâncias ativas ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6);
se o doente tiver distúrbios metabólicos congénitos de aminoácidos (se o organismo utilizar certos aminoácidos de forma inadequada);
se o doente tiver doença hepática ou renal grave sem possibilidade de diálise;
se o doente tiver hiperglicemia grave (nível alto de açúcar no sangue) e a situação for descontrolada;
se a concentração no sangue do doente (no soro) de um dos sais (eletrólitos) presentes neste medicamento for elevada;
se o doente estiver em estado geral instável, por exemplo, após uma lesão grave ou em caso de diabetes descontrolada, acidose metabólica (problema causado por uma grande quantidade de substâncias ácidas no sangue), infecção grave (choque séptico), choque agudo ou coma;
se o doente estiver em estado de desnutrição grave e houver risco de ocorrência de "síndrome de choque alimentar".
Outras situações gerais em que não se deve tomar Pediaven G15:
se o doente tiver líquido nos pulmões (edema pulmonar agudo);
se o doente tiver excesso de líquido no organismo (hiperhidratação);
se o doente tiver insuficiência cardíaca não tratada;
se o doente tiver quantidade insuficiente de líquido no organismo (desidratação hipotônica).
Não se deve administrar Pediaven G15 se alguma das situações acima se aplicar ao doente.
Em caso de dúvidas, deve consultar o médico ou a enfermeira antes de administrar Pediaven G15 ao doente.
Precauções e advertências
Informações importantes antes de iniciar a administração de Pediaven G15 ao doente:
Pediaven G15 deve ser utilizado com grande precaução quando for necessário restringir a ingestão de líquidos, por exemplo, em certas doenças cardíacas, pulmonares ou renais.
Deve informar o médico se, durante o tratamento, o doente apresentar algum efeito secundário, como calafrios, suores, febre, erupções cutâneas ou problemas respiratórios. A infusão deve ser interrompida.
Durante a administração em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração. A exposição da solução de Pediaven G15 à luz, especialmente após a adição de oligoelementos e (ou) vitaminas, pode levar à formação de peróxidos e outros produtos de degradação, o que pode ser limitado protegendo da luz.
Pediaven G15 e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, incluindo medicamentos sem prescrição médica.
3. Como tomar Pediaven G15
Dosagem
Pediaven G15 deve ser sempre utilizado de acordo com as recomendações do médico. O médico decidirá a dose e a duração do tratamento, com base na idade do doente, peso corporal, necessidades metabólicas e energéticas, estado clínico e capacidade de metabolizar a alimentação oral e enteral (fornecimento de nutrientes através de um tubo inserido no trato gastrointestinal).
Se a alimentação for exclusivamente intravenosa (administração por via venosa), o médico pode recomendar a administração concomitante de vitaminas e gorduras. Se vitaminas forem adicionadas ao medicamento, o saco deve ser protegido da luz.
Via de administração
Pediaven G15 é administrado exclusivamente por pessoal médico e apenas por via intravenosa, em uma veia central (em uma grande veia).
Durante a administração em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver ponto 2).
Uso de dose maior do que a recomendada de Pediaven G15
Pediaven G15 deve ser sempre utilizado de acordo com as recomendações do médico. Em caso de dúvidas de que o doente tenha tomado uma dose maior do que a recomendada de Pediaven G15, deve informar imediatamente o médico.
Omissão da administração de Pediaven G15
Pediaven G15 deve ser sempre utilizado de acordo com as recomendações do médico. Deve informar imediatamente o médico se o doente não receber a infusão de Pediaven G15. Não se deve administrar uma dose dupla para compensar a dose omitida e não se deve exceder a velocidade de infusão recomendada.
Em caso de dúvidas adicionais relacionadas com a administração deste medicamento, deve consultar o médico.
4. Efeitos secundários possíveis
Como qualquer medicamento, Pediaven G15 pode causar efeitos secundários, embora não em todos os doentes.
Deve contactar imediatamente o médico, que interromperá a infusão, se o doente apresentar os seguintes sintomas:
reacções alérgicas atípicas, como suores, febre, calafrios, dores de cabeça, erupções cutâneas ou problemas respiratórios.
Podem ocorrer efeitos secundários relacionados com a administração de nutrientes por via parentérica (alimentação por via venosa), especialmente no início do tratamento, que incluem:
aumento da concentração de açúcar no sangue (hiperglicemia);
distúrbios gastrointestinais (náuseas, vómitos);
ingestão excessiva de aminoácidos pode causar acidose metabólica (distúrbio do equilíbrio de substâncias ácidas e básicas no organismo). Pode ocorrer hiperazotemia (quantidade excessiva de compostos azotados no sangue), especialmente se o doente tiver problemas renais, hepáticos ou respiratórios;
distúrbios transitórios da função hepática;
reacções alérgicas a certos aminoácidos.
A administração inadequada (sobredosagem ou infusão demasiado rápida) pode levar à ocorrência de sintomas de hiperglicemia e hiperolemia (aumento do volume de sangue nas veias).
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, incluindo qualquer efeito secundário não mencionado no folheto, deve informar o médico ou o farmacêutico. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos, Produtos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Varsóvia
tel.: +48 22 49 21 301
fax: +48 22 49 21 309
e-mail: [email protected]
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a recolher mais informações sobre a segurança do medicamento.
5. Como conservar Pediaven G15
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não utilizar este medicamento após o prazo de validade impresso na etiqueta após: EXP. O prazo de validade refere-se ao último dia do mês indicado.
Conservar a uma temperatura inferior a 25°C. Não congelar. Conservar no saco exterior. Utilizar imediatamente após a mistura do conteúdo das duas câmaras.
Durante a administração em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver ponto 2).
Prazo de validade do medicamento após a mistura com substâncias adicionais
Após a mistura das duas câmaras, podem ser adicionados outros componentes através do porto destinado à adição de substâncias. O medicamento deve ser utilizado imediatamente após a adição de outros componentes.
Não utilizar este medicamento se a embalagem estiver danificada ou se houver sinais de deterioração.
Os medicamentos não devem ser eliminados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Pediaven G15
As substâncias ativas do medicamento são:
Substâncias ativas Solução de aminoácidos
Solução Solução de glicose pronta para uso
1000 ml
alanina
1,45 g
1,45 g
arginina
0,94 g
0,94 g
ácido aspártico
0,94 g
0,94 g
acetilcisteína
(correspondente a cisteína)
500 ml 500 ml
0,31 g
(0,23 g)
ácido glutâmico
1,63 g
1,63 g
glicina
0,48 g
0,48 g
histidina
0,48 g
0,48 g
isoleucina
0,71 g
0,71 g
leucina
1,61 g
1,61 g
lisina monohidratada
(correspondente a lisina anidra)
0,31 g
(0,23 g)
1,45 g
(1,29 g)
metionina
0,30 g
0,30 g
fenilalanina
0,62 g
0,62 g
prolina
1,29 g
1,29 g
serina
0,87 g
0,87 g
taurina
0,07 g
0,07 g
treonina
0,83 g
0,83 g
triptofano
0,32 g
0,32 g
tirosina
0,11 g
0,11 g
valina
0,83 g
0,83 g
fosfato de potássio
1,39 g
1,39 g
selênio
0,05 mg
0,05 mg
glicose monohidratada
(correspondente a glicose anidra)
1,45 g
(1,29 g)
165,0 g
(150,0 g)
gluconato de cálcio
2,69 g
2,69 g
lactato de magnésio dihidratado
0,95 g
0,95 g
cloruro de sódio
1,75 g
1,75 g
cloruro de potássio
0,67 g
0,67 g
acetato de zinco dihidratado
6,72 mg
6,72 mg
sulfato de cobre pentahidratado
1,00 mg
1,00 mg
fluoreto de sódio
1,11 mg
1,11 mg
cloruro de manganês tetrahidratado
0,36 mg
0,36 mg
iodeto de potássio
0,07 mg
0,07 mg
cloruro de cromo hexahidratado
0,10 mg
0,10 mg
165,0 g
(150,0 g)
sulfato ferroso heptahidratado
2,49 mg
2,49 mg
cloruro de cobalto hexahidratado
0,61 mg
0,61 mg
molibdato de amônio tetrahidratado
0,09 mg
0,09 mg
Os outros componentes (substâncias auxiliares) são: ácido acético glacial (para ajustar o pH), ácido clorídrico (para ajustar o pH), água para injeção.
Osmolalidade da solução: 1091 mOsmol/l
pH da solução: 4,8 – 5,5
Valor nutricional em 1000 ml
glicose
aminoácidos
azoto total
energia total
energia não proteica
150 g
15 g
2,14 g
660 kcal
600 kcal
Como é Pediaven G15 e o que contém a embalagem
Este medicamento é uma solução para infusão, transparente, incolor a ligeiramente amarelada, livre de partículas sólidas. Está disponível em um saco de duas câmaras (cada câmara contém 500 ml de solução).
Tamanho da embalagem: 4 sacos × 1000 ml.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Fresenius Kabi Polska Sp. z o.o.
Al. Jerozolimskie 134
02-305 Varsóvia
Fabricante
Fresenius Kabi Austria GmbH
Hafnerstrasse 36
8055 Graz
Áustria
Para obter informações mais detalhadas, deve contactar o titular da autorização de comercialização:
Fresenius Kabi Polska Sp. z o.o.
Al. Jerozolimskie 134
02-305 Varsóvia
tel.: +48 22 345 67 89
Este medicamento está autorizado à comercialização nos Estados-Membros do Espaço Económico Europeu sob as seguintes designações:
Austria
Pediaven G15%
Bélgica
Kidiamix G15%
Estónia
Pediaven G15
França
Kidiaven G15%
Espanha
Pediaven G15
Países Baixos
Kidiamix G15%
Lituânia
Pediaven G15%
Letónia
Pediaven G15%
Polónia
Pediaven G15
Portugal
Pediaven G15
Hungria
Pediaven G15
Itália
Kidiamix G15%
Data da última revisão do folheto:21.01.2020
--------------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Precauções e advertências para a administração
Pediaven G15, solução para infusão, é uma solução hipertônica.
Como a utilização de uma veia central para a infusão está associada a um risco de infecção, deve-se seguir rigorosamente as normas de procedimento asséptico para evitar qualquer infecção, especialmente durante a colocação do cateter.
Para evitar o risco associado à administração de infusão a uma velocidade maior do que a recomendada, é importante realizar a infusão a uma velocidade regular e controlada.
Deve-se controlar a osmolalidade e a concentração de glicose no soro, bem como o equilíbrio hídrico-eletrolítico, o equilíbrio ácido-básico e a função hepática.
Em caso de ocorrência de qualquer sinal ou sintoma de reação anafilática (especialmente febre, calafrios, suores, erupções cutâneas ou dificuldade respiratória), deve-se interromper imediatamente a infusão.
Não se deve administrar Pediaven G15 por via venosa periférica devido à sua alta osmolalidade.
Durante a infusão, é necessária a monitorização clínica e laboratorial, especialmente no início. A monitorização deve ser reforçada nos seguintes casos:
insuficiência hepática grave,
insuficiência renal grave,
acidose metabólica (distúrbio causado por uma grande quantidade de substâncias ácidas no sangue),
diabetes ou intolerância à glicose.
Extravasação
Como em todos os medicamentos administrados por via intravenosa, durante a infusão deste medicamento pode ocorrer extravasação (ver ponto 4. Efeitos secundários possíveis).
Deve-se verificar regularmente o local de colocação do cateter para detectar sinais de extravasação.
Em caso de extravasação, deve-se interromper imediatamente a infusão, deixando o cateter ou a cânula colocada para permitir o tratamento imediato do doente, e aspirar o líquido restante antes de remover o cateter ou a cânula.
O procedimento após a extravasação pode incluir tratamento não farmacológico, farmacológico e (ou) intervenção cirúrgica. Em caso de extravasação grave, deve-se consultar um cirurgião.
Não se deve administrar a infusão novamente na mesma veia central.
Método de administração
Infusão intravenosa, em uma veia central.
Para garantir a nutrição parentérica completa, é recomendada a administração concomitante de vitaminas (quantidade máxima que pode ser adicionada ao medicamento, ver Características do Produto Médico) e gorduras (administração apenas através de um conector Y, não diretamente no saco), a menos que seja contraindicado.
No entanto, Pediaven G15 já contém oligoelementos. Em alguns casos, dependendo das necessidades do doente, soluções farmacológicas e destinadas à nutrição parentérica podem ser adicionadas ao saco, mas apenas após a verificação da compatibilidade da mistura preparada (ver ponto "Compatibilidade farmacêutica").
Durante a administração em crianças com menos de 2 anos, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração.
Velocidade de infusão
A dose deve ser estabelecida individualmente, com base na idade do doente, peso corporal, necessidades metabólicas e energéticas, estado clínico do doente.
O médico deve realizar uma avaliação clínica e biológica regular do estado nutricional e da situação metabólica do doente, especialmente se a nutrição parentérica durar mais de 14 dias.
Recomendações gerais para a dose: a necessidade de glicose em crianças é de cerca de 10-15 g/kg de peso corporal por dia, com uma velocidade de infusão de 1-1,2 g/kg de peso corporal por hora, e a necessidade de azoto é de cerca de 200-300 mg/kg de peso corporal por dia.
A velocidade de infusão não deve exceder:
em lactentes (1 mês de vida - 2 anos): 9 ml/kg de peso corporal por hora (correspondente a 1,4 g de glicose/kg de peso corporal por hora),
em crianças (2-11 anos): 8 ml/kg de peso corporal por hora (correspondente a 1,2 g de glicose/kg de peso corporal por hora),
em adolescentes (11-18 anos): 3 ml/kg de peso corporal por hora (correspondente a 0,5 g de glicose/kg de peso corporal por hora).
Precauções especiais para a preparação do medicamento para administração
Antes de usar, deve-se remover o saco exterior e verificar se o saco interior está intacto (selado). Não utilizar se a embalagem estiver danificada.
Deve-se utilizar apenas se as soluções de aminoácidos e glicose estiverem transparentes, incolores a ligeiramente amareladas, livres de partículas sólidas. O conteúdo das duas câmaras separadas deve ser misturado antes de usar, e também antes de adicionar outros componentes através do porto destinado a esse fim.
A exposição das soluções de nutrição parentérica à luz, especialmente após a adição de oligoelementos e (ou) vitaminas, pode levar à formação de peróxidos e outros produtos de degradação. Durante a administração em crianças com menos de 2 anos, o medicamento Pediaven G15 deve ser protegido da luz até o final da administração.
Mistura das duas câmaras antes de usar
- 1. Remover o saco exterior e colocar o saco em uma superfície dura.
- 2. Rolrar suavemente o saco, começando pela parte superior (da parte do cabo), pressionando até que a solda vertical se rompa. Inverter o saco várias vezes, o que deve garantir a mistura completa dos componentes da mistura.
Apenas para uso único. O medicamento não utilizado deve ser eliminado.
Deve-se seguir rigorosamente as condições assépticas validadas para a manipulação do medicamento e do cateter, bem como para a perfusão.
Prazo de validade do medicamento após a mistura
Foi demonstrada a estabilidade química e física do saco de duas câmaras após a mistura por 24 horas a 25°C. Do ponto de vista microbiológico, o medicamento deve ser utilizado imediatamente. Se o medicamento não for utilizado imediatamente, o período de conservação durante o uso e as condições de conservação antes da administração são da responsabilidade do utilizador.
Compatibilidade farmacêutica
Podem ser adicionados ao medicamento Pediaven G15 ou administrados pela mesma linha de infusão apenas soluções farmacológicas ou destinadas à nutrição parentérica, cuja compatibilidade tenha sido estabelecida.
As informações sobre o volume de substâncias adicionais e sua compatibilidade com Pediaven G15 estão disponíveis na Característica do Produto Médico, ponto 6.6 Precauções especiais para a eliminação e preparação do produto médico para administração. Existe o risco de precipitação de sais de cálcio.
Qualquer aditivo deve ser misturado com o medicamento em condições assépticas.
Precauções especiais para a eliminação e preparação do produto médico para administração
Durante a administração em crianças com menos de 2 anos, proteger da luz até o final da administração. A exposição do medicamento Pediaven G15 à luz, especialmente após a adição de oligoelementos e (ou) vitaminas, pode levar à formação de peróxidos e outros produtos de degradação, o que pode ser limitado protegendo da luz.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorFresenius Kabi Austria GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Pediaven G15Forma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Pediaven G15 noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Pediaven G15 em Espanha
Alternativa a Pediaven G15 em Ukraine
Médicos online para Pediaven G15
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Pediaven G15 – sujeita a avaliação médica e regras locais.














