

Olimel N9e

Pergunte a um médico sobre a prescrição de Olimel N9e

Como usar Olimel N9e
Folheto para o paciente: Informação para o utilizador
OLIMEL N9E, emulsão para infusão
Deve ler atentamente o conteúdo do folheto antes de administrar o medicamento, pois contém informações importantes para o paciente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de alguma dúvida, deve consultar o médico ou a enfermeira.
- Se o paciente apresentar algum efeito adverso, incluindo qualquer efeito adverso não listado neste folheto, deve informar o médico ou a enfermeira. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento OLIMEL N9E, emulsão para infusão e para que é utilizado
- 2. Informações importantes antes de administrar o medicamento OLIMEL N9E, emulsão para infusão
- 3. Como administrar o medicamento OLIMEL N9E, emulsão para infusão
- 4. Efeitos adversos possíveis
- 5. Como conservar o medicamento OLIMEL N9E, emulsão para infusão
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento OLIMEL N9E, emulsão para infusão e para que é utilizado
OLIMEL é uma emulsão para infusão. O medicamento é fornecido em um saco de três câmaras.
Na primeira câmara, há uma solução de glicose com cálcio, na segunda - uma emulsão de gordura, e na
terceira - uma solução de aminoácidos com outros eletrólitos.
OLIMEL é utilizado para nutrição parenteral por via intravenosa em adultos e crianças com mais de
2 anos de idade, quando a nutrição oral não é adequada.
OLIMEL só deve ser utilizado sob controle médico.
2. Informações importantes antes de administrar o medicamento OLIMEL N9E, emulsão para infusão
Quando não utilizar o medicamento OLIMEL N9E, emulsão para infusão:
- em recém-nascidos, bebês e crianças com menos de 2 anos de idade;
- se o paciente tiver alergia a ovos, soja, proteínas de amendoim, milho/ produtos que contenham milho (ver também o ponto "Advertências e precauções" abaixo) ou a qualquer um dos outros componentes do medicamento (listados no ponto 6);
- se a administração de alguns aminoácidos causar uma reação anormal do organismo do paciente;
- se o paciente tiver um nível de gordura no sangue muito elevado;
- se o paciente tiver hiperglicemia (nível de açúcar no sangue muito elevado);
- se o paciente tiver um nível de eletrólitos (sódio, potássio, magnésio, cálcio e/ou fósforo) anormalmente alto no sangue.
Em cada caso, o médico tomará a decisão de administrar o medicamento com base em fatores como idade,
peso corporal do paciente e seu estado de saúde, incluindo os resultados dos exames realizados.
Advertências e precauções
Antes de iniciar a administração de OLIMEL N9E, deve discutir com o médico ou a enfermeira.
A administração excessivamente rápida de soluções para nutrição parenteral total pode resultar em lesão ou
morte do paciente.
Se ocorrerem sinais ou sintomas atípicos de reação alérgica (como suor, febre, calafrios, dor de cabeça, erupção cutânea ou problemas respiratórios), deve interromper imediatamente a infusão. O medicamento contém óleo de soja e fosfolipídios de ovo. As proteínas de soja e ovo podem causar reações de sensibilidade. Foram observadas reações alérgicas cruzadas entre as proteínas de soja e amendoim.
O medicamento OLIMEL contém glicose derivada do milho, que pode causar reações de sensibilidade se o paciente tiver alergia ao milho ou produtos que contenham milho (ver ponto "Quando não utilizar o medicamento OLIMEL N9E, emulsão para infusão:" acima).
Dificuldades respiratórias também podem ser um sinal de que partículas pequenas estão bloqueando os vasos sanguíneos nos pulmões (depósitos nos vasos pulmonares). Se ocorrerem dificuldades respiratórias, deve informar o médico ou a enfermeira. Eles decidirão sobre a ação apropriada.
O antibiótico ceftriaxon não deve ser misturado ou administrado concomitantemente com qualquer solução que contenha cálcio (incluindo o medicamento OLIMEL) por via intravenosa.
Esses medicamentos não devem ser administrados concomitantemente, mesmo por diferentes linhas de infusão ou locais de infusão.
No entanto, o medicamento OLIMEL e a ceftriaxon podem ser administrados sequencialmente, se as linhas de infusão forem inseridas em locais diferentes ou forem trocadas ou lavadas cuidadosamente com solução salina fisiológica entre as infusões, para evitar a formação de depósitos (precipitação de sais de cálcio da ceftriaxon).
Alguns medicamentos e doenças podem aumentar o risco de infecção ou septicemia (presença de bactérias no sangue). Um risco especial de infecção ou septicemia existe após a inserção de um cateter (cateter venoso) na veia do paciente. O médico monitorará cuidadosamente o paciente para detectar qualquer sinal de infecção. Pacientes que necessitam de nutrição parenteral (administração de substâncias nutricionais por via de um cateter inserido na veia) estão, devido ao seu estado clínico, mais propensos a desenvolver infecção. A adoção de procedimentos assépticos durante a inserção, manipulação do cateter e preparo do medicamento para nutrição (nutrição parenteral total) pode reduzir o risco de infecção.
Se o paciente estiver gravemente desnutrido, de modo que precise receber alimento pela veia, o médico deve iniciar o tratamento lentamente. Ao mesmo tempo, o médico deve monitorar cuidadosamente o paciente para evitar mudanças súbitas no volume de líquidos, níveis de vitaminas, eletrólitos e minerais.
Antes de iniciar a infusão, deve corrigir as perturbações do equilíbrio hidroeletrolítico e metabólico do paciente. O médico monitorará o paciente durante a terapia e pode ajustar a dosagem ou, se achar necessário, prescrever suplementos nutricionais adicionais, como vitaminas, eletrólitos e minerais.
Em pacientes que recebem terapia nutricional parenteral, foram relatados distúrbios da função hepática, incluindo dificuldades de eliminação da bile (colestase), acúmulo de gordura (esteatose hepática), fibrose, provavelmente levando à insuficiência hepática, bem como inflamação da vesícula biliar e cálculos biliares. Acredita-se que as causas desses distúrbios sejam variadas em diferentes pacientes. Se o paciente apresentar sintomas como náuseas, vômitos, dor abdominal, icterícia ou olhos amarelados, deve consultar o médico para permitir a identificação de possíveis causas e fatores, bem como medidas terapêuticas e preventivas.
Deve informar o médico:
- sobre doenças renais graves. Também deve informar o médico se o paciente está submetido a diálise (rim artificial) ou outros métodos de limpeza do sangue;
- sobre doenças hepáticas graves;
- sobre distúrbios da coagulação do sangue;
- sobre disfunção adrenal (insuficiência adrenal). As glândulas adrenais são glândulas com forma triangular, localizadas no topo dos rins;
- sobre insuficiência cardíaca;
- sobre doença pulmonar;
- sobre retenção de líquidos no organismo (hiperhidratação);
- sobre falta de líquidos no organismo (desidratação);
- sobre diabetes não tratada;
- sobre infarto do miocárdio ou choque devido à insuficiência cardíaca aguda;
- sobre acidose metabólica grave (pH do sangue muito ácido);
- sobre septicemia generalizada;
- sobre coma.
Para verificar a eficácia e segurança do medicamento, durante a administração do medicamento, o paciente será submetido a exames clínicos e laboratoriais prescritos pelo médico. Se o medicamento for administrado por várias semanas, o sangue do paciente será examinado regularmente.
A capacidade reduzida do organismo de eliminar os lipídios contidos no medicamento administrado pode resultar no chamado síndrome de sobrecarga lipídica (ver ponto 4 - "Efeitos adversos possíveis").
Se ocorrer dor, queimadura ou inchaço no local da infusão ou vazamento do líquido administrado durante a infusão, deve informar o médico ou a enfermeira.
A administração do medicamento será interrompida imediatamente e, em seguida, reiniciada em outra veia.
Se o nível de glicose no sangue aumentar excessivamente, o médico deve ajustar a velocidade de administração do medicamento OLIMEL ou administrar um medicamento para controlar o nível de açúcar no sangue (insulina).
OLIMEL pode ser administrado por um cateter (cateter venoso) inserido em uma veia grande no tórax do paciente (veia central).
Crianças e adolescentes
Quando utilizado em crianças abaixo de 18 anos de idade, deve-se ter cuidado para administrar a dose correta do medicamento. Devido à maior sensibilidade das crianças ao risco de infecção, também devem ser tomadas medidas de precaução aumentadas. Sempre é necessário enriquecer com vitaminas e minerais. Para crianças, devem ser utilizadas formulações e quantidades pediátricas.
OLIMEL e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o paciente está tomando ou utilizando atualmente ou recentemente, bem como sobre medicamentos que o paciente planeja tomar ou utilizar.
A administração concomitante de outros medicamentos geralmente não é contraindicada. No entanto, deve informar o médico sobre todos os medicamentos tomados recentemente, incluindo aqueles vendidos sem prescrição, para verificar sua compatibilidade.
Deve informar o médico sobre a administração ou recebimento de:
- insulina,
- heparina.
Não deve administrar o medicamento OLIMEL concomitantemente com sangue pelo mesmo conjunto de infusão.
OLIMEL contém cálcio. Não deve ser administrado concomitantemente com o antibiótico ceftriaxon ou pela mesma linha de infusão, pois podem se formar partículas. Se esses medicamentos forem administrados sequencialmente por meio do mesmo dispositivo, deve ser lavado cuidadosamente.
Devido ao risco de formação de depósitos, o medicamento OLIMEL não deve ser administrado pela mesma linha de infusão ou adicionado à amplicilina (antibiótico) ou fosfenitoína (medicamento anticonvulsivante).
Óleo e óleo de soja presentes no medicamento OLIMEL contêm vitamina K. Geralmente, isso não afeta a ação de medicamentos anticoagulantes, como a cumarina. No entanto, se o paciente estiver tomando medicamentos anticoagulantes, deve informar o médico.
As gorduras presentes na emulsão podem interferir nos resultados de alguns exames laboratoriais, se a amostra de sangue for coletada antes que as gorduras sejam eliminadas do sangue do paciente (elas são eliminadas do sangue após 5 a 6 horas após a administração das gorduras).
OLIMEL contém potássio. Deve-se ter cuidado especial em pacientes que estejam tomando diuréticos, inibidores da enzima conversora de angiotensina (ECA), antagonistas do receptor de angiotensina II (medicamentos utilizados na hipertensão) ou imunossupressores. Medicamentos desses tipos podem causar aumento do nível de potássio no sangue.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, acredita que possa estar grávida ou planeja ter um filho, deve consultar o médico antes de administrar este medicamento.
Falta de experiência adequada sobre o uso do medicamento OLIMEL N9E em mulheres grávidas ou lactantes. Se necessário, pode-se considerar a administração do medicamento OLIMEL N9E durante a gravidez e amamentação. O medicamento OLIMEL N9E deve ser administrado a mulheres grávidas ou lactantes apenas após uma avaliação cuidadosa.
Condução de veículos e operação de máquinas
Não se aplica.
3. Como administrar o medicamento OLIMEL N9E, emulsão para infusão
Dosagem
OLIMEL deve ser utilizado apenas em adultos e em crianças com mais de 2 anos de idade.
O medicamento tem a forma de emulsão para infusão administrada por um cateter (cateter venoso) inserido em uma veia grande no tórax do paciente.
Antes de usar, OLIMEL deve estar à temperatura ambiente.
OLIMEL é destinado a uso único.
A infusão de 1 saco geralmente dura de 12 a 24 horas.
Dosagem - adultos
A velocidade de administração, de acordo com as necessidades e o estado clínico do paciente, será determinada pelo médico.
O medicamento pode ser utilizado por tanto tempo quanto necessário, dependendo do estado clínico do paciente.
Dosagem - crianças com mais de 2 anos de idade e adolescentes
A dose do medicamento e o período de administração são determinados pelo médico. Isso depende da idade, peso corporal, crescimento, estado de saúde e capacidade do organismo de decompor e utilizar os componentes do medicamento OLIMEL N9E.
Administração de dose maior do que a recomendada do medicamento OLIMEL N9E, emulsão para infusão
Se o paciente receber uma dose excessiva do medicamento ou uma infusão muito rápida, os aminoácidos contidos podem contribuir para o aumento da acidez do sangue e o aparecimento de sintomas de hipervolemia (aumento do volume de sangue circulante). O nível de glicose no sangue e na urina pode aumentar, pode ocorrer a formação de um síndrome de hiperosmolaridade (viscosidade excessiva do sangue), e as gorduras presentes na emulsão podem aumentar o nível de triglicerídeos no sangue. A administração de uma infusão com velocidade excessiva ou volume excessivo do medicamento OLIMEL pode causar náuseas, vômitos, calafrios, dor de cabeça, ondas de calor, suor excessivo (hiperidrose) e distúrbios eletrolíticos. Nesse caso, deve-se interromper imediatamente a infusão.
Em alguns casos graves, para ajudar os rins do paciente a eliminar o excesso do medicamento, o médico pode ser obrigado a submeter o paciente a diálise renal temporária.
Para evitar tais situações, o médico monitorará regularmente o estado do paciente e verificará os parâmetros do sangue.
Em caso de dúvidas sobre a administração do medicamento, deve-se consultar o médico.
4. Efeitos adversos possíveis
Como qualquer medicamento, este medicamento pode causar efeitos adversos, embora não todos os pacientes os experimentem.
Se ocorrerem alterações no bem-estar durante o tratamento ou após a sua interrupção, deve informar imediatamente o médico ou a enfermeira.
Os exames realizados pelo médico durante a administração do medicamento ao paciente devem minimizar o risco de efeitos adversos.
Se ocorrerem sinais ou sintomas atípicos de reação alérgica, como suor excessivo, febre, calafrios, dor de cabeça, erupção cutânea ou problemas respiratórios, deve interromper imediatamente a infusão.
Durante a administração do medicamento OLIMEL, foram relatados os seguintes efeitos adversos:
Frequência - Frequente: pode afetar até 1 em 10 pessoas
- batimento cardíaco acelerado (taquicardia);
- perda de apetite;
- nível de gordura no sangue elevado (hipertrigliceridemia);
- dor abdominal;
- diarreia;
- náuseas;
- pressão arterial elevada (hipertensão).
Frequência - Desconhecida: frequência não pode ser estimada com base nos dados disponíveis
- reações de sensibilidade, incluindo suor, febre, calafrios, dor de cabeça, erupção cutânea (eritematosa, papulosa, pustulosa, maculopapulosa, erupção generalizada), prurido, ondas de calor, dificuldades respiratórias;
- vazamento da infusão para os tecidos circundantes (extravasamento) pode levar a dor, irritação, inchaço/edema, vermelhidão (eritema)/aquecimento, necrose da pele ou bolhas/bolhas, inflamação, espessamento ou contração da pele no local da infusão;
- vômitos.
Durante a administração de medicamentos semelhantes para nutrição parenteral, foram relatados os seguintes efeitos adversos:
Frequência - Muito rara: pode afetar até 1 em 10.000 pessoas
- diminuição da capacidade de eliminar lipídios (síndrome de sobrecarga lipídica) associada à deterioração súbita do estado de saúde do paciente. Os sintomas da síndrome de sobrecarga lipídica geralmente desaparecem após a interrupção da infusão da emulsão lipídica. o Febre o Diminuição do número de glóbulos vermelhos, que pode causar palidez da pele e ser a causa de fraqueza ou falta de ar (anemia) o Diminuição do número de glóbulos brancos, que pode aumentar o risco de infecções (leucopenia) o Diminuição do número de plaquetas, que pode aumentar o risco de hematomas e/ou sangramento (trombocitopenia) o Distúrbios da coagulação, que afetam a capacidade de coagulação do sangue o Nível de gordura no sangue elevado (hiperlipidemia) o Acúmulo de gordura no fígado (hepatomegalia) o Deterioração da função hepática o Sintomas do sistema nervoso central (por exemplo, coma).
Frequência — Desconhecida:frequência não pode ser estimada com base nos dados disponíveis
- reações alérgicas;
- resultado anormal do exame de sangue para função hepática;
- dificuldades de eliminação da bile (colestase);
- aumento do tamanho do fígado (hepatomegalia);
- doenças hepáticas relacionadas à nutrição parenteral (ver "Advertências e precauções" no ponto 2);
- icterícia;
- diminuição do número de plaquetas (trombocitopenia);
- nível de azoto no sangue elevado (azotemia);
- atividade aumentada de enzimas hepáticas;
- formação de partículas que podem bloquear os vasos sanguíneos nos pulmões (depósitos nos vasos pulmonares), levando a embolia pulmonar e dificuldades respiratórias (insuficiência respiratória).
Notificação de efeitos adversos
Se ocorrerem efeitos adversos, incluindo qualquer efeito adverso não listado no folheto, deve informar o médico ou a enfermeira. Efeitos adversos podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Adversos de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos
Al. Jerozolimskie 181C
02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio na Internet: https://smz.ezdrowie.gov.pl
Efeitos adversos também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos adversos permitirá reunir mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento OLIMEL N9E, emulsão para infusão
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não deve utilizar este medicamento após o prazo de validade impresso no recipiente e na embalagem exterior (MM/AAAA). O prazo de validade é o último dia do mês indicado.
Não congelar.
Conservar na embalagem protetora.
Medicamentos não devem ser jogados na canalização ou lixeiras domésticas. Deve perguntar ao farmacêutico como eliminar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento OLIMEL N9E, emulsão para infusão
Os componentes ativos em cada um dos sacos da emulsão pronta para uso são: 14,2% (correspondente a 14,2 g/100 ml) solução de L-aminoácidos (alanina, arginina, glicina, histidina, isoleucina, leucina, lisina (na forma de lisina acetato), metionina, fenilalanina, prolina, serina, treonina, triptofano, tirosina, valina, ácido aspártico, ácido glutâmico) com eletrólitos (sódio, potássio, magnésio, fosfatos, acetatos, cloretos), 20% (correspondente a 20 g/100 ml) emulsão lipídica (óleo de oliva purificado e óleo de soja purificado) e 27,5% (correspondente a 27,5 g/100 ml) solução de glicose (na forma de glicose monoidratada) com cálcio.
Outros componentes do medicamento são:
| Câmara com emulsão lipídica | Câmara com solução de aminoácidos | Câmara com solução de glicose |
| Fosfolipídios de ovo purificados, glicerol, oleato de sódio, hidróxido de sódio (para ajuste do pH), água para injeção | Ácido acético glacial (para ajuste do pH), água para injeção | Ácido clorídrico (para ajuste do pH), água para injeção |
Como é o medicamento OLIMEL N9E emulsão para infusão e o que o pacote contém
OLIMEL é uma emulsão para infusão fornecida em um saco de três câmaras. A primeira câmara contém a emulsão lipídica, a segunda câmara contém a solução de aminoácidos com eletrólitos, e a terceira câmara contém a solução de glicose com cálcio. As câmaras são separadas por selos não permeáveis.
Antes da administração, o conteúdo das câmaras deve ser misturado girando o saco em direção a si, começando pela parte superior do saco, até que os selos sejam rompidos.
Após a mistura, o medicamento tem a forma de uma emulsão homogênea com aparência leitosa.
O saco de três câmaras é uma bolsa plástica multicamada. A camada interna (em contato com o medicamento) do saco é compatível com os componentes e aditivos permitidos.
Para evitar o contato com o oxigênio do ar, o saco é embalado em uma embalagem protetora que protege contra a entrada de oxigênio, com um sachê que absorve oxigênio.
Tamanhos do pacote
saco de 1000 ml: 1 caixa de papelão com 6 sacos
saco de 1500 ml: 1 caixa de papelão com 4 sacos; 1 caixa de papelão com 5 sacos
saco de 2000 ml: 1 caixa de papelão com 4 sacos; 1 caixa de papelão com 5 sacos
1 saco com capacidade de 1000 ml, 1500 ml e 2000 ml.
Nem todos os tamanhos de pacotes precisam estar disponíveis no mercado.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Baxter Polska Sp. z o. o.
Ul. Kruczkowskiego 8
00-380 Varsóvia
Fabricante
BAXTER S.A.
Boulevard Rene Branquart 80
7860 Lessines, Bélgica
Este medicamento está autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes:
França, Portugal, Estônia, Polônia, Lituânia, Bulgária, Romênia, Letônia, República Tcheca, Bélgica, Espanha,
Eslováquia, Holanda, Luxemburgo, Eslovênia, Itália, Grécia, Chipre, Hungria: OLIMEL N9E
Em alguns países, é registrado sob um nome comercial diferente, como descrito abaixo:
Áustria: ZentroOLIMEL 5,7 % com eletrólitos
Alemanha: Olimel 5,7% E
Dinamarca, Islândia, Suécia, Noruega, Finlândia: Olimel N9E
Reino Unido, Irlanda, Malta: Triomel 9g/l nitrogênio 1070 kcal/l com eletrólitos
Data da última atualização do folheto abril 2025
--------------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico especializado:
Grupo farmacoterapêutico: soluções para nutrição parenteral/misturas
Código ATC: B05 BA10.
A. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
OLIMEL tem a forma de um saco de três câmaras.
Cada saco contém uma solução de glicose com cálcio, uma emulsão lipídica e uma solução de aminoácidos com outros eletrólitos:
| Conteúdo por saco | |||
| 1000 ml | 1500 ml | 2000 ml | |
| 27,5% solução de glicose (correspondente a 27,5 g/100 ml) | 400 ml | 600 ml | 800 ml |
| 14,2% solução de aminoácidos (correspondente a 14,2 g/100 ml) | 400 ml | 600 ml | 800 ml |
| 20% emulsão lipídica (correspondente a 20 g/100 ml) | 200 ml | 300 ml | 400 ml |
Composição da emulsão pronta para uso, após a mistura do conteúdo das três câmaras:
| Componentes ativos | 1000 ml | 1500 ml | 2000 ml |
| Óleo de oliva purificado + óleo de soja purificado | 40,00 g | 60,00 g | 80,00 g |
| Alanina | 8,24 g | 12,36 g | 16,48 g |
| Arginina | 5,58 g | 8,37 g | 11,16 g |
| Ácido aspártico | 1,65 g | 2,47 g | 3,30 g |
| Ácido glutâmico | 2,84 g | 4,27 g | 5,69 g |
| Glicina | 3,95 g | 5,92 g | 7,90 g |
| Histidina | 3,40 g | 5,09 g | 6,79 g |
| Isoleucina | 2,84 g | 4,27 g | 5,69 g |
| Leucina | 3,95 g | 5,92 g | 7,90 g |
| Lisina (correspondente a acetato de lisina) | 4,48 g (6,32 g) | 6,72 g (9,48 g) | 8,96 g (12,64 g) |
| Metionina | 2,84 g | 4,27 g | 5,69 g |
| Fenilalanina | 3,95 g | 5,92 g | 7,9 g |
| Prolina | 3,40 g | 5,09 g | 6,79 g |
| Serina | 2,25 g | 3,37 g | 4,50 g |
| Treonina | 2,84 g | 4,27 g | 5,69 g |
| Triptofano | 0,95 g | 1,42 g | 1,90 g |
| Tirosina | 0,15 g | 0,22 g | 0,30 g |
| Valina | 3,64 g | 5,47 g | 7,29 g |
| Octanato de sódio tri-hidratado | 1,50 g | 2,24 g | 2,99 g |
| Glicerofosfato de sódio monoidratado | 3,67 g | 5,51 g | 7,34 g |
| Cloruro de potássio | 2,24 g | 3,35 g | 4,47 g |
| Cloruro de magnésio hexa-hidratado | 0,81 g | 1,22 g | 1,62 g |
| Cloruro de cálcio di-hidratado | 0,52 g | 0,77 g | 1,03 g |
| Glicose (correspondente a glicose monoidratada) | 110,00 g (121,00 g) | 165,00 g (181,50 g) | 220,00 g (242,00 g) |
Os componentes auxiliares são:
| Câmara com emulsão lipídica | Câmara com solução de aminoácidos com eletrólitos | Câmara com solução de glicose com cálcio |
| Fosfolipídios de ovo purificados, glicerol, oleato de sódio, hidróxido de sódio (para ajuste do pH), água para injeção | Ácido acético glacial (para ajuste do pH), água para injeção | Ácido clorídrico (para ajuste do pH), água para injeção |
Valores nutricionais da emulsão pronta para uso, de acordo com o tamanho do saco:
| 1000 ml | 1500 ml | 2000 ml | |
| Gorduras | 40 g | 60 g | 80 g |
| Aminoácidos | 56,9 g | 85,4 g | 113,9 g |
| Azoto | 9,0 g | 13,5 g | 18,0 g |
| Glicose | 110,0 g | 165,0 g | 220,0 g |
| Valor energético: Valor energético total aproximado Valor energético não proteico Valor energético da glicose Valor energético lipídico Relação: valor energético não proteico/azoto Relação: valor energético da glicose/lipídios Lipídios/valor energético total | 1070 kcal 840 kcal 440 kcal 400 kcal 93 kcal/g 52/48 37% | 1600 kcal 1260 kcal 660 kcal 600 kcal 93 kcal/g 52/48 37% | 2140 kcal 1680 kcal 880 kcal 800 kcal 93 kcal/g 52/48 37% |
| Eletrólitos: Sódio Potássio Magnésio Cálcio Fosfatos Acetatos Cloretos | 35,0 mmol 30,0 mmol 4,0 mmol 3,5 mmol 15,0 mmol 54 mmol 45 mmol | 52,5 mmol 45,0 mmol 6,0 mmol 5,3 mmol 22,5 mmol 80 mmol 68 mmol | 70,0 mmol 60,0 mmol 8,0 mmol 7,0 mmol 30,0 mmol 107 mmol 90 mmol |
| pH | 6,4 | 6,4 | 6,4 |
| Osmolalidade | 1310 mOsm/l | 1310 mOsm/l | 1310 mOsm/l |
B. DOSAGEM E MODO DE ADMINISTRAÇÃO
Dosagem
OLIMEL não é recomendado para uso em crianças com menos de 2 anos de idade, devido à composição e volume inadequados (ver pontos 4.4; 5.1 e 5.2 do RCP).
Não deve exceder a dosagem diária máxima indicada. Devido à composição constante do saco de múltiplas câmaras, pode não ser possível atender às necessidades nutricionais do paciente simultaneamente. Pode haver situações clínicas em que os pacientes precisem de quantidades diferentes de nutrientes do que as contidas no saco de composição constante. Nesse caso, qualquer alteração no volume (dose) deve levar em conta o efeito que isso terá na dosagem de todos os outros nutrientes do medicamento OLIMEL.
Adultos
A dosagem depende do gasto energético do paciente, do estado clínico, do peso corporal e da capacidade de metabolizar os componentes do medicamento OLIMEL, bem como dos nutrientes energéticos ou proteicos adicionais administrados por via oral/enteral; portanto, deve-se escolher o tamanho do saco apropriado.
A necessidade diária média é:
- 0,16 a 0,35 g de azoto/kg de peso corporal (1 a 2 g de aminoácidos/kg), dependendo do estado nutricional do paciente e do grau de catabolismo,
- 20 a 40 kcal/kg,
- 20 a 40 ml de líquido/kg ou 1 a 1,5 ml por kcal consumida. Para o medicamento OLIMEL, a dosagem diária máxima é determinada com base na ingestão de aminoácidos, 35 ml/kg corresponde a 2,0 g de aminoácidos/kg, 3,9 g de glicose/kg, 1,4 g de gordura/kg, 1,2 mmol de sódio/kg e 1,1 mmol de potássio/kg. Para um paciente de 70 kg, isso corresponderia a 2450 ml do medicamento OLIMEL por dia, o que significa a ingestão de 140 g de aminoácidos, 270 g de glicose e 98 g de gordura (ou seja, 2058 kcal não proteicas e 2622 kcal totais).
Geralmente, a velocidade de administração deve aumentar gradualmente durante a primeira hora e, em seguida, a velocidade da infusão deve ser ajustada com base na dose, no volume diário do medicamento administrado e no tempo de duração da infusão.
Para o medicamento OLIMEL, a velocidade máxima de infusão é de 1,8 ml/kg/h, o que corresponde a 0,10 g de aminoácidos/kg/h, 0,19 g de glicose/kg/h e 0,07 g de gordura/kg/h.
Crianças com mais de 2 anos de idade e adolescentes
Não foram realizados estudos nessa população pediátrica.
A dosagem depende do gasto energético do paciente, do estado clínico, do peso corporal e da capacidade de metabolizar os componentes do medicamento OLIMEL, bem como dos nutrientes energéticos ou proteicos adicionais administrados por via oral/enteral; portanto, deve-se escolher o tamanho do saco apropriado.
Além disso, a necessidade diária de líquidos, azoto e energia diminui constantemente com a idade. Foram considerados dois grupos, de 2 a 11 anos e de 12 a 18 anos.
Para o medicamento OLIMEL N9E, no grupo etário de 2 a 11 anos, o fator limitante para a dosagem diária é a concentração de magnésio. Nesse grupo etário, o fator limitante para a velocidade de administração por hora é a concentração de glicose. No grupo etário de 12 a 18 anos, os fatores limitantes para a dosagem diária são as concentrações de aminoácidos e magnésio. Nesse grupo etário, o fator limitante para a velocidade de administração por hora é a concentração de aminoácidos. Os valores resultantes são apresentados abaixo:
| Componente | 2 a 11 anos | 12 a 18 anos | ||
| Recomendado | Volume máximo de OLIMEL N9E | Recomendado | Volume máximo de OLIMEL N9E | |
| Dosagem diária máxima | ||||
| Líquidos (ml/kg/dia) |
| 25 |
| 35 |
| Aminoácidos (g/kg/dia) |
| 1,4 |
| 2,0 |
| Glicose (g/kg/dia) | 1,4 – 8,6 | 2,8 | 0,7 – 5,8 | 3,9 |
| Gordura (g/kg/dia) | 0,5 - 3 | 1,0 | 0,5 - 2 (até 3) | 1,4 |
| Valor energético total (kcal/kg/dia) |
| 26,8 |
| 37,5 |
| Velocidade máxima de administração por hora | ||||
| OLIMEL N9E (ml/kg/h) | 3,3 | 2,1 | ||
| Aminoácidos (g/kg/h) | 0,20 | 0,19 | 0,12 | 0,12 |
| Glicose (g/kg/h) | 0,36 | 0,36 | 0,24 | 0,23 |
| Gordura (g/kg/h) | 0,13 | 0,13 | 0,13 | 0,08 |
Geralmente, a velocidade de administração deve aumentar gradualmente durante a primeira hora e, em seguida, a velocidade da infusão deve ser ajustada com base na dose, no volume diário do medicamento administrado e no tempo de duração da infusão.
Em geral, em crianças pequenas, é recomendável iniciar a infusão com uma dose diária baixa e aumentá-la gradualmente até a dosagem máxima (ver acima).
Modo de administração
Para uso único.
Recomenda-se que, após a abertura, o conteúdo do saco seja utilizado imediatamente e não seja armazenado para uma infusão posterior.
Após a mistura, a emulsão pronta para uso tem a forma de uma mistura homogênea com aparência leitosa.
As instruções para a preparação e administração da emulsão para infusão estão no ponto 6.6 do RCP.
Devido à alta osmolalidade do OLIMEL, ele só pode ser administrado em uma veia central.
O tempo de duração da infusão recomendado para o saco de nutrição parenteral é de 12 a 24 horas.
O tratamento com nutrição parenteral pode ser continuado por tanto tempo quanto necessário, dependendo do estado clínico do paciente.
C. INCOMPATIBILIDADES FARMACÊUTICAS
Não deve adicionar nenhum medicamento ou substância a nenhum dos componentes do saco ou à emulsão pronta para uso sem antes confirmar a compatibilidade e a estabilidade do produto resultante (especialmente a estabilidade da emulsão lipídica).
Incompatibilidades podem resultar, por exemplo, de uma acidez excessiva (pH baixo) ou de uma concentração inadequada de cátions divalentes (Ca e Mg), que podem desestabilizar a emulsão lipídica.
Assim como na preparação de outras misturas para nutrição parenteral, deve-se considerar a relação entre a concentração de cálcio e fosfatos. O excesso de cálcio e fosfato, especialmente na forma de sais inorgânicos, pode causar a formação de depósitos de fosfato de cálcio.
OLIMEL contém íons de cálcio, o que aumenta o risco de formação de coágulos em preparações de sangue ou componentes sanguíneos com citrato como anticoagulante/conservante.
Não deve misturar ou administrar ceftriaxon concomitantemente com soluções para infusão que contenham cálcio, incluindo o medicamento OLIMEL, pela mesma linha de infusão (por exemplo, por um conector em forma de Y) devido ao risco de formação de sais de cálcio da ceftriaxon (ver pontos 4.4 e 4.5 do RCP). A ceftriaxon e as soluções que contenham cálcio podem ser administradas sequencialmente, se as linhas de infusão forem inseridas em locais diferentes ou forem trocadas ou lavadas cuidadosamente com solução salina fisiológica entre as infusões, para evitar a formação de depósitos.
Devido ao risco de formação de depósitos, o medicamento OLIMEL não deve ser administrado pela mesma linha de infusão ou adicionado à amplicilina (antibiótico) ou fosfenitoína (medicamento anticonvulsivante).
Deve verificar a compatibilidade com as soluções administradas concomitantemente pela mesma linha de infusão, cateter ou canula.
Devido ao risco de pseudoaglutinação, não deve administrar este medicamento antes, durante ou após a administração de sangue pela mesma linha de infusão.
D. PRECAUÇÕES ESPECIAIS PARA ELIMINAÇÃO E PREPARO DO MEDICAMENTO PARA USO
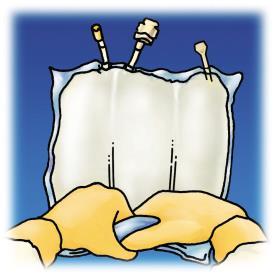
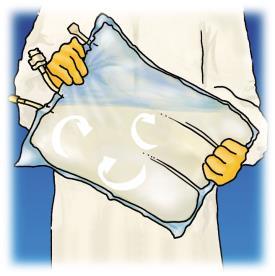
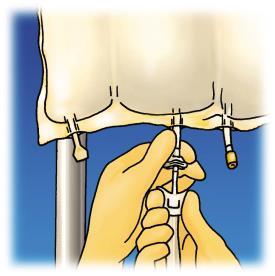
Revisão dos estágios de preparação do OLIMEL para administração está apresentada na Figura 1.
Abertura
Remover o saco protetor.
Descartar o sachê que absorve oxigênio.
Certificar-se de que o saco ou os selos não estão danificados. Use apenas se o saco estiver intacto e os selos não estiverem rompidos (ou seja, o conteúdo das 3 câmaras não foi misturado), as soluções de aminoácidos e glicose são claras, incolores ou ligeiramente amareladas, praticamente livres de partículas visíveis e a emulsão lipídica é homogênea com aparência leitosa.
Mistura das soluções e emulsões
Antes de romper os selos, certifique-se de que o medicamento está à temperatura ambiente.
Inicie a partir da parte superior do saco (perto da alça), role o saco com as duas mãos. Os selos serão rompidos a partir da extremidade dos portos. Continue rolando o saco até que os selos sejam rompidos até metade de sua extensão.
Misture, girando o saco pelo menos 3 vezes.
Após a mistura, o medicamento tem a forma de uma emulsão homogênea com aparência leitosa.
Aditivos
O volume do saco é suficiente para permitir a adição de vitaminas, eletrólitos e minerais traços.
Qualquer aditivo (incluindo vitaminas) deve ser introduzido na emulsão pronta para uso (após a ruptura dos selos e após a mistura do conteúdo das 3 câmaras).
As vitaminas também podem ser adicionadas à câmara que contém glicose antes da preparação da emulsão pronta para uso (antes da ruptura dos selos e antes da mistura do conteúdo das 3 câmaras).
Ao introduzir aditivos nos produtos que contenham eletrólitos, deve-se considerar a quantidade de eletrólitos já presentes no saco.
Os aditivos devem ser introduzidos por pessoal qualificado em condições assépticas.
Para o medicamento OLIMEL, os eletrólitos podem ser adicionados de acordo com a tabela abaixo:
Minerais traços e vitaminas:
Foi demonstrada a estabilidade após a adição de produtos de vitaminas e minerais traços disponíveis no mercado (contendo até 1 mg de ferro).
A compatibilidade com outros aditivos está disponível a pedido.
Ao introduzir aditivos, deve:
- controlar as condições de assepsia,
- preparar o local de injeção no saco,
- perfurar o local de injeção e injetar os aditivos com uma agulha para injeção ou dispositivo para preparo do medicamento,
- misturar o conteúdo do saco com os aditivos.
2. 3.



5. 6.
Administração
Apenas para uso único.
Administrar o produto apenas após quebrar as soldas que separam as 3 câmaras e misturar seu conteúdo.
Deve-se garantir que na emulsão pronta para infusão não ocorra separação de fases.
Após a abertura do saco, o conteúdo deve ser utilizado imediatamente. Não é permitido armazenar
o saco aberto para a próxima infusão. Não conectar novamente sacos parcialmente usados.
Para evitar a possibilidade de formação de embolias aéreas, causadas pela presença de gás
contido no primeiro saco, não conectar sacos em série.
Qualquer resíduo do produto não utilizado ou seus resíduos, bem como todo o conjunto de infusão, deve ser
destruído.
Extravasamento
O local de inserção do cateter deve ser monitorado regularmente para sinais de extravasamento.
Em caso de extravasamento, a administração do preparado deve ser interrompida imediatamente, deixando o cateter ou a cânula no local para iniciar imediatamente o procedimento terapêutico. Se possível, antes de remover o cateter/cânula, deve-se realizar uma aspiração do líquido através do cateter/cânula para reduzir a quantidade de líquido nos tecidos.
Dependendo do tipo de produto extravasado (incluindo o produto(s) misturado(s) com o produto OLIMEL, se aplicável) e do grau/extentão do possível dano, devem ser tomadas medidas terapêuticas apropriadas. As opções de tratamento podem incluir tratamento não farmacológico, farmacológico e (ou) intervenção cirúrgica. Em caso de grande extravasamento, deve-se consultar um cirurgião plástico dentro de 72 horas.
O local de extravasamento deve ser monitorado a cada quatro horas durante as primeiras 24 horas e, em seguida, uma vez por dia.
Não deve ser reiniciada a infusão na mesma veia central.
Baxter e Olimel são marcas registradas da Baxter International Inc.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBaxter S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Olimel N9eForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Olimel N9e noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Olimel N9e em Spain
Alternativa a Olimel N9e em Ukraine
Médicos online para Olimel N9e
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Olimel N9e – sujeita a avaliação médica e regras locais.














