
Numeta G16%e

Pergunte a um médico sobre a prescrição de Numeta G16%e

Como usar Numeta G16%e
Folheto informativo para o utilizador
NUMETA G16%E, emulsão para infusão
Deve ler atentamente o conteúdo do folheto antes de administrar o medicamento, pois contém
informações importantes para o doente.
- Deve conservar este folheto para o poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico do seu filho, farmacêutico ou enfermeira.
- Se o seu filho apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico responsável ou a enfermeira. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento NUMETA G16%E e para que é utilizado
- 2. Informações importantes antes de administrar o medicamento NUMETA G16%E ao seu filho
- 3. Como administrar o medicamento NUMETA G16%E
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento NUMETA G16%E
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento NUMETA G16%E e para que é utilizado
O medicamento NUMETA G16%E é uma emulsão especializada para nutrição, destinada a recém-nascidos a termo e crianças até 2 anos de idade. É administrado através de um tubo inserido na veia da criança, quando a criança não pode ingerir todos os nutrientes por via oral.
O medicamento NUMETA G16%E é apresentado em um saco tricamarado, onde cada câmara contém: solução de glicose a 50%; solução pediátrica de aminoácidos com eletrólitos a 5,9%; emulsão lipídica a 12,5%. Dependendo das necessidades da criança, dois ou três desses solutos são misturados no saco antes da administração à criança.
O medicamento NUMETA G16%E só deve ser utilizado sob controle médico.
2. Informações importantes antes de administrar o medicamento NUMETA G16%E ao seu filho
Quando o medicamento NUMETA G16%E não deve ser administrado à criança:
Em caso de 2 solutos misturados no saco ("2 em 1"):
- se a criança tiver alergia a proteínas de ovo, soja, amendoins ou a qualquer um dos componentes contidos na câmara com glicose ou aminoácidos (listados no ponto 6);
- se o organismo da criança não puder utilizar os componentes de construção das proteínas;
- se a criança tiver níveis elevados de eletrólitos presentes no medicamento NUMETA G16%E no sangue;
- no caso de recém-nascidos (≤28 dias de vida), o medicamento NUMETA G16%E (ou outras soluções contendo cálcio) não deve ser administrado simultaneamente com ceftriaxona (antibiótico), mesmo que sejam utilizadas linhas de infusão separadas. Existe o risco de formação de partículas no sangue do recém-nascido, que podem levar à morte.
- se a criança tiver hiperglicemia (nível de açúcar no sangue muito elevado).
Em caso de 3 solutos misturados no saco ("3 em 1"):
- em todos os casos mencionados acima para o medicamento "2 em 1" e, além disso:
- se a criança tiver níveis muito elevados de lipídios no sangue.
Em todos os casos, o médico decide sobre a administração do medicamento, considerando a idade, o peso e o estado clínico da criança. O médico também levará em conta os resultados de todos os exames realizados.
Precauções e advertências
Antes de iniciar a administração do medicamento NUMETA G16%E, deve discutir com o médico responsável ou a enfermeira.
Em caso de administração a recém-nascidos e crianças abaixo de 2 anos, a solução (nos sacos e conjuntos de administração) deve ser protegida da luz até o final da administração. A exposição do medicamento NUMETA G16%E à luz ambiente, especialmente após a mistura com oligoelementos e/ou vitaminas, pode causar a formação de peróxidos e outros produtos de degradação, o que pode ser minimizado protegendo da luz.
Reações alérgicas:
Se ocorrerem sinais ou sintomas de reação alérgica (como febre, suor, calafrios, dor de cabeça, erupções cutâneas ou dificuldades respiratórias), a infusão deve ser interrompida imediatamente.
Este medicamento contém óleo de soja, que pode causar reações de sensibilidade em casos raros. Em algumas pessoas alérgicas a proteínas de amendoim, também foi observada alergia a proteínas de soja.
O medicamento NUMETA G16%E contém glicose produzida a partir de amido de milho. Portanto, o medicamento NUMETA G16%E deve ser utilizado com cautela em pacientes com alergia conhecida ao milho ou produtos que contenham milho.
Risco de formação de sedimentos com ceftriaxona (antibiótico):
O antibiótico ceftriaxona não deve ser misturado ou administrado simultaneamente com qualquer solução contendo cálcio (incluindo o medicamento NUMETA G16%E) por via intravenosa.
O médico está ciente disso e não administrará esses medicamentos ao paciente simultaneamente, mesmo que por linhas de infusão ou locais de infusão diferentes.
No entanto, o médico pode administrar cálcio e ceftriaxona sequencialmente, um após o outro, se as linhas de infusão forem inseridas em locais diferentes ou forem trocadas ou lavadas cuidadosamente com solução salina fisiológica entre as infusões, para evitar a formação de sedimentos.
Formação de pequenas partículas nos vasos sanguíneos nos pulmões:
Dificuldades respiratórias também podem ser um sinal de que pequenas partículas bloquearam os vasos sanguíneos nos pulmões (sedimentos nos vasos pulmonares). Se a criança apresentar dificuldades respiratórias, deve informar o médico ou a enfermeira. Eles decidirão sobre as medidas apropriadas.
Infecção e septicemia:
O médico estará atento para detectar sinais de infecção. A observância das normas de assepsia (procedimentos que protegem contra microorganismos) ao inserir e manter o cateter, bem como ao preparar a mistura nutricional, pode reduzir o risco de infecção.
Às vezes, se um tubo estiver inserido na veia (cateter venoso), a criança pode desenvolver infecção e septicemia (presença de bactérias no sangue). Alguns medicamentos e doenças podem aumentar o risco de infecção ou septicemia. Pacientes que necessitam de nutrição parenteral (alimentação por meio de um tubo inserido na veia) devido ao seu estado de saúde podem estar mais propensos a desenvolver infecção.
Síndrome de sobrecarga lipídica:
Durante o uso de medicamentos semelhantes, foi relatada a ocorrência de síndrome de sobrecarga lipídica.
A capacidade reduzida ou limitada do organismo de eliminar os lipídios contidos no medicamento NUMETA G16%E ou a sobredose pode resultar na chamada síndrome de sobrecarga lipídica (ver pontos 3 e 4).
Alterações nos níveis de substâncias químicas no sangue:
O médico monitorará e seguirá o estado dos fluidos da criança, a composição química do sangue e os níveis de outras substâncias, pois a nutrição de pessoas gravemente desnutridas pode causar alterações na composição química do sangue. Também pode ocorrer acúmulo de fluidos nos tecidos e inchaço. Recomenda-se iniciar a nutrição parenteral de forma lenta e cuidadosa.
Níveis elevados de magnésio no sangue:
A quantidade de magnésio presente no produto NUMETA G16%E pode causar níveis elevados de magnésio no sangue. Nesse caso, podem ocorrer sintomas como fraqueza, reflexos lentos, náuseas, vômitos, níveis baixos de cálcio no sangue, problemas respiratórios, pressão arterial baixa e batimentos cardíacos irregulares. Os sintomas podem ser difíceis de detectar, por isso o médico pode monitorar os níveis de magnésio no sangue da criança, especialmente em casos de crianças com fatores de risco para níveis elevados de magnésio no sangue, como disfunção renal. Se os níveis de magnésio no sangue estiverem elevados, a infusão será interrompida ou a velocidade de administração do medicamento será reduzida.
Monitorização e ajuste:
O médico estará atento e ajustará a administração do medicamento NUMETA de acordo com as necessidades individuais da criança nas seguintes situações:
- condições graves pós-traumáticas;
- diabetes grave;
- choque;
- ataque cardíaco;
- infecção grave;
- certos tipos de coma.
Uso com cautela:
O medicamento NUMETA deve ser utilizado com cautela se a criança tiver:
- edema pulmonar (fluidos nos pulmões) ou insuficiência cardíaca;
- disfunção hepática grave;
- distúrbios de absorção de nutrientes;
- níveis elevados de açúcar no sangue;
- doenças renais;
- distúrbios graves do metabolismo (quando o processo de decomposição de substâncias não ocorre normalmente);
- distúrbios de coagulação do sangue.
Será realizado um controle rigoroso do volume de fluidos no organismo da criança, dos resultados dos exames hepáticos e (ou) do sangue.
Interacções com outros medicamentos
Deve informar o médico sobre todos os medicamentos que a criança está tomando atualmente ou recentemente, bem como sobre medicamentos que a criança irá tomar.
O medicamento NUMETA não deve ser administrado ao mesmo tempo que:
- ceftriaxona(antibiótico), mesmo por linhas de infusão separadas, devido ao risco de formação de partículas sólidas;
- sanguepelo mesmo conjunto de infusão, devido ao risco de pseudoaglutinação (glóbulos vermelhos grudam uns nos outros);
- ampicilina, fosfenitoína ou furosemidapela mesma linha de infusão, devido ao risco de formação de partículas sólidas.
Anticoagulantes (cumatrina e varfarina):
O médico estará atento se a criança estiver tomando cumatrina ou varfarina.
A vitamina K1 é um componente natural do óleo e do óleo de soja. A vitamina K1 pode interagir com medicamentos como cumatrina e varfarina. Esses medicamentos são anticoagulantes utilizados para prevenir a coagulação do sangue.
Exames laboratoriais:
Os lipídios presentes nesta emulsão podem afetar os resultados de certos exames laboratoriais.
Os exames laboratoriais devem ser realizados após 5 a 6 horas da última administração de lipídios.
Interacções do medicamento NUMETA G16%E com medicamentos que podem afetar os níveis de potássio/metabolismo:
O medicamento NUMETA contém potássio. Níveis elevados de potássio no sangue podem causar ritmo cardíaco anormal. Deve haver cuidado especial com pacientes que tomam diuréticos (medicamentos que visam reduzir a retenção de fluidos) ou inibidores da ECA (medicamentos utilizados para hipertensão) ou antagonistas do receptor de angiotensina II (medicamentos utilizados para hipertensão) ou imunossupressores (medicamentos que podem reduzir a resposta imunológica normal do organismo). Medicamentos desse tipo podem aumentar os níveis de potássio.
3. Como administrar o medicamento NUMETA G16%E
O medicamento NUMETA G16%E deve ser sempre administrado à criança de acordo com as recomendações do médico. Em caso de dúvidas, deve consultar o médico.
Grupo etário
O medicamento NUMETA G16%E foi projetado para atender às necessidades nutricionais de recém-nascidos a termo e crianças até 2 anos de idade.
O médico da criança decidirá se este medicamento é adequado para ela.
Administração
Este medicamento é uma emulsão para infusão. É administrado através de um tubo plástico inserido na veia do braço ou na veia grande do tórax da criança.
O médico pode decidir não administrar lipídios à criança. O saco do medicamento NUMETA G16%E é projetado de forma que, se necessário, as divisórias entre a câmara com aminoácidos/eletrolitos e a câmara com glicose podem ser rompidas. Nesse caso, a divisória entre a câmara com aminoácidos e a câmara com lipídios permanece intacta. Dessa forma, o conteúdo do saco pode ser administrado sem lipídios.
Em caso de administração a recém-nascidos e crianças abaixo de 2 anos, a solução (nos sacos e conjuntos de administração) deve ser protegida da luz até o final da administração (ver ponto 2).
Dose e duração do tratamento
O médico decidirá sobre a dose do medicamento e por quanto tempo ele será administrado. A dose depende das necessidades nutricionais da criança. A dose será estabelecida com base no peso da criança, no estado clínico e na capacidade do organismo da criança de decompor e utilizar os componentes do medicamento NUMETA G16%E. Outros nutrientes ou proteínas administrados por via oral ou enteral também podem ser administrados.
Administração de dose maior do que a recomendada do medicamento NUMETA G16%E à criança
Sintomas
Uma dose excessiva do medicamento ou administração muito rápida pode causar:
- náuseas (enjoo);
- vômitos;
- convulsões;
- distúrbios eletrolíticos (níveis anormais de eletrólitos no sangue);
- sintomas de hiperolemia (volume aumentado de sangue circulante);
- acidose (aumento da acidez do sangue).
Nessas situações, a infusão deve ser interrompida imediatamente. O médico decidirá se medidas adicionais são necessárias.
A sobredose de lipídios contidos no medicamento NUMETA G16%E pode levar à ocorrência de "síndrome de sobrecarga lipídica", que geralmente regride após a interrupção da infusão. Em recém-nascidos (lactentes) e crianças pequenas (crianças abaixo de 2 anos), a síndrome de sobrecarga lipídica está relacionada a distúrbios respiratórios que levam à redução da quantidade de oxigênio no organismo (insuficiência respiratória) e condições que levam ao aumento da acidez do sangue (acidose).
Para evitar tais situações, o médico realizará controles regulares do estado da criança e realizará exames de sangue durante o tratamento.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não em todas as crianças.
Em caso de alterações no bem-estar da criança durante o tratamento ou após a sua interrupção, deve informar o médico ou a enfermeira imediatamente.
Os exames realizados pelo médico durante a administração do medicamento à criança devem minimizar o risco de efeitos secundários.
Se ocorrerem sintomas de reação alérgica, a infusão deve ser interrompida e deve-se consultar o médico imediatamente. Pode ser um efeito secundário grave, e os sintomas podem incluir:
- suor;
- calafrios;
- dor de cabeça;
- erupções cutâneas;
- dificuldades respiratórias.
Outros efeitos secundários observados:
Comuns: podem afetar 1 em cada 10 pessoas
- baixo nível de fosfatos no sangue (hipofosfatemia);
- nível elevado de açúcar no sangue (hiperglicemia);
- nível elevado de cálcio no sangue (hipercalcemia);
- nível elevado de triglicérides no sangue (hipertrigliceridemia);
- distúrbios eletrolíticos (hiponatremia).
Menos comuns: podem afetar 1 em cada 100 pessoas
- nível elevado de lipídios no sangue (hiperlipidemia);
- condição em que a bile não pode fluir do fígado para o duodeno (colestase). O duodeno é uma parte do intestino.
Frequência desconhecida: a frequência não pode ser estimada com base nos dados disponíveis(Esses efeitos secundários foram relatados apenas após a administração do medicamento NUMETA G13%E Preterm e NUMETA G16%E com diluição inadequada).
- nekrose da pele;
- lesões nos tecidos moles;
- extravasamento.
Os seguintes efeitos secundários foram relatados para outros medicamentos de nutrição parenteral:
A capacidade reduzida ou limitada de eliminar os lipídios contidos no medicamento NUMETA pode levar à ocorrência de síndrome de sobrecarga lipídica. Os seguintes sinais e sintomas dessa síndrome geralmente regridem após a interrupção da infusão da emulsão lipídica:
- piora súbita e grave do estado clínico do paciente;
- nível elevado de lipídios no sangue (hiperlipidemia);
- febre;
- esteatose hepática (acúmulo de gordura no fígado);
- disfunção hepática;
- redução do número de glóbulos vermelhos, que pode causar palidez e fraqueza ou falta de ar (anemia);
- redução do número de glóbulos brancos, que pode aumentar o risco de infecção (leucopenia);
- redução do número de plaquetas, que pode aumentar o risco de hematomas e (ou) sangramentos (trombocitopenia);
- distúrbios de coagulação do sangue, que afetam a capacidade do sangue de formar coágulos;
- distúrbios respiratórios que levam à redução da quantidade de oxigênio no organismo (insuficiência respiratória);
- condições que levam ao aumento da acidez do sangue (acidose);
- coma que exige hospitalização.
A formação de pequenas partículas que podem bloquear os vasos sanguíneos nos pulmões (sedimentos nos vasos pulmonares) ou dificuldades respiratórias.
Notificação de efeitos secundários
Se a criança apresentar qualquer efeito secundário, deve consultar o médico responsável ou a enfermeira. Isso inclui qualquer efeito secundário não mencionado neste folheto.
Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181 C
PL 02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Site: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento NUMETA G16%E
O medicamento deve ser conservado em local não visível e inacessível às crianças quando não estiver sendo administrado.
Em caso de administração a recém-nascidos e crianças abaixo de 2 anos, a solução (nos sacos e conjuntos de administração) deve ser protegida da luz até o final da administração (ver ponto 2).
Não deve ser utilizado após a data de validade impressa no saco e no pacote exterior (MM/RRRR). A data de validade é o último dia do mês indicado.
Não congelar.
Conservar no saco de proteção.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Esse procedimento ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
Como é o medicamento NUMETA G16%E e o que o pacote contém
O medicamento NUMETA é apresentado em um saco tricamarado. O conteúdo de cada saco é estéril e consiste em solução de glicose, solução de aminoácidos para crianças com eletrólitos e emulsão lipídica, de acordo com a descrição abaixo.
| Tamanho do recipiente | 50% solução de glicose | 5,9% solução de aminoácidos com eletrólitos | 12,5% emulsão lipídica |
| 500 ml | 155 ml | 221 ml | 124 ml |
Aspecto antes da preparação:
- As soluções nas câmaras que contêm aminoácidos e glicose são transparentes, incolores ou ligeiramente amareladas
- A câmara com emulsão lipídica é um líquido homogêneo e leitoso
Aspecto após a preparação:
- As soluções para infusão "2 em 1" são transparentes, incolores ou ligeiramente amareladas
- A emulsão para infusão "3 em 1" é homogênea e leitosa
O saco tricamarado é um saco plástico multicamada.
Para proteger contra o contato com o ar, o saco NUMETA é embalado em um saco de proteção que contém um absorvedor de oxigênio e um indicador de oxigênio.
Tamanhos dos pacotes
Sacos de 500 ml: 6 sacos em uma caixa de papelão
1 saco de 500 ml
Nem todos os tipos de embalagens precisam estar disponíveis no mercado.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Varsóvia
Fabricante
Baxter S.A.
Boulevard Rene Branquart 80
7860 Lessines
Bélgica
Este medicamento está autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes:
| Áustria Alemanha | Numeta G 16 % E Emulsão para infusão |
| Bélgica Luxemburgo | NUMETZAH G16%E, emulsão para perfusão |
| França | NUMETAH G16 %E, emulsão para perfusão |
| Dinamarca Noruega Suécia | Numeta G16E |
| República Tcheca Grécia | NUMETA G 16 % E |
| Países Baixos | NUMETA G16%E emulsão para infusão |
| Irlanda Reino Unido | Numeta G16%E, emulsão para infusão |
| Itália | NUMETA G16%E emulsão para infusão |
| Finlândia | Numeta G16E infusão, emulsão |
| Polônia | NUMETA G16%E |
| Portugal | Numeta G16%E |
| Espanha | NUMETA G16%E, emulsão para perfusão |
Data da última atualização do folheto: Maio 2024
Informações destinadas exclusivamente ao pessoal médico ou profissionais de saúde
*Em alguns casos, este medicamento pode ser administrado em casa por pais ou outros cuidadores.
Nesses casos, os pais/cuidadores devem ler as informações abaixo.
Não deve ser adicionado nenhum componente extra ao saco sem verificar a compatibilidade antes.
Isso pode causar a formação de partículas sólidas ou a desestabilização da emulsão lipídica. Isso pode levar à obstrução das veias.
O medicamento NUMETA G16%E deve atingir a temperatura ambiente antes da administração.
Antes da administração do medicamento NUMETA G16%E, o saco deve ser preparado como mostrado abaixo.
Deve-se verificar se o saco não está danificado. O saco só pode ser utilizado se não estiver danificado. Abaixo estão listadas as características de um saco não danificado:
- As divisórias estão intactas. Isso é indicado pela falta de mistura do conteúdo de qualquer uma das três câmaras.
- As soluções que contêm aminoácidos e glicose são transparentes, incolores ou ligeiramente amareladas, sem partículas visíveis.
- A emulsão lipídica é um líquido homogêneo com aspecto leitoso.
Antes de abrir o saco de proteção, deve-se verificar a cor do absorvedor de oxigênio.
- Deve-se compará-la com a cor de referência impressa ao lado do símbolo OK e mostrada na área impressa do indicador.
- Não deve ser utilizado o medicamento se a cor do indicador de oxigênio não corresponder à cor de referência impressa ao lado do símbolo OK.
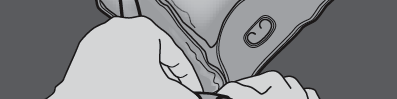
Figuras 1 e 2 mostram como remover o saco de proteção. Descartar o saco de proteção, o indicador de oxigênio e o absorvedor de oxigênio.









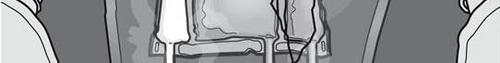
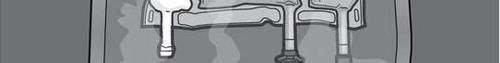
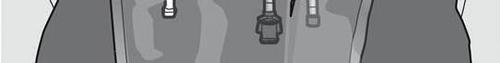




Figura 1
Figura 2
Preparação da emulsão misturada:
- Antes de romper as soldas, verificar se o medicamento está à temperatura ambiente.
- Colocar o saco em uma superfície plana e limpa.
Ativação do saco tricamarado (mistura de 3 solutos abrindo as 2 soldas separáveis)
Passo 1: Iniciar o enrolamento do saco a partir do lado do gancho.
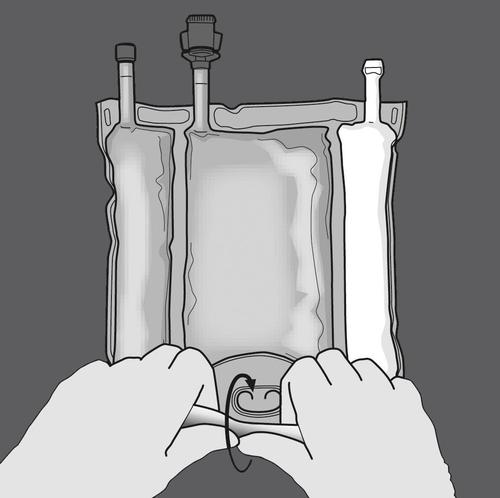
Passo 2: Pressionar até que as soldas se abram.
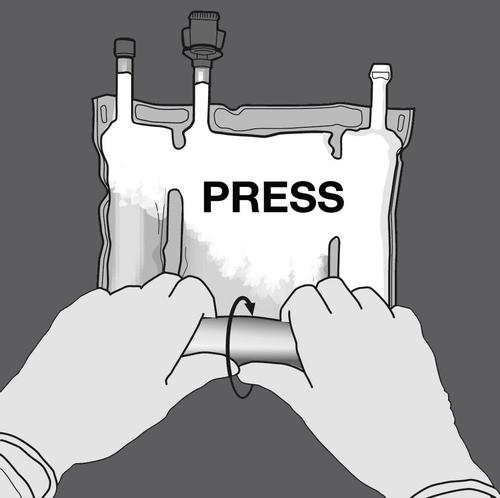
PRESSIONAR
Passo 3: Alterar a direção, enrolando o saco em direção ao gancho.
Continuar até que a solda se abra completamente.
Proceder da mesma forma até que a segunda solda se abra completamente.
PRESSIONAR
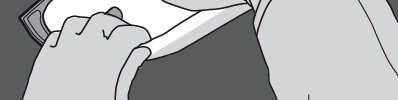

Passo 4: Girar o saco pelo menos três vezes para misturar completamente o conteúdo.
A solução misturada deve ter um aspecto leitoso.

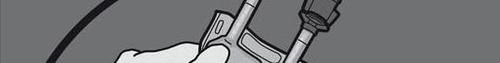






Passo 5: Remover a tampa de proteção do local de administração do medicamento e conectar o conjunto de administração intravenosa.








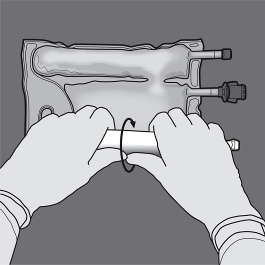
Ativação do saco bicamarado (mistura de 2 solutos abrindo a solda separável entre as câmaras que contêm aminoácidos e glicose)
Passo 1: Para misturar apenas 2 solutos, enrolar o saco, começando do canto superior (com o gancho) ao lado da solda que separa os solutos.
Pressionar para abrir a solda que separa as câmaras com glicose e aminoácidos.
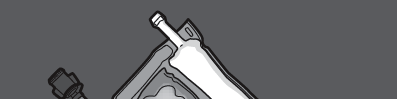
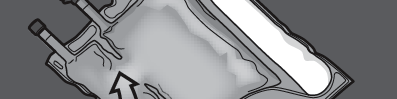
PRESSIONAR

Passo 2: Colocar o saco de forma que a câmara com emulsão lipídica fique mais próxima do usuário.
Enrolar o saco, protegendo a câmara com emulsão lipídica com as mãos.
Passo 3: Pressionar com uma mão e enrolar o saco em direção às tubulações.

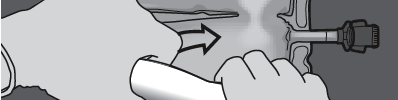
PRESSIONAR


Passo 4: Alterar a direção, enrolando o saco em direção ao canto superior (com o gancho).
Pressionar com a segunda mão até que a solda que separa as câmaras com aminoácidos e glicose se abra completamente.

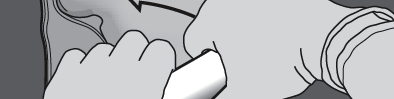
PREPARAÇÃO


Passo 5: Girar o saco pelo menos três vezes para misturar completamente o conteúdo.
A solução misturada deve ser transparente, incolor ou ligeiramente amarela.







Passo 6: Remover a tampa protetora do local de administração do medicamento e introduzir o conjunto de administração intravenosa.
Dentro da primeira hora, a velocidade de fluxo deve ser aumentada gradualmente. A velocidade de fluxo de administração deve ser ajustada com base nos seguintes fatores:








- dose administrada
- volume diário administrado
- tempo de duração da infusão.
Método de administração:
Em caso de uso em recém-nascidos e crianças abaixo de 2 anos, a solução (em sacos e conjuntos de administração) deve ser protegida da luz até o final da administração.
Recomenda-se o uso de um filtro de 1,2 micrômetro para a administração do medicamento NUMETA G16%E.
Devido à alta osmolalidade, o medicamento NUMETA G16%E não diluído pode ser administrado apenas por via central. A diluição adequada do medicamento NUMETA G16%E com água para injeção reduz a osmolalidade e permite a infusão em um vaso periférico.
A fórmula abaixo apresenta o efeito da diluição na osmolalidade do medicamento.
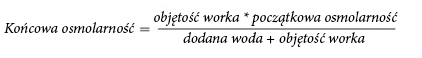
Na tabela abaixo, são apresentados exemplos de osmolalidade de sacos de duas e três câmaras ativados após a adição de água para injeção:
| Aminocidos e glicose (W2K ativado) | Aminocidos, glicose e lipídios (W3K ativado) | |
| Volume inicial no saco (ml) | 376 | 500 |
| Osmolalidade inicial (mOsm/l aproximadamente) | 1585 | 1230 |
| Volume de água adicionada (ml) | 376 | 500 |
| Volume final após adição (ml) | 752 | 1000 |
| Osmolalidade após adição (mOsm/l aproximadamente) | 792,5 | 615 |
Introdução de componentes adicionais:
A exposição à luz de soluções para nutrição parenteral, especialmente após a mistura com traços de minerais e (ou) vitaminas, pode ter um efeito adverso nos resultados clínicos em recém-nascidos, devido à formação de peróxidos e outros produtos de degradação. Em caso de uso em recém-nascidos e crianças abaixo de 2 anos, o medicamento NUMETA G16%E deve ser protegido da luz ambiente até o final da administração.
Componentes adicionais compatíveis podem ser adicionados à mistura reconstituída através do local de injeção (após a abertura das soldas rompíveis e após a mistura do conteúdo de duas ou três câmaras).
Vitaminas também podem ser adicionadas à câmara que contém glicose antes da reconstituição da mistura (antes da abertura das soldas rompíveis e antes da mistura das soluções e emulsões).
São apresentados abaixo exemplos de aditivos de soluções de minerais traços prontas (identificados como TE1, TE2 e TE4), vitaminas (identificados como liofilizado V1 e emulsão V2) e eletrólitos em quantidades específicas antes da reconstituição:
- 1.Compatibilidade com TE4, V1 e V2
Tabela 1: Compatibilidade 3-em-1 (W3K ativado) com diluição em água e sem diluição
| Para 500 ml (após a mistura de 3 câmaras, com lipídios) | ||||||
| Aditivo sem diluição | Aditivo com diluição | |||||
| Componentes adicionais | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total |
| Sódio (mmol) | 12,0 | 25,6 | 37,6 | 12,0 | 25,6 | 37,6 |
| Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
| Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
| Cálcio (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
| Fosfatos* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
| Minerais traços e vitaminas | 10 ml TE4 + 1 frasco V1 + 30 ml V2 | 10 ml TE4 + 1 frasco V1 + 30 ml V2 | 5 mL TE4 + ½ frasco V1 + 5 mL V2 | 5 ml TE4 + ½ frasco V1 + 5 ml V2 | ||
| Água para injeção | 350 ml | 350 ml | ||||
Tabela 2: Compatibilidade 2-em-1 (W2K ativado) com diluição em água e sem diluição
| Para 376 ml (após a mistura de 2 câmaras, sem lipídios) | ||||||
| Aditivo sem diluição | Aditivo com diluição | |||||
| Componentes adicionais | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total |
| Sódio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Cálcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 3,2 |
| 11,3 | 3,2 | 0,0 | 3,2 |
| Minerais traços e vitaminas | 5ml TE4 + ½ frasco V1 | 5ml TE4 + ½ frasco V1 | 5ml TE4 + ½ frasco V1 | 5ml TE4 + ½ frasco V1 | ||
| Água para injeção | 450 ml | 450 ml | ||||
- 2.Compatibilidade com TE1, V1 e V2Tabela 3: Compatibilidade 3-em-1 (W3K ativado) com diluição em água e sem diluição
| Para 500 ml (após a mistura de 3 câmaras, com lipídios) | ||||||
| Aditivo sem diluição | Aditivo com diluição | |||||
| Componentes adicionais | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total |
| Sódio (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Potássio (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnésio (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Cálcio (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Minerais traços e vitaminas | 5 ml TE1 + ½ frasco V1 + 5 ml V2 | 5 ml TE1 + ½ frasco V1 + 5 ml V2 | 5 ml TE1 + ½ frasco V1 + 5 ml V2 | 5 ml TE1 + ½ frasco V1 + 5 ml V2 | ||
| Água para injeção | 350 ml | 350 ml | ||||
Tabela 4: Compatibilidade 2-em-1 (W2K ativado) com diluição em água e sem diluição
| Para 376 ml (após a mistura de 2 câmaras, sem lipídios) | ||||||
| Aditivo sem diluição | Aditivo com diluição | |||||
| Componentes adicionais | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total |
| Sódio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Cálcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Minerais traços e vitaminas | 5 ml TE1 + ½ frasco V1 | 5 ml TE1 + ½ frasco V1 | 5 ml TE1 + ½ frasco V1 | 5 ml TE1 + ½ frasco V1 | ||
| Água para injeção | 450 ml | 450 ml | ||||
- 3.Compatibilidade com TE2, V1 e V2Tabela 5: Compatibilidade 3-em-1 (W3K ativado) com diluição em água e sem diluição
| Para 500 ml (após a mistura de 3 câmaras, com lipídios) | ||||||
| Aditivo sem diluição | Aditivo com diluição | |||||
| Componentes adicionais | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total |
| Sódio (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Potássio (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnésio (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Cálcio (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Minerais traços e vitaminas | 5 ml TE2 + ½ frasco V1 + 5 ml V2 | 5 ml TE2 + ½ frasco V1 + 5 ml V2 | 5 ml TE2 + ½ frasco V1 + 5 ml V2 | 5 ml TE2 + ½ frasco V1 + 5 ml V2 | ||
| Água para injeção | 350 ml | 350 ml | ||||
Tabela 6: Compatibilidade 2-em-1 (W2K ativado) com diluição em água e sem diluição
| Para 376 ml (após a mistura de 2 câmaras, sem lipídios) | ||||||
| Aditivo sem diluição | Aditivo com diluição | |||||
| Componentes adicionais | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total | Quantidade contida | Quantidade máxima adicionada | Quantidade máxima total |
| Sódio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Cálcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Minerais traços e vitaminas | 5 ml TE2 + ½ frasco V1 | 5 ml TE2 + ½ frasco V1 | 5 ml TE2 + ½ frasco V1 | 5 ml TE2 + ½ frasco V1 | ||
| Água para injeção | 450 ml | 450 ml | ||||
Composição dos preparados que contêm vitaminas e minerais traços apresentados nas Tabelas 7 e 8.
Tabela 7: Composição do preparado pronto que contém minerais traços:
| Composição por frasco de 10 ml | TE1 | TE2 | TE4 |
| Ferro | 8,9 µmol ou 0,5 mg | ||
| Zinco | 38,2 µmol ou 2,5 mg | 15,3 µmol ou 1 mg | 15,3 µmol ou 1 mg |
| Selênio | 0,253 µmol ou 0,02 mg | 0,6 µmol ou 0,05 mg | 0,253 µmol ou 0,02 mg |
| Cobre | 3,15 µmol ou 0,2 mg | 4,7 µmol ou 0,3 mg | 3,15 µmol ou 0,2 mg |
| Iodo | 0,0788 µmol ou 0,01 mg | 0,4 µmol ou 0,05 mg | 0,079 µmol ou 0,01 mg |
| Flúor | 30 µmol ou 0,57 mg | 26,3 µmol ou 0,5 mg | |
| Molibdênio | 0,5 µmol ou 0,05 mg | ||
| Manganês | 0,182 µmol ou 0,01 mg | 1,8 µmol ou 0,1 mg | 0,091 µmol ou 0,005 mg |
| Cobalto | 2,5 µmol ou 0,15 mg | ||
| Cromo | 0,4 µmol ou 0,02 mg 18 |
Tabela 8: Composição do preparado pronto que contém vitaminas:
Introdução de componentes adicionais:
- Devem ser mantidas as condições assépticas.
- Preparar o local de injeção no saco.
- Perfurar o local de injeção e injetar os componentes adicionais usando uma agulha para injeção ou um dispositivo para preparação de medicamentos.
- Misturar o conteúdo do saco com os componentes adicionais.
Preparação da infusão:
- Devem ser mantidas as condições assépticas.
- Suspender o saco.
- Remover a tampa plástica do porto de administração do medicamento.
- Introduzir a agulha do conjunto de infusão no porto de administração do medicamento com um movimento decidido.
Administração da infusão:
- Apenas para uso único.
- Administrar o medicamento apenas após a ruptura das soldas entre as duas ou três câmaras e após a mistura do conteúdo das duas ou três câmaras.
- Deve-se garantir que a emulsão final do saco de três câmaras ativado para infusão não apresente separação de fases ou que a solução final do saco de duas câmaras para infusão não contenha partículas sólidas.
- Recomenda-se o uso imediato após a abertura das soldas rompíveis. O medicamento NUMETA G16%E não deve ser armazenado para a próxima infusão.
- Não conectar sacos parcialmente usados.
- Para evitar a formação de um êmbolo aéreo causado pelo ar residual contido no primeiro saco, não conectar sacos em série.
- Recomenda-se o uso de um filtro de 1,2 micrômetro para a administração do medicamento NUMETA G16%E.
- Em caso de uso em recém-nascidos e crianças abaixo de 2 anos, deve-se proteger da luz até o final da administração. A exposição do medicamento NUMETA G16%E à luz ambiente, especialmente após a mistura com minerais traços e (ou) vitaminas, pode causar a formação de peróxidos e outros produtos de degradação, o que pode ser reduzido protegendo da luz.
- Todos os resíduos de medicamento não utilizado ou seus resíduos e todo o conjunto de uso único necessário devem ser eliminados de forma apropriada.
| Composição por frasco | V1 | V2 |
| Vitamina B1 | 2,5 mg | |
| Vitamina B2 | 3,6 mg | |
| Nicotinamida | 40 mg | |
| Vitamina B6 | 4,0 mg | |
| Ácido pantotênico | 15,0 mg | |
| Biotina | 60 µg | |
| Ácido fólico | 400 µg | |
| Vitamina B12 | 5,0 µg | |
| Vitamina C | 100 mg | |
| Vitamina A | 2300 UI | |
| Vitamina D | 400 UI | |
| Vitamina E | 7 UI | |
| Vitamina K | 200 µg |
Prazo de validade após a mistura das soluções:
O medicamento deve ser usado imediatamente após a abertura das soldas rompíveis entre as duas ou três câmaras.
Estudos de estabilidade das misturas foram realizados por 7 dias a uma temperatura de 2°C a 8°C, e subsequentemente por 48 horas a 30°C.
Prazo de validade após a introdução de componentes adicionais (eletrólitos, minerais traços, vitaminas, água)
Para os componentes adicionais específicos, foi demonstrada a estabilidade física do medicamento NUMETA por 7 dias a uma temperatura de 2°C a 8°C, e subsequentemente por 48 horas a 30°C.
Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente. Se o medicamento não for usado imediatamente, o tempo e as condições de armazenamento até o momento de sua aplicação são de responsabilidade do usuário, mas normalmente não devem exceder 24 horas a uma temperatura de 2°C a 8°C, a menos que a preparação/dissolução/introdução de componentes adicionais tenha sido realizada em condições assépticas controladas e validadas.
Não usar o medicamento NUMETA G16%E se o saco estiver danificado. Abaixo são apresentadas as características de um saco danificado:
- As soldas rompíveis estão abertas
- Qualquer uma das câmaras contém uma mistura de soluções
- As soluções que contêm aminocidos e glicose não são transparentes, incolores ou levemente amareladas e (ou) contêm partículas visíveis
- A emulsão lipídica não é um líquido homogêneo de aparência leitosa.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. É necessário perguntar ao farmacêutico o que fazer com os medicamentos que não são mais necessários. Esse procedimento ajudará a proteger o meio ambiente.
O que contém o medicamento NUMETA G16%E
Substâncias ativas:
| Composição | ||
| Substância ativa | W2K ativado (376 ml) | W3K ativado (500 ml) |
| Câmara com aminocidos | ||
| Alanina | 1,03 g | 1,03 g |
| Arginina | 1,08 g | 1,08 g |
| Ácido aspártico | 0,77 g | 0,77 g |
| Cisteína | 0,24 g | 0,24 g |
| Ácido glutâmico | 1,29 g | 1,29 g |
| Glicina | 0,51 g | 0,51 g |
| Histidina | 0,49 g | 0,49 g |
| Isoluecina | 0,86 g | 0,86 g |
| Leucina | 1,29 g | 1,29 g |
| Lisina monoidratada (equivalente a lisina) | 1,59 g (1,42 g) | 1,59 g (1,42 g) |
| Metionina | 0,31 g | 0,31 g |
| Ornitina cloridratada (equivalente a ornitina) | 0,41 g (0,32 g) | 0,41 g (0,32 g) |
| Fenilalanina | 0,54 g | 0,54 g |
| Prolina | 0,39 g | 0,39 g |
| Serina | 0,51 g | 0,51 g |
| Taurina | 0,08 g | 0,08 g |
| Treonina | 0,48 g | 0,48 g |
| Triptofano | 0,26 g | 0,26 g |
| Tirosina | 0,10 g | 0,10 g |
| Valina | 0,98 g | 0,98 g |
| Cloruro de sódio | 0,30 g | 0,30 g |
| Acetato de potássio | 1,12 g | 1,12 g |
| Cloruro de cálcio diidratado | 0,46 g | 0,46 g |
| Acetato de magnésio tetraidratado | 0,33 g | 0,33 g |
| Glicerofosfato de sódio monoidratado | 0,98 g | 0,98 g |
| Câmara com glicose | ||
| Glicose monoidratada (equivalente a glicose anidra) | 85,25 g (77,50 g) | 85,25 g (77,50 g) |
| Câmara com lipídios | ||
| Óleo de oliva purificado (aproximadamente 80%) + óleo de soja purificado (aproximadamente 20%) | 15,5 g | |
A solução após a mistura/emulsão contém os seguintes componentes:
| Composição | ||||
| W2K ativado | W3K ativado | |||
| Por unidade de volume (ml) Azoto (g) Aminocidos (g) Glicose (g) Lipídios (g) Valor energético Valor energético total (kcal) Valor energético não proteico (kcal) Valor energético da glicose (kcal) Valor energético lipídico (kcal) Valor energético não proteico/azoto (kcal/g N) Valor energético lipídico/valor energético não proteico (%) Valor energético lipídico/valor energético total (%) Eletrólitos Sódio (mmol) Potássio (mmol) Magnésio (mmol) Cálcio (mmol) Fosfatos* (mmol) | 376 2,0 13,0 77,5 0 362 310 310 0 158 Não aplicável Não aplicável 11,6 11,4 1,6 3,1 3,2 | 100 0,52 3,5 20,6 0 96 82 82 0 158 Não aplicável Não aplicável 3,1 3,0 0,41 0,82 0,85 | 500 2,0 13,0 77,5 15,5 517 465 310 155 237 33 30 12,0 11,4 1,6 3,1 4,4 | 100 0,39 2,6 15,5 3,1 103 93 62 31 237 33 30 2,4 2,3 0,31 0,62 0,87 |
| Octanos (mmol) Malatos (mmol) Cloruros (mmol) | 14,5 4,3 13,8 | 3,9 1,1 3,7 | 14,5 4,3 13,8 | 2,9 0,86 2,8 |
| pH (aproximadamente) Osmolalidade (aproximadamente) (mOsm/l) | 5,5 1585 | 5,5 1585 | 5,5 1230 | 5,5 1230 |
Neste valor, inclui-se o valor energético dos fosfolipídios do ovo para injeção.
Neste valor, inclui-se os fosfatos dos fosfolipídios do ovo para injeção, que são componentes da emulsão lipídica.
Outros componentes:
Ácido L-málico
Ácido clorídrico
Fosfolipídios do ovo para injeção
Glicerol
Oléato de sódio
Hidróxido de sódio
Água para injeção
para ajustar o pH
Baxter, Numeta, Numetzah e Numetah são marcas registradas da Baxter International Inc.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBaxter S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Numeta G16%eForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Numeta G16%e noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Numeta G16%e em Espanha
Alternativa a Numeta G16%e em Ukraine
Médicos online para Numeta G16%e
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Numeta G16%e – sujeita a avaliação médica e regras locais.














