
Maxitrol

Pergunte a um médico sobre a prescrição de Maxitrol

Como usar Maxitrol
Folheto anexo ao embalagem: informação para o doente
Atenção! Deve conservar o folheto. Informação no embalagem primário em língua estrangeira.
Maxitrol
(1 mg + 3500 UI + 6000 UI)/ml, gotas para os olhos, suspensão
Dexametasona + Sulfato de Neomicina + Sulfato de Polimixina B
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto, para que possa lê-lo novamente se necessário.
- Em caso de dúvidas, deve consultar um médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Maxitrol e para que é usado
- 2. Informações importantes antes de usar o medicamento Maxitrol
- 3. Como usar o medicamento Maxitrol
- 4. Efeitos não desejados possíveis
- 5. Como conservar o medicamento Maxitrol
- 6. Conteúdo do embalagem e outras informações
1. O que é o medicamento Maxitrol e para que é usado
O medicamento Maxitrol é usado para tratar doenças inflamatórias dos olhos, que podem ser acompanhadas de infecção.
A inflamação do olho pode ser causada por infecção ou outros fatores que entram no olho
ou lesões no olho.
O medicamento Maxitrol é um medicamento composto que contém componentes antibacterianos e corticosteroides.
Os corticosteroides (neste caso, dexametasona) são usados para prevenir e reduzir a inflamação dos olhos. Os medicamentos antibacterianos contidos nas gotas (neste caso, sulfato de neomicina e sulfato de polimixina B) são ativos contra a maioria das bactérias patogênicas que causam infecções nos olhos.
2. Informações importantes antes de usar o medicamento Maxitrol
Quando não usar o medicamento Maxitrol
- se o doente tiver alergiaao sulfato de neomicina, sulfato de polimixina B, dexametasona ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6),
- se o doente tiver:
- herpes simples na córnea, varicela, sarampo ou qualquer outra infecção viral nos olhos,
- infecção fúngica nos olhos,
- infecção parasitária nos olhos não tratada,
- infecção tuberculosa nos olhos,
- infecção bacteriana nos olhos não tratada.
Página 1 de 6
Precauções e advertências
Para uso exclusivo nos olhos.
- Em alguns doentes, pode ocorrer sensibilidade ao uso tópico de antibióticos aminoglicosídeos, como a neomicina. Em caso de ocorrência de sintomas de sensibilidade, deve-se interromper o uso do medicamento e procurar imediatamente um médico (ver ponto 4). As reações de sensibilidade podem ocorrer na forma de coceira local ou vermelhidão da pele, reações alérgicas graves (anafilaxia) ou reações cutâneas graves. Essas reações cutâneas podem ocorrer durante o uso de outros antibióticos tópicos ou sistêmicos da mesma família (aminoglicosídeos).
- Além disso, o uso tópico de neomicina pode causar vermelhidão, irritação e desconforto na pele.
- Os doentes que apresentam sintomas de sensibilidade ao uso tópico de neomicina também podem apresentar sensibilidade a outros antibióticos.
- Se o doente estiver usando outros antibióticos durante o tratamento com o medicamento Maxitrol, deve procurar um médico, pois o uso concomitante do medicamento Maxitrol com outros antibióticos pode causar efeitos não desejados graves.
- Os doentes que usam corticosteroides nos olhos por períodos prolongados podem apresentar:
- pressão intraocular elevada. Deve-se controlar regularmente a pressão nos olhos durante o uso deste medicamento. Isso é especialmente importante em crianças, pois a elevação da pressão intraocular causada pelos corticosteroides pode ser maior e ocorrer mais cedo em crianças do que em adultos. Deve-se procurar um médico especialmente em caso de crianças. O risco de elevação da pressão intraocular e (ou) catarata também é maior em doentes predispostos (por exemplo, diabéticos).
- desenvolvimento do síndrome de Cushing causado pelo medicamento que entra no sangue. Deve-se procurar um médico se o doente apresentar inchaço e aumento de peso, especialmente no tronco e na face, pois esses são geralmente os primeiros sintomas da doença conhecida como síndrome de Cushing. A supressão da função adrenal pode ocorrer após a interrupção do uso prolongado ou intensivo do medicamento Maxitrol. Deve-se procurar um médico antes de interromper o tratamento. Esse risco é especialmente importante em crianças e em doentes tratados com ritonavir ou cobicistat.
- Em caso de ocorrência ou agravamento de sintomas de infecção nos olhos, deve-se procurar imediatamente um médico. Os doentes que usam o medicamento Maxitrol podem ter uma resposta imunológica reduzida às infecções nos olhos, incluindo infecções bacterianas e fúngicas resistentes ao tratamento com antibióticos.
- Os doentes que usam corticosteroides e medicamentos anti-inflamatórios não esteroides concomitantemente podem apresentar problemas de cicatrização das lesões na superfície dos olhos.
- Se o doente tiver doenças que causem afinamento da córnea ou esclera, deve informar o médico.
Se o doente apresentar visão turva ou outros distúrbios da visão, deve procurar um médico.
Se o doente tiver glaucoma, o tempo de tratamento deve ser limitado a duas semanas, a menos que o médico prescreva de outra forma.
O medicamento deve ser usado por tanto tempo quanto prescrito pelo médico. Se os sintomas da doença piorarem ou não melhorarem, deve-se consultar um médico.
Crianças
A segurança e eficácia do medicamento Maxitrol não foram estabelecidas em crianças, portanto não é recomendado seu uso nessa faixa etária.
Medicamento Maxitrol e outros medicamentos
Página 2 de 6
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está usando atualmente
ou recentemente, bem como sobre os medicamentos que o doente planeja usar, incluindo medicamentos sem prescrição médica.
Deve informar especialmente o médico se o doente estiver usando:
- medicamentos anti-inflamatórios não esteroides tópicos. O uso concomitante de um medicamento esteroide e um medicamento anti-inflamatório não esteroide pode causar problemas de cicatrização das lesões nos olhos;
- ritonavir ou cobicistat, pois podem aumentar a concentração de dexametasona no sangue. Se o doente estiver usando outros medicamentos para os olhos, deve-se manter um intervalo de pelo menos 5 minutos entre as doses. Os pomadas para os olhos devem ser usadas por último.
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar um médico ou farmacêutico antes de usar este medicamento. O medicamento não é recomendado durante a gravidez ou amamentação.
Condução de veículos e uso de máquinas
O medicamento Maxitrol não tem ou tem um efeito insignificante na capacidade de conduzir veículos e usar máquinas.
Por um período de tempo após a administração do medicamento Maxitrol, a visão pode estar turva. Não se deve conduzir veículos ou usar máquinas até que esse efeito desapareça.
Medicamento Maxitrol gotas para os olhos contém cloreto de benzalcônio.
O medicamento contém 0,04 mg de cloreto de benzalcônio em cada mililitro (0,04 mg/ml).
O cloreto de benzalcônio pode ser absorvido por lentes de contato moles e alterar sua coloração. Deve-se remover as lentes de contato antes de usar as gotas e esperar pelo menos 15 minutos antes de colocá-las novamente.
O cloreto de benzalcônio também pode causar irritação nos olhos, especialmente em pessoas com síndrome do olho seco ou distúrbios da córnea (camada transparente na frente do olho). Em caso de sensações anormais nos olhos, coceira ou dor nos olhos após o uso do medicamento, deve-se procurar um médico.
3. Como usar o medicamento Maxitrol
O medicamento Maxitrol deve ser usado sempre de acordo com as instruções do médico. Em caso de dúvidas, deve-se consultar um médico ou farmacêutico.
O medicamento Maxitrol é destinado exclusivamentepara uso nos olhos; uma única embalagem do medicamento deve ser usada por um únicodoente.
Se, após a remoção da tampa, o anel de segurança estiver solto, deve-se removê-lo antes de usar o medicamento.
Recomenda-se fechar a pálpebra e pressionar suavemente o ducto nasolacrimal (canal lacrimal) com o dedo. Isso pode ajudar a reduzir a absorção do medicamento para o sangue após a administração em forma de gotas para os olhos.
Dose recomendada
Em doenças de evolução leve, usa-se uma a duas gotas no(s) saco(s) conjuntival(is) quatro a seis vezes ao dia.
Em casos graves, usa-se uma a duas gotas, a cada hora. O medicamento é usado em doses cada vez menores à medida que os sintomas da inflamação desaparecem e é interrompido após a resolução dos sintomas.
O médico determinará o tempo de tratamento. Não se deve interromper o tratamento prematuramente.
Página 3 de 6
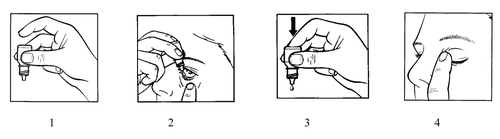
- 1. Preparar a garrafa com o medicamento Maxitrol e um espelho.
- 2. Lavar as mãos.
- 3. Agitar a garrafa.
- 4. Remover a tampa.
- 5. Segurar a garrafa com a mão e apontá-la para cima com a parte inferior, segurando com o polegar e o dedo médio (figura 1).
- 6. Inclinar a cabeça para trás. Puxar a pálpebra inferior para baixo com um dedo limpo, de modo a formar uma "bolsa" entre a pálpebra e o globo ocular; a gota deve cair nessa bolsa (figura 2).
- 7. Aproximar a ponta da garrafa do olho. Para facilitar, pode-se usar um espelho.
- 8.
Não tocar a ponta do aplicador no olho, pálpebra, área ao redor dos olhos ou outras superfícies.
Não seguir essa recomendação pode causar infecção das gotas.
- 9. Pressionar suavemente a parte inferior da garrafa para fazer com que uma única gota do medicamento Maxitrol saia (figura 3).
- 10. Após a instilação do medicamento Maxitrol, remover o dedo que segurava a pálpebra inferior. Fechar o olho e pressionar o canto do olho perto do nariz com o dedo (figura 4). Isso ajuda a prevenir a absorção do medicamento para o sangue.
- 11. Se for necessário administrar gotas em ambos os olhos, deve-se repetir as etapas acima para o segundo olho.
- 12. Fechar a garrafa imediatamente após o uso.
- 13. Deve-se usar uma única garrafa com o medicamento por vez. Se a gota não atingir o olho, deve-se repetir a tentativa de instilação correta.
Uso de dose maior do que a recomendada do medicamento Maxitrol
Em caso de superdose local do medicamento Maxitrol, deve-se lavar o olho (olhos) com água morna.
Não se deve usar as gotas até a próxima dose programada.
Omissão da dose do medicamento Maxitrol
Em caso de omissão de uma dose do medicamento, deve-se tomar a próxima dose programada. No entanto, se faltar pouco tempo para a próxima dose, a dose omitida deve ser ignorada e o esquema de administração normal deve ser retomado. Não se devetomar uma dose dupla para compensar a dose omitida.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve-se consultar um médico ou farmacêutico.
4. Efeitos não desejados possíveis
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não todos os doentes os apresentem.
Se o doente apresentar reações alérgicas, incluindo erupções cutâneas, inchaço do rosto, lábios, língua e
(ou) garganta, que podem causar dificuldades para respirar ou engolir, ou apresentar outros efeitos não desejados graves, deve interromper o uso do medicamento Maxitrol e procurar imediatamente um médico ou o departamento de emergência do hospital mais próximo.
Durante o uso do medicamento Maxitrol, foram observados os seguintes efeitos não desejados:
Pouco frequentes( podem ocorrer em menos de 1 em 1000 doentes): inflamação da córnea, aumento da pressão intraocular, coceira nos olhos, desconforto nos olhos, irritação nos olhos.
Frequência desconhecida( frequência não pode ser estimada com base nos dados disponíveis): sensibilidade, dor de cabeça, úlceras na córnea, visão turva, sensibilidade à luz, dilatação da pupila, ptose, dor nos olhos, inchaço nos olhos, sensação de corpo estranho nos olhos, congestão nos olhos, lacrimejamento excessivo, reações cutâneas graves (síndrome de Stevens-Johnson), visão turva, hirsutismo (crescimento excessivo de pelos no corpo, especialmente em mulheres), fraqueza muscular e perda de massa muscular, estrias roxas na pele, pressão arterial elevada, irregularidades menstruais ou ausência de menstruação, alterações nos níveis de proteína e cálcio no organismo, supressão do crescimento em crianças e adolescentes e inchaço e ganho de peso, especialmente no tronco e na face (doença conhecida como síndrome de Cushing) (ver ponto 2 "Precauções e advertências").
Notificação de efeitos não desejados
Se ocorrerem qualquer efeito não desejado, incluindo qualquer efeito não desejado não mencionado no folheto, deve-se informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Medicamentos, Agência Reguladora de Medicamentos, Dispositivos Médicos e Produtos Biocidas, Al. Jerozolimskie 181C, 02-222 Varsóvia, telefone: +48 22 49 21 301, fax: +48 22 49 21 309, site: https://smz.ezdrowie.gov.pl
A notificação de efeitos não desejados pode ajudar a coletar mais informações sobre a segurança do medicamento.
Em caso de agravamento de qualquer um dos sintomas ou ocorrência de outros sintomas não desejados não mencionados neste folheto, deve-se informar o médico.
5. Como conservar o medicamento Maxitrol
Para evitar a contaminação das gotas, a garrafa deve ser descartada após 4 semanas da primeira abertura.
A data de abertura da garrafa deve ser anotada no espaço indicado abaixo.
Data de primeira abertura:……….
O medicamento deve ser armazenado em um local não visível e inacessível às crianças.
Não armazenar em temperaturas acima de 25°C.
Não armazenar na geladeira.
Armazenar a garrafa em posição vertical.
Armazenar o embalagem fechado hermeticamente.
Não se deve usar este medicamento após a data de validade indicada no embalagem.
A data de validade indica o último dia do mês indicado.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve-se perguntar ao farmacêutico como descartar os medicamentos que não são mais usados. Esse procedimento ajudará a proteger o meio ambiente.
Página 5 de 6
6. Conteúdo do embalagem e outras informações
O que contém o medicamento Maxitrol
Os componentes ativos do medicamento são:
Dexametasona 1 mg/ml
Sulfato de Neomicina 3500 UI/ml
Sulfato de Polimixina B 6000 UI/ml
Os componentes inativos são:
cloreto de sódio, polissorbato 20, cloreto de benzalcônio, hipromelose, água purificada.
Para o medicamento, adicionam-se quantidades mínimas de ácido clorídrico concentrado e/ou hidróxido de sódio para manter o pH dentro do limite normal.
Como é o medicamento e o que contém o embalagem
O medicamento Maxitrol gotas para os olhos tem a forma de suspensão não transparente de cor branca a amarelada clara.
Está disponível em uma garrafa com aplicador de polietileno de baixa densidade (LDPE) e tampa, em uma caixa de papelão.
Para obter informações mais detalhadas, deve-se consultar o titular da autorização de comercialização ou o importador paralelo.
Titular da autorização de comercialização na República Tcheca, país de exportação:
Novartis s.r.o., Na Pankráci 1724/129, 140 00 Praga 4, República Tcheca
Fabricante:
Novartis Pharma GmbH, Roonstrasse 25, 90429 Nuremberga, Alemanha
Siegfried El Masnou, S.A., Camil Fabra, 58, 08320 El Masnou, Barcelona, Espanha
Novartis Farmacéutica, S.A., Gran Via de les Corts Catalanes 764, 08013 Barcelona, Espanha
Importador paralelo:
Delfarma Sp. z o.o., ul. Św. Teresy od Dzieciątka Jezus 111, 91-222 Łódź
Reembalado por:
Delfarma Sp. z o.o., ul. Św. Teresy od Dzieciątka Jezus 111, 91-222 Łódź
Número de autorização na República Tcheca, país de exportação: 64/631/70-C
Número de autorização para importação paralela: 49/25
Data de aprovação do folheto: 04.02.2025
[Informação sobre marca registrada]
Página 6 de 6
- País de registo
- Substância ativa
- Requer receita médicaSim
- Titular da Autorização de Introdução no Mercado (AIM, MAH)Novartis s.r.o.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a MaxitrolForma farmacêutica: Gotas, (3 mg + 1 mg)/mlSubstância ativa: dexamethasone and antiinfectivesFabricante: Rafarm S.A.Requer receita médicaForma farmacêutica: Gotas, (5 mg + 1 mg)/mlSubstância ativa: dexamethasone and antiinfectivesFabricante: Dr. Gerhard Mann Chem. - Pharm. Fabrik GmbHRequer receita médicaForma farmacêutica: Pomada, (5 mg + 0.3 mg)/gSubstância ativa: dexamethasone and antiinfectivesFabricante: Dr. Gerhard Mann Chem. - Pharm. Fabrik GmbHRequer receita médica
Alternativas a Maxitrol noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Maxitrol em Ucrania
Alternativa a Maxitrol em España
Médicos online para Maxitrol
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Maxitrol – sujeita a avaliação médica e regras locais.














