

Kabiven Peripheral

Pergunte a um médico sobre a prescrição de Kabiven Peripheral

Como usar Kabiven Peripheral
Folheto informativo: informação para o utilizador
Kabiven Peripheral, emulsão para infusão
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém
informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar um médico, farmacêutico ou enfermeiro.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é Kabiven Peripheral e para que é usado
- 2. Informações importantes antes de usar Kabiven Peripheral
- 3. Como usar Kabiven Peripheral
- 4. Efeitos não desejados
- 5. Como conservar Kabiven Peripheral
- 6. Conteúdo do pacote e outras informações
1. O que é Kabiven Peripheral e para que é usado
Kabiven Peripheral é um medicamento que contém: aminoácidos (componentes necessários para a produção de proteínas),
gorduras, glicose e eletrólitos. Fornece uma fonte intravenosa de energia (a partir do açúcar e das gorduras) e
aminoácidos, quando a alimentação oral é impossível, insuficiente ou contraindicada.
Kabiven Peripheral é indicado para uso como componente de uma dieta intravenosa completa, juntamente
com sais, oligoelementos e vitaminas.
2. Informações importantes antes de usar Kabiven Peripheral
Quando não usar Kabiven Peripheral
Não use o medicamento:
- se o doente tiver alergia(hipersensibilidade) a Kabiven Peripheral, aos princípios ativos ou a qualquer um dos outros componentes do medicamento (listados no ponto 6);
- se o doente tiver alergia (hipersensibilidade) a ovos, soja ou amendoins;
- se o doente tiver níveis elevados de gorduras(por exemplo, colesterol) no sangue;
- se o doente tiver doença hepática grave;
- se o doente estiver em choque agudo(causado por perda de grande quantidade de sangue ou alergia);
- se o doente tiver distúrbios da coagulação(síndrome hemofagocitária) ou se o sangue não coagula normalmente;
- se o doente tiver distúrbios do metabolismo de proteínas ou aminoácidos;
- se o doente tiver doença renal grave;
- se o doente tiver hiperglicemia ( nível elevado de açúcar no sangue) que exija a administração de mais de 6 unidades de insulina por hora;
- se o doente tiver níveis elevados de eletrólitos(sais) no sangue;
- se o doente tiver acidose metabólica(acúmulo de substâncias ácidas no sangue e nos tecidos);
- se o doente tiver excesso de líquidono organismo (hiperhidratação);
- se o doente tiver líquido nos pulmões(edema pulmonar agudo);
- se o doente estiver em coma;
- se o doente tiver problemas cardíacos;
- se o doente estiver desidratadoe tiver níveis baixos de sais;
- se o doente tiver reação inflamatória sistémica grave(estado em que o organismo tem uma infecção grave).
Não use Kabiven Peripheral em recém-nascidos e crianças com menos de 2 anos.
Precauções e advertências
Informar o médico se o doente tiver:
- distúrbios da função hepática;
- diabetes não tratada;
- distúrbios do metabolismo das gorduras;
- doenças renais;
- qualquer doença pancreática;
- doenças da tiróide- hipotireoidismo;
- reação inflamatória sistémica(estado em que o organismo tem uma infecção);
- distúrbios da eliminação de eletrólitos do organismo;
- falta de oxigéniopara as células;
- aumento da osmolalidade do soro.
Se durante a infusão ocorrer febre, erupção cutânea, arrepios ou dificuldade em respirar, deve
informar imediatamente o pessoal médico. Estes sintomas podem ser causados por uma reação alérgica ou
por uma dose excessiva do medicamento (ver ponto 4).
Este medicamento pode afetar os resultados de alguns exames. Deve informar o médico sobre a utilização
deste medicamento antes de realizar um exame.
O médico pode recomendar a realização de exames de sangue regulares para confirmar o funcionamento
adequado do medicamento Kabiven Peripheral.
Kabiven Peripheral e outros medicamentos
Deve informar o médico ou enfermeiro sobre todos os medicamentos que o doente está a tomar
atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Deve informar o médico se o doente estiver a tomar:
- heparina - medicamento que previne a formação de coágulos e ajuda a dissolvê-los;
- warfarina, pois a vitamina K presente no óleo de soja pode afetar a capacidade de coagulação do sangue;
- insulina - medicamento usado no tratamento da diabetes.
Gravidez e amamentação
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar ter um
filho, deve consultar um médico ou farmacêutico antes de usar este medicamento.
Não há dados sobre a utilização do medicamento Kabiven Peripheral em mulheres grávidas ou durante
a amamentação. Se a administração de nutrição parenteral (fora do trato gastrointestinal) for necessária
em mulheres grávidas ou durante a amamentação, o médico usará Kabiven Peripheral apenas após uma
avaliação cuidadosa dos benefícios e riscos.
3. Como usar Kabiven Peripheral
Kabiven Peripheral é administrado por infusão.
A dose e o tamanho do pacote a usar são determinados com base no peso do doente e na sua capacidade
de metabolizar gorduras e açúcares. Kabiven Peripheral é administrado por infusão lenta durante 12 a 24
horas. A dose é determinada pelo médico para cada doente.
O pessoal médico pode controlar o estado de saúde do doente durante o tratamento.
Não use Kabiven Peripheral em recém-nascidos e crianças com menos de 2 anos.
Uso de dose excessiva de Kabiven Peripheral
É pouco provável que o doente receba uma dose excessiva de Kabiven Peripheral, pois o medicamento
é administrado por pessoal médico qualificado. Os sintomas de overdose são náuseas, vómitos, suor excessivo
e retenção de líquidos no organismo. Também foram observados hiperglicemia (nível elevado de açúcar no
sangue) e distúrbios do metabolismo dos eletrólitos. Em caso de overdose, há risco de absorção excessiva
de gorduras. Este sintoma é chamado de "síndrome de overdose de gordura". Para obter informações detalhadas,
ver ponto 4. Efeitos não desejados. Se o doente notar os sintomas acima ou achar que recebeu uma dose
excessiva de Kabiven Peripheral, deve informar imediatamente o médico ou enfermeiro. Eles podem reduzir
a velocidade da infusão ou interrompê-la.
Todos estes sintomas geralmente desaparecem ou diminuem após a interrupção da infusão.
Em caso de dúvidas adicionais sobre a utilização deste medicamento, deve consultar um médico, enfermeiro
ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram
em todos os doentes.
Muito raro (menos de 1 em 10.000 doentes) Kabiven Peripheral pode causar alergia (hipersensibilidade). Deve informar imediatamente o médico sobre a ocorrência de:
- erupção cutânea urticariada e pruriginosa no corpo;
- febre muito alta;
- dificuldade em respirar.
Comum (menos de 1 em 10 doentes, mas mais de 1 em 100 doentes):
- aumento da temperatura corporal;
- inflamação da veia na qual o medicamento foi administrado.
Não muito comum (menos de 1 em 100 doentes, mas mais de 1 em 1.000 doentes):
- arrepios;
- fadiga;
- dor abdominal;
- dor de cabeça;
- náuseas;
- vómitos;
- aumento da atividade das enzimas hepáticas. O médico informará o doente sobre a ocorrência deste efeito não desejado.
Outros efeitos não desejados ocorrem muito raramente (menos de 1 em 10.000 doentes):
- pressão arterial elevada ou reduzida;
- respiração acelerada;
- ereção prolongada e dolorosa nos homens;
- distúrbios da imagem sanguínea.
Síndrome de overdose de gordura
A síndrome de overdose de gordura ocorre quando o organismo tem problemas para metabolizar as
gorduras devido à administração excessiva de Kabiven Peripheral. Também pode ocorrer devido a uma
mudança súbita no estado de saúde do doente (por exemplo, problemas renais ou hepáticos). Os sintomas
possíveis incluem febre, aumento da quantidade de gordura no sangue, células e tecidos, distúrbios da
função de vários órgãos e coma. Todos estes sintomas geralmente desaparecem após a interrupção da infusão.
Notificação de efeitos não desejados
Se ocorrerem qualquer efeitos não desejados, incluindo qualquer efeito não desejado não mencionado
neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser
notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos
da Agência Reguladora de Medicamentos
Al. Jerozolimskie 181C, 02-222 Varsóvia
telefone: +48 22 49 21 301, fax: +48 22 49 21 309
site: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode ajudar a recolher mais informações sobre a segurança do
medicamento.
5. Como conservar Kabiven Peripheral
O medicamento deve ser conservado em local não visível e inacessível às crianças.
O médico ou farmacêutico são responsáveis por garantir as condições adequadas de conservação,
administração e eliminação do medicamento Kabiven Peripheral.
Não conservar a uma temperatura superior a 25°C. Conservar no saco exterior.
Não congelar.
Não usar este medicamento após a data de validade impressa no pacote.
Não usar se o pacote estiver danificado.
Para uso único. O medicamento não utilizado não é adequado para uso posterior.
6. Conteúdo do pacote e outras informações
O que contém Kabiven Peripheral
Kabiven Peripheral está disponível em sacos tricômora.
Os sacos tricômora são produzidos em três tamanhos.
Cada saco tricômora contém as seguintes quantidades diferentes de componentes:
| 2400 ml | 1920 ml | 1440 ml | |
| glicose 11% | 1475 ml | 1180 ml | 885 ml |
| solução de aminoácidos com eletrólitos | 500 ml | 400 ml | 300 ml |
| emulsão lipídica (Intralipid 20%) | 425 ml | 340 ml | 255 ml |
Isso corresponde às seguintes composições:
| Substâncias ativas: | 2400 ml | 1920 ml | 1440 ml |
| óleo de soja purificado | 85 g | 68 g | 51 g |
| glicose monohidratada que corresponde à glicose anidra | 178 g 162 g | 143 g 130 g | 107 g 97 g |
| alanina | 8,0 g | 6,4 g | 4,8 g |
| arginina | 5,6 g | 4,5 g | 3,4 g |
| ácido aspártico | 1,7 g | 1,4 g | 1,0 g |
| ácido glutâmico | 2,8 g | 2,2 g | 1,7 g |
| glicina (ácido aminobutírico) | 4,0 g | 3,2 g | 2,4 g |
| histidina | 3,4 g | 2,7 g | 2,0 g |
| isoleucina | 2,8 g | 2,2 g | 1,7 g |
| leucina | 4,0 g | 3,2 g | 2,4 g |
| lisina cloridrato | 5,6 g | 4,5 g | 3,4 g |
| que corresponde à lisina anidra | 4,5 g | 3,6 g | 2,7 g |
| metionina | 2,8 g | 2,2 g | 1,7 g |
| fenilalanina | 4,0 g | 3,2 g | 2,4 g |
| prolina | 3,4 g | 2,7 g | 2,0 g |
| serina | 2,2 g | 1,8 g | 1,4 g |
| treonina | 2,8 g | 2,2 g | 1,7 g |
| triptofano | 0,95 g | 0,76 g | 0,57 g |
| tirosina | 0,12 g | 0,092 g | 0,069 g |
| valina | 3,6 g | 2,9 g | 2,2 g |
| cloreto de cálcio di-hidratado que corresponde ao cloreto de cálcio | 0,49 g 0,37 g | 0,39 g 0,30 g | 0,29 g 0,22 g |
| glicerofosfato de sódio que corresponde ao glicerofosfato de sódio anidro | 2,5 g | 2,0 g | 1,5 g |
| sulfato de magnésio heptahidratado que corresponde ao sulfato de magnésio | 1,6 g 0,8 g | 1,3 g 0,64 g | 0,99 g 0,48 g |
| cloreto de potássio | 3,0 g | 2,4 g | 1,8 g |
| acetato de sódio tri-hidratado que corresponde ao acetato de sódio | 4,1 g 2,4 g | 3,3 g 2,0 g | 2,5 g 1,5 g |
Os outros componentes (substâncias auxiliares) são:fosfolipídios de ovo de galinha purificados, glicerol,
hidróxido de sódio (para ajustar o pH), ácido acético glacial (para ajustar o pH) e água para injeção.
Como é Kabiven Peripheral e o que contém o pacote
As soluções de glicose e aminoácidos com eletrólitos são transparentes, incolores a ligeiramente amareladas,
e a emulsão lipídica é branca e homogênea. O pacote do medicamento Kabiven Peripheral consiste
em um saco tricômora interno e um saco exterior. Entre o saco interno e o exterior, há um absorvedor de oxigénio,
que deve ser removido antes de usar o medicamento. O saco interno é dividido em três câmaras por soldaduras,
que se abrem durante a preparação do saco para uso. O conteúdo de todas as três câmaras deve ser misturado
antes de usar.
Tamanhos do pacote:
1440 ml, 1920 ml, 2400 ml.
Nem todos os tamanhos do pacote podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Fresenius Kabi AB
S-751 74 Uppsala
Suécia
Para obter mais informações, deve contactar um representante do titular da autorização de comercialização:
Fresenius Kabi Portugal, Lda.
Rua do Centro Empresarial do Aeroporto, n.º 29, 3.º andar, sala 2
4470-177 Maia
telefone: +351 229 435 610
Data da última revisão do folheto:16.11.2023
Informações destinadas apenas a profissionais de saúde:
Precauções e advertências especiais para uso
Para evitar riscos associados a uma velocidade de infusão excessiva, recomenda-se que a infusão seja
realizada de forma contínua e controlada, sempre que possível com um dispositivo de bomba de volume.
Como o uso de uma veia central para infusão está associado a um risco aumentado de infecção, durante a
inserção e manipulação do cateter, é recomendável seguir estritamente as normas de procedimento asséptico,
para evitar qualquer infecção.
Também se recomenda controlar os níveis de glicose e eletrólitos no soro, a osmolalidade, bem como realizar
exames de sangue e testes enzimáticos hepáticos (fosfatase alcalina, AspAT, AlAT).
Em caso de aparecimento de qualquer sinal ou sintoma de reação anafilática, deve interromper imediatamente
a infusão.
Não deve administrar o medicamento Kabiven Peripheral simultaneamente com sangue no mesmo conjunto
de infusão, devido ao risco de pseudoaglutinação.
Da mesma forma, como no caso de outras soluções hipertônicas para infusão, durante a administração em veias
periféricas, pode ocorrer tromboflebite.
Método de administração
Administração intravenosa, infusão em veia periférica ou central.
Para garantir a nutrição parenteral completa, deve usar, consoante as necessidades do doente, oligoelementos,
vitaminas e eletrólitos (tendo em conta os eletrólitos presentes no medicamento Kabiven Peripheral) adicionais.
Velocidade de infusão
A velocidade máxima de infusão de glicose é de 0,25 g/kg de peso corporal por hora.
A dose de aminoácidos não deve exceder 0,1 g/kg de peso corporal por hora.
A dose de gorduras não deve exceder 0,15 g/kg de peso corporal por hora.
A velocidade de infusão não deve exceder 3,7 ml/kg de peso corporal por hora (o que corresponde a 0,25 g de
glicose, 0,09 g de aminoácidos e 0,13 g de gorduras por kg de peso corporal). O tempo de duração da infusão
recomendado é de 12 a 24 horas.
Compatibilidade
Os dados de compatibilidade estão disponíveis para os medicamentos Dipeptiven, Addamel N/Supliven, Glycophos,
Addiphos, Vitalipid N Adult/Infant e Soluvit N em quantidades específicas e em eletrólitos com concentração
específica. Ao adicionar eletrólitos, deve ter em conta as quantidades já presentes no saco para atender às
necessidades clínicas do doente. Os dados disponíveis confirmam a possibilidade de adicionar os medicamentos
acima mencionados ao saco ativado, conforme a tabela abaixo:
Intervalo de compatibilidade: estável por 8 dias, ou seja, 6 dias a uma temperatura de 2-8 °C, e depois 48 horas
a uma temperatura de 20-25 °C, incluindo o tempo de duração da infusão. Do ponto de vista microbiológico, o medicamento
deve ser usado imediatamente. Caso contrário, o utilizador é responsável pelo período de conservação durante
o uso e pelas condições de conservação antes da administração. Este período não deve exceder, em princípio,
24 horas a uma temperatura de 2-8 °C, a menos que a mistura tenha ocorrido em condições assépticas controladas
e validadas.
| Unidade | Quantidade máxima total | |||
| Tamanho do saco Kabiven Peripheral | ml | 1440 | 1920 | 2400 |
| Aditivo | Volume | |||
| Dipeptiven | ml |
|
|
|
| Supliven/Addamel N | ml |
|
|
|
| Soluvit N | ampola |
|
|
|
| Vitalipid N Adult/Infant | ml |
|
|
|
| Limites de eletrólitos1 | Quantidade por saco | |||
| Sódio | mmol | ≤ 216 | ≤ 288 | ≤ 360 |
| Potássio | mmol | ≤ 216 | ≤ 288 | ≤ 360 |
| Cálcio | mmol | ≤ 7,2 | ≤ 9,6 | ≤ 12 |
| Magnésio | mmol | ≤ 7,2 | ≤ 9,6 | ≤ 12 |
| Fosfato inorgânico (Addiphos) ou Fosfato orgânico (Glycophos) | mmol | ≤ 22 | ≤ 29 | ≤ 36 |
Nota: esta tabela tem como objetivo demonstrar a compatibilidade. Não constitui diretrizes para a dosagem.
Antes de prescrever os medicamentos acima, deve consultar os folhetos de informação aprovados.
As informações sobre a compatibilidade com outros aditivos e os tempos de conservação de diferentes misturas
estão disponíveis a pedido.
Qualquer aditivo deve ser misturado com o medicamento em condições assépticas.
Qualquer resíduo não utilizado do medicamento ou resíduos deve ser eliminado de acordo com as regulamentações
locais.
Prazo de validade e condições de conservação
Não conservar a uma temperatura superior a 25°C. Conservar no saco exterior.
Não congelar.
Prazo de validade após a mistura do conteúdo das câmaras do saco
Foi demonstrada a estabilidade física e química do conteúdo misturado do saco tricômora durante
48 horas a uma temperatura de 20-25 °C, incluindo o tempo de duração da infusão. Do ponto de vista microbiológico,
o medicamento deve ser usado imediatamente. Caso contrário, o utilizador é responsável pelo período de conservação
durante o uso e pelas condições de conservação antes da administração. Este período não deve exceder, em princípio,
24 horas a uma temperatura de 2-8 °C, a menos que a mistura tenha ocorrido em condições assépticas controladas
e validadas.
Prazo de validade após a mistura com substâncias adicionais
Após a abertura e mistura do conteúdo das câmaras do saco, podem ser adicionados outros componentes
através do porto para adição de substâncias.
Foi demonstrada a estabilidade físico-química do conteúdo misturado do saco tricômora com substâncias adicionais
por um período de até 8 dias, ou seja, 6 dias a uma temperatura de 2-8 °C, e depois 48 horas a uma temperatura
de 20-25 °C, incluindo o tempo de duração da infusão. Do ponto de vista microbiológico, o medicamento deve ser
usado imediatamente após a adição de outras substâncias. Caso contrário, o utilizador é responsável pelo período
de conservação durante o uso e pelas condições de conservação antes da administração. Este período não deve
exceder, em princípio, 24 horas a uma temperatura de 2-8 °C, a menos que a mistura tenha ocorrido em condições
assépticas controladas e validadas.
Eliminação de resíduos de medicamento
Não use se o pacote estiver danificado.
Use apenas se as soluções de aminoácidos com eletrólitos e glicose forem transparentes, incolores a ligeiramente
amareladas, e a emulsão lipídica for branca e homogênea .O conteúdo de todas as três câmaras deve ser
misturado antes de usar.
Após a abertura, deve agitar o saco várias vezes para obter uma mistura homogênea antes da infusão.
Para uso único. O medicamento não utilizado não é adequado para uso posterior.
Qualquer resíduo não utilizado do medicamento ou resíduos deve ser eliminado de acordo com as regulamentações
locais.
Kabiven Peripheral - Instruções para preparar o saco Biofine para uso
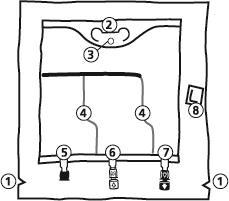
- 1. Corte no saco exterior
- 2. Alça do saco
- 3. Orifício de suspensão do saco
- 4. Soldaduras que separam as câmaras do saco
- 5. Porto cego (usado apenas na produção)
- 6. Porto para adição de substâncias
- 7. Porto de infusão
- 8. Absorvedor de oxigênio
1. Remoção do saco exterior
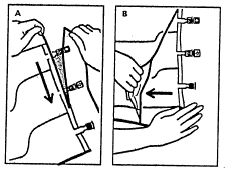
- Para remover o saco exterior, deve colocá-lo na horizontal e, começando pelo corte próximo aos portos,
rasgar ao longo da borda superior (A). - Em seguida, rasgar o saco exterior ao longo da borda longa, remover e descartar juntamente com o absorvedor
de oxigênio (B).
2. Mistura
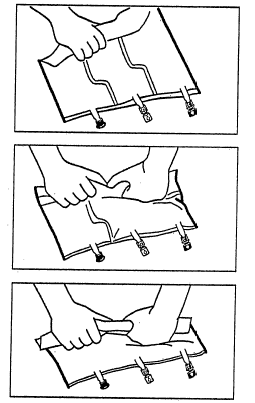
- Colocar o saco em uma superfície plana.
- Enrolar firmemente o saco a partir da alça em direção aos portos, primeiro com a mão direita e, em seguida,
aplicando pressão constante com a mão esquerda, até que as soldaduras verticais se abram. Elas se abrem
devido à pressão do líquido. As soldaduras podem ser abertas antes da remoção do saco exterior. Nota:
o líquido mistura-se facilmente, mesmo que a soldadura horizontal permaneça intacta.
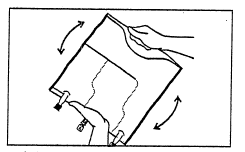
- Misturar o conteúdo das três câmaras virando o saco três vezes, o que deve garantir a mistura completa dos
componentes.
3. Preparação final
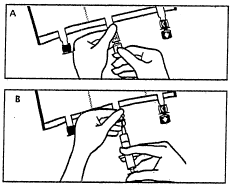
- Colocar o saco novamente em uma superfície plana e nivelada. Imediatamente antes da adição de substâncias,
remover a tampa de uso único que protege o porto branco para adição de substâncias (A). Nota:
a membrana do porto para adição de substâncias é estéril. - Segurar a base do porto para adição de substâncias. Introduzir a agulha, injetar as substâncias adicionais (com
conhecida compatibilidade) através do centro do local de injeção (B). - Misturar bem o conteúdo do saco após a adição de cada componente, girando o saco três vezes após cada
adição. Use seringas com agulhas de diâmetro 18 a 23 G e comprimento máximo de 40 mm.
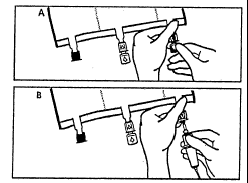
- Imediatamente antes de conectar o conjunto de infusão, remover a tampa de uso único que protege o porto
azul de infusão (A). Nota:a membrana do porto de infusão é estéril. - Use conjuntos de infusão sem dispositivo de ar ou feche o dispositivo de ar.
- Segurar a base do porto de infusão.
- Inserir a ponta do dispositivo de infusão no porto de infusão. Para garantir uma fixação segura da ponta, é
necessário inseri-la até ao fim. Nota:a superfície interna do porto de infusão é estéril.
4. Suspensão do saco
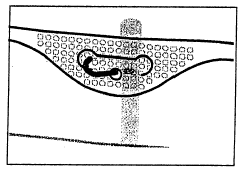
- Suspender o saco usando o orifício localizado abaixo da alça.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorFresenius Kabi AB
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Kabiven PeripheralForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Kabiven Peripheral noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Kabiven Peripheral em Espanha
Alternativa a Kabiven Peripheral em Ukraine
Médicos online para Kabiven Peripheral
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Kabiven Peripheral – sujeita a avaliação médica e regras locais.














