
Havrix Adult

Pergunte a um médico sobre a prescrição de Havrix Adult

Como usar Havrix Adult
Folheto para o paciente: informação para o utilizador
Havrix Adult, suspensão para injeção
Vacina contra a hepatite viral A, inativada, adsorvida
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém
informações importantes para o paciente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico, farmacêutico ou enfermeiro.
- A vacina foi prescrita para uma pessoa específica. Não deve ser transmitida a outros.
- Se o paciente apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
O conteúdo deste folheto foi redigido com a suposição de que será lido pela pessoa que recebe a vacina. No entanto, como a vacina pode ser administrada a jovens a partir dos 16 anos, é possível que o conteúdo do folheto seja lido por um pai ou tutor da criança.
Índice do folheto:
- 1. O que é a vacina Havrix Adult e para que é utilizada
- 2. Informações importantes antes de administrar a vacina Havrix Adult
- 3. Como administrar a vacina Havrix Adult
- 4. Efeitos secundários possíveis
- 5. Como armazenar a vacina Havrix Adult
- 6. Conteúdo da embalagem e outras informações
1. O que é a vacina Havrix Adult e para que é utilizada
Para que é utilizada a vacina Havrix Adult
A vacina Havrix Adult é utilizada para prevenir a hepatite viral A (HVA) em pessoas com 16 anos ou mais, expostas ao risco de infecção pelo vírus da hepatite A (HAV).
O que é a hepatite viral A:
‐
A HVA é uma doença do fígado causada pelo vírus da hepatite A (HAV).
‐
O vírus HAV é transmitido de pessoa para pessoa ou por contato com água, alimentos e bebidas contaminados.
‐
Os sintomas da hepatite A variam de leves a graves e podem incluir febre, mal-estar, perda de apetite, diarreia, náuseas, desconforto abdominal, urina escura e icterícia (amarelamento dos olhos e da pele). A maioria dos pacientes se recupera completamente, mas em alguns casos a doença pode ser grave e requerer hospitalização, e em casos raros pode levar à insuficiência hepática aguda.
Como funciona a Havrix Adult:
‐
A Havrix Adult ajuda o organismo a produzir sua própria proteção (anticorpos) contra o vírus.
‐
Os anticorpos ajudam a proteger o organismo contra a doença.
‐
Assim como todas as vacinas, a Havrix Adult pode não proteger completamente todas as pessoas vacinadas.
2. Informações importantes antes de administrar a vacina Havrix Adult
Quando não administrar a vacina Havrix Adult
‐
se o paciente tiver alergia à substância ativa ou a qualquer um dos outros componentes da vacina (listados no ponto 6) ou à neomicina ou ao formaldeído,
‐
se o paciente já teve uma reação alérgica a qualquer vacina contra a hepatite viral A.
Os sintomas de uma reação alérgica podem incluir erupção cutânea pruriginosa, dificuldade para respirar, inchaço do rosto ou da língua.
Não deve ser administrada a vacina Havrix Adult se alguma das situações acima se aplicar ao paciente. Em caso de dúvida, antes de administrar a vacina Havrix Adult, deve consultar um médico, farmacêutico ou enfermeiro.
Precauções e advertências
Antes de administrar a vacina Havrix Adult, deve discutir com o médico se:
‐
o paciente tem uma infecção grave com febre alta. Nesse caso, a vacinação será adiada. Uma infecção leve, como um resfriado, não deve ser uma contraindicação para a vacinação, mas deve informar o médico antes.
‐
o paciente tem um sistema imunológico debilitado devido a uma doença e/ou medicamentos. O médico decidirá se é necessário administrar doses adicionais,
‐
o paciente tem problemas de sangramento ou tendência a hematomas.
Após ou mesmo antes de administrar cada vacina por injeção, pode ocorrer uma perda de consciência. Nesse caso, deve informar o médico, farmacêutico ou enfermeiro se o paciente já teve uma perda de consciência durante a administração de uma injeção.
A vacina Havrix Adult e outros medicamentos
Deve informar o médico, farmacêutico ou enfermeiro sobre todos os medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o paciente planeja tomar e sobre as vacinas recentemente administradas.
A vacina Havrix Adult pode ser administrada simultaneamente com outras vacinas e imunoglobulinas, mas os locais de injeção devem ser diferentes.
Gravidez e amamentação
Se a paciente está grávida ou amamentando, suspeita que possa estar grávida ou planeja ter um filho, deve consultar um médico, farmacêutico ou enfermeiro antes de administrar esta vacina.
Condução de veículos e operação de máquinas
A vacina Havrix Adult não tem ou tem um efeito insignificante na capacidade de conduzir veículos ou operar máquinas.
A Havrix Adult contém fenilalanina, sódio e potássio
Esta vacina contém 0,166 mg de fenilalanina por dose.
A fenilalanina pode ser prejudicial para pacientes com fenilcetonúria, uma doença genética rara, na qual a fenilalanina se acumula no organismo, pois o organismo não a elimina corretamente.
Esta vacina contém menos de 1 mmol (23 mg) de sódio por dose e menos de 1 mmol (39 mg) de potássio por dose, ou seja, a vacina é considerada "livre de sódio e potássio".
3. Como administrar a vacina Havrix Adult
Como é administrada a vacina Havrix Adult
‐ ‐ A sobredosagem é muito improvável, pois a vacina é fornecida em um frasco ou seringa com uma dose única e é administrada por um médico ou enfermeiro. Foram relatados alguns casos de administração acidental de uma dose maior, e os efeitos secundários relatados foram semelhantes aos relatados com a administração normal da vacina (listados na seção 4). Deve entrar em contato com o médico, que decidirá se é necessário administrar a próxima dose. Como qualquer medicamento, a vacina pode causar efeitos secundários, embora não todos os pacientes os experimentem. ‐ Muito frequentes(podem ocorrer em mais de 1 caso em 10 doses da vacina): Frequentes(podem ocorrer em até 1 caso em 10 doses da vacina): Pouco frequentes(podem ocorrer em até 1 caso em 100 doses da vacina): Raros(podem ocorrer em até 1 caso em 1000 doses da vacina): ‐ Se ocorrerem algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309, O medicamento deve ser armazenado em um local não visível e inacessível às crianças. Vírus da hepatite A, cepa HM175 (inativado) A Havrix Adult é uma suspensão ligeiramente opaca, branca, em um frasco ou seringa. GlaxoSmithKline Biologicals S.A. 08/2024 Instruções para a seringa Adaptador Luer Lock Tampa da agulha
A Havrix Adult é administrada por injeção intramuscular, geralmente no braço superior.
‐Dosagem
O paciente recebe 1 dose da vacina Havrix Adult (1 ml de suspensão) no dia acordado com o médico ou enfermeiro.
‐
A segunda dose (dose de reforço) é recomendada para ser administrada entre 6 e 12 meses após a primeira dose, mas pode ser administrada até 5 anos após a primeira dose para garantir proteção duradoura.Administração de uma dose maior do que a recomendada da vacina Havrix Adult
Se a próxima dose da vacina Havrix Adult não for administrada no prazo estabelecido
4. Efeitos secundários possíveis
Efeitos secundários graves
Deve informar imediatamente o médico se ocorrer algum dos seguintes efeitos secundários graves - pode ser necessário tratamento de emergência:
reações alérgicas - os sintomas podem incluir erupção cutânea localizada ou generalizada, que pode coçar ou formar bolhas, inchaço dos olhos e do rosto, dificuldade para respirar ou engolir, queda repentina da pressão arterial e perda de consciência.
Essas reações podem ocorrer antes de deixar o consultório do médico.
Se ocorrer algum dos efeitos secundários graves mencionados acima, deve informar imediatamente o médico.Durante os estudos clínicos da Havrix Adult, os seguintes efeitos secundários ocorreram:
Os seguintes efeitos secundários ocorreram após a comercialização da vacina Havrix Adult:
convulsões
‐
estreitamento ou bloqueio dos vasos sanguíneos
‐
reação alérgica grave que causa inchaço do rosto, língua ou garganta, o que pode causar dificuldade para engolir ou respirar
‐
urticária, manchas vermelhas, frequentemente coçadoras, que começam nos membros, e às vezes no rosto e no resto do corpo
‐
dor articularNotificação de efeitos secundários
Site: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a coletar mais informações sobre a segurança do medicamento.5. Como armazenar a vacina Havrix Adult
Armazenar na geladeira (2 ° C – 8 ° C).
Não congelar.
Armazenar no embalagem original para proteger da luz.
Não usar esta vacina após o prazo de validade impresso na embalagem após "EXP". O prazo de validade é o último dia do mês indicado.
A abreviatura "Lote" significa o número da série do produto.6. Conteúdo da embalagem e outras informações
O que contém a vacina Havrix Adult
não menos de 1440 unidades ELISA
produzido em cultura de células diploides humanas MRC-5
adsorvido em hidróxido de alumínio, hidratado
0,5 mg de AlComo é a vacina Havrix Adult e o que contém a embalagem
Embalagens disponíveis:
1 frasco de 1 ml em uma caixa de papelão
1 seringa de 1 ml com agulha em uma caixa de papelão
1 seringa de 1 ml com agulha anexada à embalagem em uma caixa de papelãoTitular da autorização de comercialização e fabricante
rue de l’Institut 89
1330 Rixensart, Bélgica
Para obter informações mais detalhadas, deve contatar o representante local do titular da autorização de comercialização:
GSK Services Sp. z o.o.
ul. Rzymowskiego 53
02-697 Warszawa
tel. +48 (22) 576-90-00A vacina é autorizada para comercialização nos estados membros da Área Econômica Europeia sob os seguintes nomes:
República Tcheca, Dinamarca, Estônia, Finlândia, Grécia, Islândia, Itália HAVRIX Noruega, Suécia Havrix Áustria, Bélgica, Hungria, Luxemburgo, Países Baixos HAVRIX 1440 Alemanha Havrix 1440 Bulgária ХАВРИКС 1440 инжекционна суспензия (доза за възрастни) Chipre HAVRIX 1440 IU França HAVRIX 1440 U/1ml ADULTES Irlanda, Malta HAVRIX MONODOSE Letônia HAVRIX 1440 ELISA units/ml vienības/ml suspensija injekcijām Lituânia Havrix 1440 ELISA vienetų/ml injekcinė suspensija Polônia HAVRIX ADULT Portugal HAVRIX 1440 ADULTO Romênia HAVRIX ADULT 1440 suspensie injectabilă República Eslovaca HAVRIX 1440 Dosis adulta Eslovênia HAVRIX 1440 ELISA enot suspenzija za injiciranje Data da última atualização do folheto:
Informações destinadas apenas ao pessoal médico ou de saúde:
Durante o armazenamento, pode ocorrer um sedimento branco e um líquido transparente e incolor no fundo do frasco ou seringa. Antes da administração, a vacina deve ser examinada para detectar a presença de partículas estranhas e/ou alterações físicas.
Antes do uso, deve agitar o frasco ou seringa para obter uma suspensão ligeiramente opaca e branca.
Se ocorrer alguma alteração na aparência da vacina, não deve ser administrada.para adultos Espanha HAVRIX 1440 suspensión inyectable en jeringa precargada
Deve segurar a seringa pelo corpo, não pelo êmbolo.
Deve remover a tampa da seringa girando-a no sentido contrário ao dos ponteiros do relógio.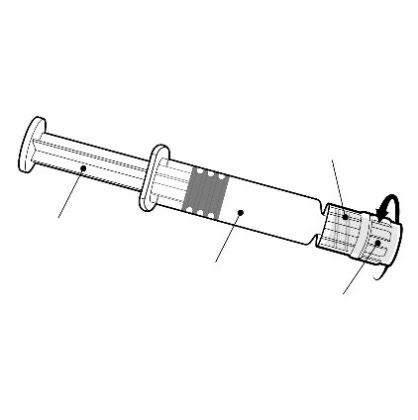
Êmbolo
Corpo
Tampa
Deve conectar a agulha à seringa conectando a tampa da agulha ao adaptador Luer Lock (ang. Luer Lock Adaptor, LLA)
e girando-a um quarto de volta no sentido dos ponteiros do relógio, até sentir o bloqueio da agulha.
Não deve retirar o êmbolo do corpo da seringa. Se isso ocorrer, não deve administrar a vacina.
Eliminação
Qualquer resíduo não utilizado do produto ou seus resíduos deve ser eliminado de acordo com as regulamentações locais.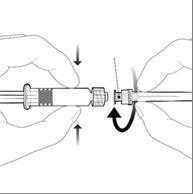
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Havrix AdultForma farmacêutica: Suspensão, 160 unidades antigénicas ELISA do vírus da hepatite A, estirpe GBM/0,5 ml; 1 dose (0,5 ml)Substância ativa: hepatitis A, inactivated, whole virusRequer receita médicaForma farmacêutica: Suspensão, pelo menos 720 unidades ELISA de vírus da hepatite A, estirpe HM175/0,5 ml; 1 dose (0,5 ml)Substância ativa: hepatitis A, inactivated, whole virusFabricante: GlaxoSmithKline Biologicals S.A.Requer receita médicaForma farmacêutica: Suspensão, 25 U de vírus da hepatite A, estirpe CR326F/0,5 ml; 1 dose (0,5 ml), para crianças e adolescentesSubstância ativa: hepatitis A, inactivated, whole virusFabricante: Merck Sharp & Dohme B.V.Requer receita médica
Alternativas a Havrix Adult noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Havrix Adult em España
Alternativa a Havrix Adult em Ucrania
Médicos online para Havrix Adult
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Havrix Adult – sujeita a avaliação médica e regras locais.














