
Havrix 720 Iunior

Pergunte a um médico sobre a prescrição de Havrix 720 Iunior

Como usar Havrix 720 Iunior
Folheto para o paciente: informação para o utilizador
Havrix 720 Junior, suspensão para injeção
Vacina contra a hepatite viral tipo A, inativada, adsorvida
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém
informações importantes para o paciente.
- Deve conservar este folheto, para que possa lê-lo novamente se necessário.
- Em caso de dúvidas, deve consultar um médico, farmacêutico ou enfermeiro.
- A vacina foi prescrita para uma pessoa específica. Não deve ser transmitida a outros.
- Se o paciente apresentar algum efeito indesejado, incluindo qualquer efeito indesejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
O conteúdo deste folheto foi redigido com a suposição de que será lido pela pessoa que recebe a vacina. No entanto, como a vacina pode ser administrada a jovens e crianças, é possível que o conteúdo do folheto seja lido por um pai ou responsável pela criança.
Índice do folheto:
- 1. O que é a vacina Havrix 720 Junior e para que é utilizada
- 2. Informações importantes antes de administrar a vacina Havrix 720 Junior
- 3. Como administrar a vacina Havrix 720 Junior
- 4. Efeitos indesejados possíveis
- 5. Como armazenar a vacina Havrix 720 Junior
- 6. Conteúdo da embalagem e outras informações
1. O que é a vacina Havrix 720 Junior e para que é utilizada
Para que é utilizada a vacina Havrix 720 Junior
A vacina Havrix 720 Junior é utilizada para prevenir a hepatite viral tipo A (HVA) em pessoas com idade entre 1 e 15 anos, inclusive. Se necessário, a vacina Havrix 720 Junior também pode ser administrada a jovens com idade entre 16 e 18 anos, inclusive.
O que é a hepatite viral tipo A:
‐
A HVA é uma doença do fígado causada pelo vírus da hepatite tipo A (HAV).
‐
O vírus HAV é transmitido de uma pessoa para outra ou por contato com água, alimentos e bebidas contaminados.
‐
Os sintomas da hepatite tipo A variam de leves a graves e podem incluir febre, mal-estar, perda de apetite, diarreia, náuseas, desconforto abdominal, urina escura e icterícia (amarelamento dos olhos e da pele). A maioria dos pacientes se recupera completamente, mas às vezes a doença pode ter um curso grave e exigir hospitalização, e em casos raros pode levar à insuficiência hepática aguda.
Como funciona a Havrix 720 Junior:
‐
A Havrix 720 Junior ajuda o organismo a produzir sua própria proteção (anticorpos) contra o vírus.
‐
Os anticorpos ajudam a proteger o organismo contra a doença.
‐
Assim como todas as vacinas, a Havrix 720 Junior pode não proteger completamente todas as pessoas vacinadas.
2. Informações importantes antes de administrar a vacina Havrix 720 Junior
Quando não administrar a vacina Havrix 720 Junior
‐
se o paciente tiver alergia à substância ativa ou a qualquer um dos outros componentes da vacina (listados no ponto 6) ou à neomicina ou ao formaldeído,
‐
se o paciente já teve uma reação alérgica a qualquer vacina contra a hepatite viral tipo A.
Sintomas de reação alérgica podem incluir erupção cutânea pruriginosa, dificuldade para respirar, inchaço do rosto ou da língua.
Não deve ser administrada a vacina Havrix 720 Junior se alguma das situações acima se aplicar ao paciente. Em caso de dúvida, antes de administrar a vacina Havrix 720 Junior, deve consultar um médico, farmacêutico ou enfermeiro.
Advertências e precauções
Antes de administrar a vacina Havrix 720 Junior, deve discutir com um médico, farmacêutico ou enfermeiro se:
‐
o paciente tiver problemas de sangramento ou tendência a hematomas.
Após ou mesmo antes da administração de cada vacina injetável, pode ocorrer uma perda de consciência. Nesse caso, é necessário informar o médico, farmacêutico ou enfermeiro se o paciente já teve uma perda de consciência durante a administração de uma injeção.
A vacina Havrix 720 Junior e outros medicamentos
Deve informar o médico, farmacêutico ou enfermeiro sobre todos os medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o paciente planeja tomar e sobre as vacinas recentemente administradas.
A vacina Havrix 720 Junior pode ser administrada simultaneamente com outras vacinas e imunoglobulinas, mas os locais de injeção devem ser diferentes.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar um médico, farmacêutico ou enfermeiro antes de administrar esta vacina.
Condução de veículos e operação de máquinas
A vacina Havrix 720 Junior não tem ou tem um efeito insignificante na capacidade de conduzir veículos ou operar máquinas.
A Havrix 720 Junior contém fenilalanina, sódio e potássio
Esta vacina contém 0,083 mg de fenilalanina por dose.
A fenilalanina pode ser prejudicial para pacientes com fenilcetonúria, uma doença genética rara, na qual a fenilalanina se acumula no organismo porque o organismo não a elimina corretamente.
Esta vacina contém menos de 1 mmol (23 mg) de sódio por dose e menos de 1 mmol (39 mg) de potássio por dose, ou seja, a vacina é considerada "livre de sódio e potássio".
3. Como administrar a vacina Havrix 720 Junior
Como é administrada a vacina Havrix 720 Junior
‐
A Havrix 720 Junior é administrada por injeção intramuscular, geralmente no braço superior em crianças e jovens.
‐
Em crianças pequenas, a vacina pode ser administrada no músculo da coxa.
‐
Em pacientes com contagem de plaquetas baixa ou com distúrbios graves de coagulação, a vacina Havrix 720 Junior pode ser administrada subcutaneamente, em casos excepcionais.
Posologia
‐
O paciente receberá 1 dose da vacina Havrix 720 Junior (0,5 ml de suspensão) no dia acordado com o médico ou enfermeiro.
‐
A segunda dose (dose de reforço) é recomendada para ser administrada entre 6 e 12 meses após a primeira dose, mas pode ser administrada até 5 anos após a primeira dose para garantir proteção de longo prazo.
Administração de uma dose maior do que a recomendada da vacina Havrix 720 Junior
A sobredose é muito improvável, pois a vacina é fornecida em um frasco ou seringa com dose única e é administrada por um médico ou enfermeiro. Foram relatados alguns casos de administração acidental de dose maior, e os efeitos indesejados relatados foram semelhantes aos relatados com a administração normal da vacina (listados no ponto 4).
Se a próxima dose da vacina Havrix 720 Junior não for administrada no prazo estabelecido
Deve entrar em contato com o médico, que decidirá se é necessário administrar a próxima dose.
4. Efeitos indesejados possíveis
Como qualquer medicamento, esta vacina pode causar efeitos indesejados, embora não todos os pacientes os experimentem.
Efeitos indesejados graves
Deve informar imediatamente o médico se ocorrer algum dos seguintes efeitos indesejados graves - pode ser necessário tratamento de emergência:
‐
reações alérgicas - sintomas podem incluir erupção cutânea localizada ou generalizada, que pode coçar ou formar bolhas, inchaço dos olhos e do rosto, dificuldade para respirar ou engolir, queda repentina da pressão arterial e perda de consciência.
Essas reações podem ocorrer antes de deixar o consultório do médico.
Se ocorrer algum dos efeitos indesejados graves mencionados acima, deve informar imediatamente o médico.
Durante os estudos clínicos da Havrix 720 Junior, ocorreram os seguintes efeitos indesejados:
Muito frequentes(podem ocorrer em mais de 1 caso em 10 doses da vacina):
- irritabilidade
- dor e vermelhidão no local da injeção
Frequentes(podem ocorrer em até 1 caso em 10 doses da vacina):
- diminuição do apetite
- dor de cabeça
- tontura
- náuseas (enjoo)
- mal-estar geral
- febre ≥ 37,5°C
- inchaço no local da injeção
Pouco frequentes(podem ocorrer em até 1 caso em 100 doses da vacina):
- congestão nasal ou sinusite
- vômitos
- diarreia
- erupção cutânea
- endurecimento no local da injeção
Os seguintes efeitos indesejados ocorreram após a comercialização da vacina Havrix 720 Junior:
‐
convulsões
‐
vasculite que leva à estreitamento ou bloqueio dos vasos sanguíneos (vasculite)
‐
reação alérgica grave que causa inchaço do rosto, língua ou garganta, o que pode causar dificuldade para engolir ou respirar
‐
urticária, manchas vermelhas, frequentemente pruriginosas, que começam nos membros, e às vezes no rosto e no resto do corpo
‐
dor nas articulações
Notificação de efeitos indesejados
Se ocorrerem algum efeito indesejado, incluindo qualquer efeito indesejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos indesejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Indesejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309,
Página da Internet: https://smz.ezdrowie.gov.pl
Os efeitos indesejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos indesejados permite reunir mais informações sobre a segurança do medicamento.
5. Como armazenar a vacina Havrix 720 Junior
O medicamento deve ser armazenado em um local não visível e inacessível às crianças.
Armazenar na geladeira (2 °C – 8 °C).
Não congelar.
Armazenar no embalagem original para proteger da luz.
Não usar esta vacina após o prazo de validade impresso na embalagem após "EXP". O prazo de validade é o último dia do mês indicado.
A abreviação "Lote" significa o número da série do produto.
6. Conteúdo da embalagem e outras informações
O que contém a vacina Havrix 720 Junior
- A substância ativa da vacina Havrix 720 Junior é:
O vírus da hepatite tipo A, cepa HM175 (inativado) não menos de 720 unidades ELISA
produzidas em cultura de células diploides humanas MRC-5
adsorvido em hidróxido de alumínio, hidratado
0,25 mg de Al
- Os outros componentes são: polissorbato 20, aminoácidos para injeção (incluindo fenilalanina), fosfato de sódio, fosfato de potássio, cloreto de sódio, cloreto de potássio, água para injeção.
Como é a vacina Havrix 720 Junior e o que contém a embalagem
A Havrix 720 Junior é uma suspensão levemente opaca, branca, em um frasco ou seringa.
Embalagens disponíveis:
1 frasco de 0,5 ml em uma caixa de papelão
1 seringa com agulha de 0,5 ml em uma caixa de papelão
1 seringa de 0,5 ml com agulha anexada à embalagem em uma caixa de papelão
Titular da autorização de comercialização e fabricante
GlaxoSmithKline Biologicals S.A.
Rue de l’Institut 89
1330 Rixensart, Bélgica
Para obter informações mais detalhadas, deve contatar o representante local do titular da autorização de comercialização:
GSK Services Sp. z o.o.
ul. Rzymowskiego 53
02-697 Warszawa
Tel. +48 (22) 576 90 00
Este medicamento está autorizado para comercialização nos Estados-membros do Espaço Econômico Europeu sob as seguintes denominações:
| Dinamarca, Estônia, Finlândia, Grécia, Islândia, Itália | HAVRIX |
| Noruega, Suécia | Havrix |
| Áustria, Bélgica, Luxemburgo | HAVRIX JUNIOR 720 |
| Bulgária | ХАВРИКС 720 инжекционна суспензия (доза за деца) |
| Chipre, Malta, Holanda | HAVRIX JUNIOR |
| República Checa, Irlanda | HAVRIX JUNIOR MONODOSE |
| França | HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 ml |
| Alemanha | Havrix 720 Kinder |
| Hungria, Polônia | HAVRIX 720 JUNIOR |
| Letônia | HAVRIX 720 ELISA units/0,5 ml vienības/0,5 ml suspensija injekcijām |
| Lituânia | Havrix 720 ELISA vienetų/0,5 ml injekcinė suspensija |
| Portugal | HAVRIX 720 JÚNIOR |
| Romênia | HAVRIX JUNIOR 720 suspensie injectabilă |
Data da última atualização do folheto:
08/2024
Informações destinadas apenas ao pessoal médico ou profissionais de saúde:
Durante o armazenamento, pode aparecer um sedimento branco e um líquido transparente e incolor no fundo do frasco ou seringa. Antes da administração, a vacina deve ser inspecionada para detectar a presença de partículas estranhas e/ou alterações físicas.
Antes do uso, deve agitar o frasco ou seringa para obter uma suspensão levemente opaca e branca.
Se for observada qualquer alteração na aparência da vacina, não deve ser administrada.
| República Eslovaca | HAVRIX 720 Junior monodose |
| Eslovênia | HAVRIX 720 ELISA enot suspenzija za injiciranje za otroke |
| Espanha | HAVRIX 720 suspensión inyectable en jeringa precargada |
Instruções para a seringa
Deve segurar a seringa pelo corpo, não pelo êmbolo.
Deve remover a tampa da seringa girando-a no sentido contrário ao dos ponteiros do relógio.
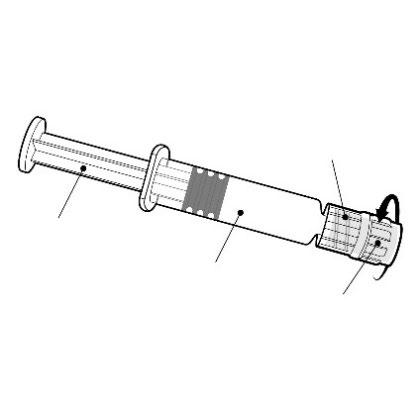
Adaptador Luer Lock
Êmbolo
Corpo
Tampa
Deve fixar a agulha à seringa conectando a tampa da agulha ao adaptador Luer Lock (Adaptador Luer Lock, ALL)
e girando-a um quarto de volta no sentido dos ponteiros do relógio, até sentir o bloqueio da agulha.
Não deve retirar o êmbolo do corpo da seringa. Se isso acontecer, não deve administrar a vacina.
Eliminação
Qualquer resíduo não utilizado do produto ou seus dejetos deve ser eliminado de acordo com as regulamentações locais.
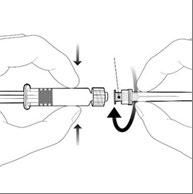
Tampa da agulha
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Havrix 720 IuniorForma farmacêutica: Suspensão, 160 unidades antigénicas ELISA do vírus da hepatite A, estirpe GBM/0,5 ml; 1 dose (0,5 ml)Substância ativa: hepatitis A, inactivated, whole virusRequer receita médicaForma farmacêutica: Suspensão, não menos de 1440 unidades ELISA de vírus da hepatite A, estirpe HM175/ml; 1 dose (1 ml)Substância ativa: hepatitis A, inactivated, whole virusFabricante: GlaxoSmithKline Biologicals S.A.Requer receita médicaForma farmacêutica: Suspensão, 25 U de vírus da hepatite A, estirpe CR326F/0,5 ml; 1 dose (0,5 ml), para crianças e adolescentesSubstância ativa: hepatitis A, inactivated, whole virusFabricante: Merck Sharp & Dohme B.V.Requer receita médica
Alternativas a Havrix 720 Iunior noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Havrix 720 Iunior em Espanha
Alternativa a Havrix 720 Iunior em Ukraine
Médicos online para Havrix 720 Iunior
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Havrix 720 Iunior – sujeita a avaliação médica e regras locais.














