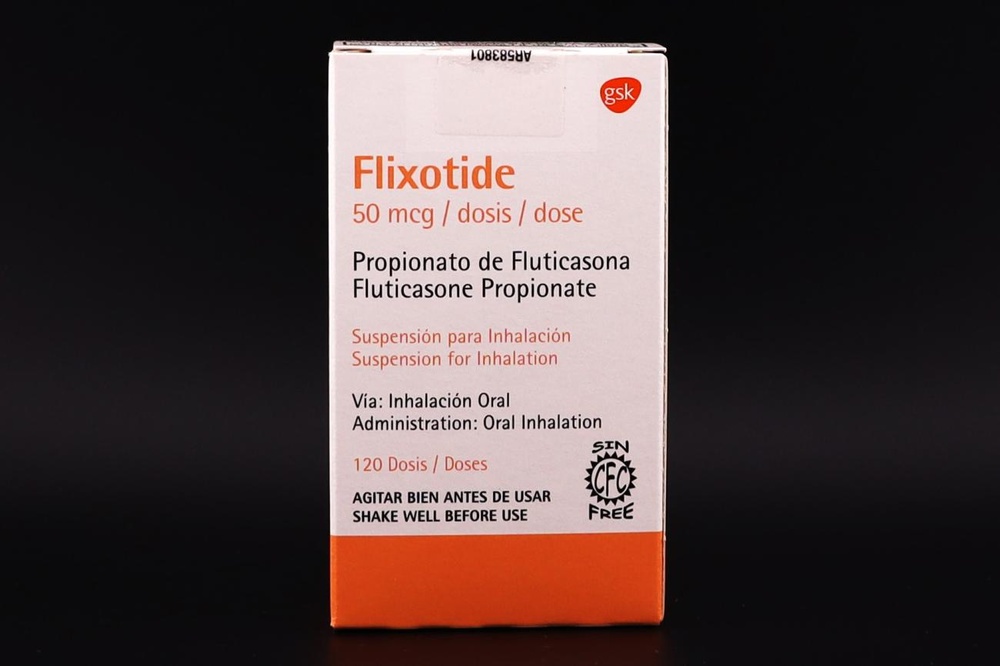
Flixotide

Pergunte a um médico sobre a prescrição de Flixotide

Como usar Flixotide
Folheto informativo para o paciente
Flixotide, 0,5 mg/2 ml, suspensão para nebulização
Flixotide, 2 mg/2 ml, suspensão para nebulização
Fluticasona propionato
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Flixotide e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Flixotide
- 3. Como tomar o medicamento Flixotide
- 4. Efeitos secundários possíveis
- 5. Como armazenar o medicamento Flixotide
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Flixotide e para que é utilizado
Flixotide, suspensão para nebulização, pertence a uma classe de medicamentos utilizados no tratamento da asma brônquica. A substância ativa do medicamento, fluticasona propionato, é um esteroide com ação anti-inflamatória local nos pulmões.
Indicações para uso Adultos e jovens com mais de 16 anos:
O medicamento é utilizado para prevenir a asma brônquica grave, em pacientes que necessitam de doses elevadas de esteroides inalatórios ou orais. O início do tratamento com fluticasona propionato inalatória em muitas pessoas permite reduzir as doses ou interromper completamente os esteroides orais.
Crianças com idades entre 4 e 16 anos:
Tratamento de exacerbação da asma brônquica.
2. Informações importantes antes de tomar o medicamento Flixotide
Quando não tomar o medicamento Flixotide
- se o paciente for alérgico à fluticasona propionato ou a qualquer um dos outros componentes do medicamento (listados no ponto 6).
Precauções e advertências
Se os sintomas da asma se agravarem ou se a asma não estiver controlada, ou seja, se a respiração wheezing se agravar ou se for necessário usar mais inalações de um medicamento inalatório de ação rápida para facilitar a respiração, o paciente deve continuar a tomar o medicamento e contatar imediatamente o médico, que avaliará o estado de saúde do paciente e prescreverá o tratamento adequado.
O medicamento Flixotide não deve ser utilizado para interromper um ataque agudo de falta de ar. Para isso, deve ser utilizado um medicamento inalatório de ação rápida, que o paciente deve sempre ter consigo.
Flixotide é destinado a ser utilizado diariamente, de forma regular.
Flixotide não pode ser administrado em vez de esteroides orais ou intravenosos em condições de risco de vida.
Em caso de tratamento prolongado com o medicamento Flixotide, pode ocorrer supressão da produção natural de hormônios esteroides pelas glândulas supra-renais. Isso pode causar redução da densidade óssea, catarata, glaucoma, aumento de peso, redondeamento da face (forma lunar), hipertensão, retardamento do crescimento em crianças e jovens. O médico monitorará regularmente se o paciente apresenta algum desses efeitos secundários e garantirá que o paciente esteja tomando a menor dose de Flixotide necessária para controlar a asma.
Durante o tratamento com fluticasona propionato nas doses recomendadas, a função da cortex supra-renal geralmente permanece normal. No entanto, em pacientes que foram previamente tratados com esteroides orais, podem ocorrer sintomas de disfunção da cortex supra-renal. O tratamento prolongado com doses elevadas de esteroides inalatórios pode causar supressão da função da cortex supra-renal. Crianças e jovens com menos de 16 anos que tomam doses elevadas (geralmente ≥1000 microgramas por dia) de fluticasona propionato são um grupo de risco especial. Raramente, podem ocorrer sintomas secundários em caso de doses elevadas de Flixotide por um longo período ou em caso de interrupção abrupta do tratamento ou redução da dose. Os sintomas secundários também podem ocorrer em caso de infecções ou em períodos de estresse intenso (por exemplo, acidente, lesão ou cirurgia).
Os sintomas não são geralmente característicos e podem incluir: dores abdominais, fadiga, perda de apetite, náuseas e vômitos, perda de peso, dores de cabeça, confusão, hipotensão, redução da glicemia e convulsões. Para prevenir esses sintomas, o médico pode prescrever corticosteroides adicionais para serem utilizados durante esse período.
Devido à possibilidade de disfunção da cortex supra-renal, os pacientes que têm esteroides orais substituídos por fluticasona propionato inalatória devem ser monitorados de perto, e a função da cortex supra-renal deve ser monitorada.
Após a introdução do tratamento com fluticasona propionato, a redução das doses de esteroides de ação sistêmica deve ser feita gradualmente, e os pacientes devem ter um "cartão de esteroides" que informe sobre a necessidade de administração de esteroides de ação sistêmica em caso de estresse.
A substituição de esteroides orais por medicamentos inalatórios pode revelar sintomas de alergia, como alergia ao naso ou erupções cutâneas, que foram previamente tratados com esteroides de ação sistêmica. O médico prescreverá o tratamento adequado.
Foram relatados casos muito raros de aumento da glicemia (hiperglicemia) (ver ponto 4) e o médico deve considerar isso ao prescrever Flixotide a pacientes com diabetes.
Não deve interromper abruptamente o tratamento com fluticasona propionato.
Se o paciente estiver atualmente sendo tratado ou tiver sido tratado para tuberculose, deve informar o médico.
Se o paciente apresentar visão turva ou outros distúrbios da visão que possam ser causados por catarata ou glaucoma, deve contatar o médico.
Flixotide e outros medicamentos
Deve informar o médico sobre todos os medicamentos que está tomando atualmente ou recentemente, bem como sobre os medicamentos que planeja tomar, incluindo os que são vendidos sem receita.
É especialmente importante informar o médico sobre os seguintes medicamentos:
- esteroides orais ou injetáveis
- ritonavir ou medicamentos que contenham cobicistat, utilizados no tratamento de HIV
- ketoconazol ou itraconazol, utilizados no tratamento de infecções fúngicas.
O médico avaliará se é possível tomar Flixotide com esses medicamentos. Alguns deles podem aumentar os efeitos de Flixotide e o médico pode querer monitorar de perto o estado do paciente que está tomando esses medicamentos (incluindo alguns medicamentos para HIV: ritonavir, cobicistat).
Com Flixotide, apenas os medicamentos prescritos pelo médico devem ser utilizados.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico antes de tomar este medicamento.
O médico avaliará se a paciente pode tomar Flixotide durante esse período.
Condução de veículos e operação de máquinas
É pouco provável que os possíveis efeitos secundários associados ao uso de Flixotide afetem a capacidade de conduzir veículos ou operar máquinas.
3. Como tomar o medicamento Flixotide
Este medicamento deve ser sempre utilizado de acordo com as recomendações do médico. Não deve ser tomado em doses maiores do que as recomendadas. Em caso de dúvidas, deve consultar o médico.
Flixotide, na forma de suspensão para nebulização, é destinado apenas para inalação, não é destinado para administração oral ou injeção.
O medicamento deve ser utilizado na forma de aerossol produzido por um nebulizador pneumático, de acordo com as recomendações do médico. Não é recomendado o uso de nebulizadores ultrassônicos para inalação do medicamento Flixotide, suspensão para nebulização.
Como a administração inalatória do medicamento depende de muitos fatores, deve seguir as instruções fornecidas pelo fabricante do nebulizador.
Recomenda-se a inalação do medicamento com um bocal, para evitar o risco de aparecimento de lesões atrofiantes na pele do rosto em caso de administração prolongada de fluticasona propionato com um bocal facial. Em caso de uso de um bocal facial, a pele do rosto em contato com ele deve ser protegida com um creme ou lavada cuidadosamente após a inalação.
Dosagem
Adultos e jovens com mais de 16 anos- 0,5 a 2,0 mg duas vezes ao dia, estritamente de acordo com as recomendações do médico.
Crianças e jovens com idades entre 4 e 16 anos- 1,0 mg duas vezes ao dia, estritamente de acordo com as recomendações do médico.
Não deve ser utilizado o medicamento Flixotide, 2 mg/2 ml, suspensão para nebulização em crianças com menos de 16 anos. Não há dados clínicos sobre a dosagem recomendada para essa faixa etária.
Grupos especiais de pacientes:não há necessidade de reduzir a dose em pacientes idosos ou com disfunção renal ou hepática.
Modo de administração
Antes de usar, agite bem o conteúdo do recipiente, sacudindo-o várias vezes. Para abrir, gire a parte superior móvel do recipiente e separe-a.
Recomenda-se a inalação do medicamento com um bocal de inalação (ver as instruções de uso do nebulizador).
Diluição:Flixotide, suspensão para nebulização pode ser diluído com solução salina a 0,9% para injeção, para facilitar a administração de pequenos volumes do medicamento ou se for recomendada uma administração mais prolongada.
A suspensão não utilizada deve ser descartada do nebulizador.
Dependendo do design do nebulizador, o aerossol pode ser liberado para o exterior. Por isso, não deve ser realizado a inalação com o nebulizador em ambientes fechados, sem possibilidade de ventilação. Isso é especialmente importante em salas de hospital, onde vários pacientes podem estar usando nebulizadores ao mesmo tempo.
Uso de dose maior do que a recomendada do medicamento Flixotide
Em caso de uso de dose maior do que a recomendada do medicamento Flixotide, deve contatar imediatamente o médico ou farmacêutico para obter conselho.
É importante utilizar as doses do medicamento de acordo com as recomendações do médico. Não deve aumentar ou diminuir a dose sem consultar o médico.
O uso de doses maiores do que as recomendadas de fluticasona propionato pode causar supressão transitória da função da cortex supra-renal.
O uso prolongado de doses maiores do que as recomendadas de fluticasona propionato pode levar à insuficiência da cortex supra-renal.
Omissão da administração do medicamento Flixotide
É muito importante tomar a dose recomendada do medicamento todos os dias, para garantir a máxima eficácia do tratamento.
Em caso de omissão da dose, deve tomar o medicamento o mais rápido possível. Continue o tratamento de acordo com as recomendações.
Não deve tomar uma dose dupla para compensar a dose omitida.
Interrupção do tratamento com o medicamento Flixotide
É muito importante tomar o medicamento Flixotide todos os dias, até que o médico não recomende interromper o tratamento. Não deve interromper abruptamente o tratamento com Flixotide, pois os sintomas da doença podem se agravar e podem ocorrer distúrbios hormonais no organismo.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar o médico ou farmacêutico.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não todos os pacientes os apresentem.
Abaixo estão listados os efeitos secundários observados em pacientes que tomaram o medicamento Flixotide.
Reações alérgicas: deve procurar imediatamente um médico
Reações alérgicasao medicamento Flixotide, que ocorrem não muito frequentemente (podem ocorrer em 1 a 10
em 1000 pacientes que tomam o medicamento).Caracterizam-se por sintomas como:
- erupção cutânea (urticária) ou vermelhidão.
Reações alérgicasao medicamento Flixotide, que ocorrem muito raramente (podem ocorrer em menos
de1 em 10 000 pacientes que tomam o medicamento), e em uma pequena quantidade de pacientes, essas reações podem se desenvolver em uma condição grave, potencialmente ameaçadora da vida, se não forem tratadas. Caracterizam-se por sintomas como:
- inchaço (principalmente da face, lábios, boca, língua ou garganta), que pode causar dificuldade para engolir ou respirar,
- aparição súbita de dificuldade para respirar ou agravamento súbito da respiração wheezing (broncoconstrição),
- aparição súbita de fraqueza ou tontura (que pode levar a uma queda ou perda de consciência). ➔
Em caso de ocorrência desses sintomas, deve interromper o uso do medicamento e contatar imediatamente um médico, que prescreverá o tratamento adequado.
Outros efeitos secundários:
Efeitos secundários muito frequentes( podem ocorrer em mais de 1 em 10 pacientes):
- Candidíase (lesões dolorosas, crostas amareladas) na boca e garganta, dificuldade para engolir. Pode ser útil enxaguar a boca com água e cuspir após a inalação. O médico pode prescrever um medicamento antifúngico adicional para tratar a candidíase.
Efeitos secundários frequentes( podem ocorrer em 1 a 10 em 100 pacientes):
- Ronco, perda de voz. Pode ser útil enxaguar a boca com água e cuspir após a inalação.
- Pneumonia foi relatada em pacientes com doença pulmonar obstrutiva crônica (DPOC).
- Sangramento nasal.
Efeitos secundários raros( podem ocorrer em 1 a 10 em 10 000 pacientes):
- Candidíase no esôfago.
Efeitos secundários muito raros( podem ocorrer em menos de 1 em 10 000 pacientes):
- O medicamento Flixotide pode ter um efeito inibidor na produção normal de hormônios esteroides pelo organismo, especialmente em caso de doses elevadas do medicamento por um longo período. Os sintomas incluem: retardamento do crescimento em crianças e jovens, redução da densidade óssea, catarata, glaucoma, aumento de peso, redondeamento da face (forma lunar), hipertensão, convulsões.
- Aumento da glicemia (hiperglicemia). Em pacientes com diabetes, pode ser necessário monitorar mais frequentemente a glicemia e ajustar a dose de medicamentos antidiabéticos atualmente utilizados.
- Dor nas articulações.
- Dispepsia.
- Ansiedade, distúrbios do sono e alterações de comportamento, incluindo hiperatividade e irritabilidade. A ocorrência desses efeitos é mais provável em crianças.
Efeitos secundários com frequência desconhecida( frequência não pode ser estimada com base nos dados disponíveis):
- Depressão e agressividade. A ocorrência desses efeitos é mais provável em crianças.
- Sangramento nasal.
- Visão turva.
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Medicamentos da Agência Nacional de Vigilância Sanitária:
Rua São Paulo, 1000
01311-100 São Paulo
Telefone: +55 11 3207 6000
Fax: +55 11 3207 6001
Site: https://www.anvisa.gov.br
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização ou ao seu representante.
A notificação de efeitos secundários pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como armazenar o medicamento Flixotide
Armazenar em temperatura abaixo de 30 °C. Proteger da luz, não congelar.
Armazenar em local inacessível e fora do alcance das crianças.
Armazenar na posição vertical. Agitar antes de usar.
Não usar o medicamento após o vencimento da data de validade impressa na embalagem: VENC.
A data de validade indica o último dia do mês indicado.
O número do lote do medicamento está impresso na embalagem: LOTE.
Após a abertura do sachê, armazenar o produto em recipientes plásticos, protegendo da luz, por no máximo 28 dias.
O medicamento deve ser descartado se não for utilizado imediatamente após a abertura do recipiente plástico.
Os medicamentos não devem ser jogados na rede de esgoto ou em lixeiras domésticas. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Flixotide, suspensão para nebulização
- A substância ativa do medicamento é fluticasona propionato (micronizado). 2 ml da suspensão (1 recipiente plástico) contém 0,5 mg ou 2 mg (miligramas) de fluticasona propionato (micronizado).
- Os outros componentes são: polissorbato 20, sorbitan lauril, fosfato de sódio di-hidratado, fosfato de sódio anidro, cloreto de sódio, água para injeção.
Como é o medicamento Flixotide, suspensão para nebulização e o que contém a embalagem
10 recipientes (2 sachês com 5 recipientes cada) em uma caixa de papelão.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização:
GlaxoSmithKline (Ireland) Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
Irlanda
Fabricante:
GlaxoSmithKline Trading Services Limited
12 Riverwalk,
Citywest Business Campus
Dublin 24,
Irlanda
Para obter informações mais detalhadas, deve contatar o representante do titular da autorização de comercialização:
GSK Services Sp. z o.o.
ul. Rzymowskiego 53
02-697 Warszawa
telefone: (0-22) 576 9000
{Logo do titular da autorização de comercialização}
Data da última atualização do folheto: novembro de 2020
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorGlaxoSmithKline Trading Services Limited
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FlixotideForma farmacêutica: Pó, 250 mcg/dose inh.Substância ativa: fluticasoneRequer receita médicaForma farmacêutica: Pó, 500 mcg/dose inh.Substância ativa: fluticasoneRequer receita médicaForma farmacêutica: Pó, 50 mcg/dose inh.Substância ativa: fluticasoneRequer receita médica
Alternativas a Flixotide noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Flixotide em Ukraine
Alternativa a Flixotide em Espanha
Médicos online para Flixotide
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Flixotide – sujeita a avaliação médica e regras locais.