
Cluvot 1250 i.m.
Pergunte a um médico sobre a prescrição de Cluvot 1250 i.m.

Como usar Cluvot 1250 i.m.
Folheto informativo para o paciente: informação para o paciente
Cluvot 1250 j.m.
pó e solvente para a preparação de uma solução para injeção/infusão
Fator XIII da coagulação sanguínea humano
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve guardar este folheto, para que possa lê-lo novamente se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para uma pessoa. Não deve ser dado a outras pessoas. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito colateral, incluindo qualquer efeito colateral não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Sumário do folheto
- 1. O que é Cluvot e para que é utilizado
- 2. Informações importantes antes de tomar Cluvot
- 3. Como tomar Cluvot
- 4. Efeitos colaterais possíveis
- 5. Como armazenar Cluvot
- 6. Conteúdo da embalagem e outras informações
1. O que é Cluvot e para que é utilizado
O que é Cluvot
Cluvot é um medicamento disponível em forma de pó branco e solvente. A solução preparada deve ser administrada por injeção intravenosa.
Cluvot é um fator XIII da coagulação sanguínea humano (F XIII) produzido a partir de plasma humano (é a parte líquida do sangue) e desempenha um papel importante no processo de hemostasia (parando o sangramento).
Para que é utilizado Cluvot
Cluvot é indicado para uso em adultos, crianças e adolescentes.
- para o tratamento profilático da deficiência congênita de fator XIII e
- no tratamento perioperatório para o tratamento de sangramentos durante procedimentos cirúrgicos em pacientes com deficiência congênita de fator XIII.
2. Informações importantes antes de tomar Cluvot
Esta parte do folheto contém informações que devem ser consideradas antes de iniciar o tratamento com Cluvot.
Quando não tomar Cluvot:
- se o paciente tiver alergia à substância ativa ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Deve informar o médico se tiver hipersensibilidade a qualquer medicamento ou alimento.
Advertências e precauções:
- se reações alérgicas ao fator XIII da coagulação sanguínea ocorreram no passado. Profilaticamente, deve-se administrar medicamentos antihistamínicos e corticosteroides se o médico decidir.
- quando ocorrerem sintomas alérgicos ou reações anafiláticas (sintomas alérgicos graves podem causar dificuldade respiratória ou tontura). A administração de Cluvot deve ser interrompida imediatamente (ou seja, interromper a injeção ou infusão). Em caso de choque, deve-se administrar tratamento de acordo com os padrões médicos atuais.
- se ocorreu trombose recente (coágulo sanguíneo). Deve-se monitorar o paciente devido à ação estabilizadora da fibrina do F XIII.
- a formação de inibidores (anticorpos neutralizantes) é conhecida como uma complicação do tratamento e significa que o tratamento deixa de ser eficaz. Se o sangramento não for controlado com o medicamento Cluvot, deve-se informar o médico imediatamente. O paciente deve ser monitorado cuidadosamente para o desenvolvimento (aparição) de inibidores.
O médico deve sempre considerar os benefícios do tratamento em relação ao risco de complicações.
Segurança contra vírus
Quando os medicamentos são produzidos a partir de sangue ou plasma humano, são tomadas várias medidas para proteger o paciente contra a transmissão de agentes infecciosos. Essas medidas incluem:
- seleção apropriada de doadores de sangue e plasma para excluir o risco de transmissão de agentes infecciosos
- teste de cada doação e pool de plasma para a presença de marcadores virais/infecções.
- inclusão no processo de fabricação de produtos de sangue ou plasma de etapas que podem inativar ou remover vírus.
Apesar da implementação dessas medidas, não é possível excluir completamente a possibilidade de transmissão de agentes infecciosos após a administração de um produto medicamentoso derivado de sangue ou plasma humano. Esse risco também se aplica a vírus desconhecidos ou recentemente descobertos e outros agentes infecciosos.
As medidas de segurança tomadas são eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV, vírus que causa a AIDS), vírus da hepatite B (HBV, que causa hepatite B) e vírus da hepatite C (HCV, que causa hepatite C), bem como contra vírus não envelopados, como o vírus da hepatite A (HAV, que causa hepatite A) e parvovirus B 19.
Em pacientes que recebem produtos derivados de plasma humano repetidamente, deve-se considerar a vacinação contra a hepatite A e B.
Recomenda-se que, sempre que Cluvot for administrado, a data de administração, o número de lote e o volume administrado sejam registrados na documentação do paciente.
Cluvot e outros medicamentos
- Deve informar o médico ou farmacêutico sobre a ingestão de outros medicamentos, incluindo aqueles disponíveis sem prescrição.
- Não é conhecida a ocorrência de interações entre o concentrado de fator XIII da coagulação sanguínea e outros produtos medicamentosos.
- Cluvot não deve ser misturado com outros produtos medicamentosos, solventes ou diluentes, exceto aqueles mencionados no ponto 6, e deve ser administrado por meio de conjuntos de infusão separados.
Gravidez e amamentação
- Se a paciente estiver grávida ou amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
- Dados limitados sobre o uso clínico de Cluvot durante a gravidez não mostraram efeitos negativos na gravidez e no desenvolvimento embrionário e pós-natal. Em caso de necessidade, pode-se considerar a administração de Cluvot durante a gravidez.
- Não é conhecido o grau de penetração de Cluvot no leite humano, mas considerando sua alta massa molecular, a probabilidade de excreção no leite materno é muito baixa, e devido à sua natureza proteica, a absorção de partículas intactas pelo recém-nascido também é improvável. Portanto, Cluvot pode ser administrado durante a amamentação.
- Não há dados sobre o efeito de Cluvot na fertilidade.
Condução de veículos e operação de máquinas
Não foram realizados estudos sobre o efeito na capacidade de conduzir veículos e operar máquinas.
Informações importantes sobre alguns componentes de Cluvot
Cluvot contém sódio.
Deve-se ter em mente que Cluvot contém sódio. Isso é importante para pacientes em dieta controlada de baixo teor de sódio. Cluvot contém de 124,4 a 195,4 mg (5,41 a 8,50 mmol) de sódio por dose (40 j.m./kg de peso corporal - com peso corporal médio de 70 kg), se a dose recomendada for administrada (2800 j.m. = 44,8 ml)
3. Como tomar Cluvot
- Cluvot é geralmente administrado por um médico.
- Cluvot é destinado exclusivamente para administração intravenosa.
Dosagem
O médico deve calcular a dose adequada e decidir com que frequência Cluvot deve ser administrado ao paciente, considerando o progresso do tratamento.
Recomendações mais detalhadas, ver ponto: “Informação destinada exclusivamente ao pessoal médico
ou profissionais de saúde”.
Sobredosagem
Não foram relatados casos de sobredosagem e não se espera que ocorram em caso de administração deste medicamento por pessoal médico.
4. Efeitos colaterais possíveis
Como qualquer medicamento, este medicamento pode causar efeitos colaterais, embora não em todos os pacientes.
Os seguintes efeitos colaterais foram observados raros(ocorreram em mais de 1 em 10.000 pacientes e menos de 1 em 1.000)
- Reações alérgicas, como urticária generalizada (inchaço pruriginoso na pele), erupção cutânea, hipotensão (que pode causar sensação de desmaio ou tontura), dificuldade respiratória.
- Aumento da temperatura corporal
Os seguintes efeitos colaterais foram observados muito raros(ocorreram em menos de 1 em 10.000 pacientes):
- Formação de inibidores do F XIII.
Se ocorrerem reações alérgicas, a administração do medicamento Cluvot deve ser interrompida imediatamente e deve-se iniciar o tratamento adequado. Devem ser aplicados os padrões médicos atuais para o tratamento do choque.
Efeitos colaterais em crianças e adolescentes
Espera-se que os efeitos colaterais em crianças sejam os mesmos que em adultos.
Notificação de efeitos colaterais
Se ocorrerem algum efeito colateral, incluindo qualquer efeito colateral não mencionado no folheto, deve-se informar o médico ou farmacêutico. Efeitos colaterais podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Colaterais de Produtos Medicamentosos da Agência Reguladora de Produtos Medicamentosos, Dispositivos Médicos e Produtos Biocidas Al. Jerozolimskie 181C, 02-222 Varsóvia Tel.: + 48 22 49 21 301 Fax: + 48 22 49 21 309 Site: https://smz.ezdrowie.gov.pl Efeitos colaterais também podem ser notificados ao titular da autorização de comercialização. A notificação de efeitos colaterais pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como armazenar Cluvot
- Armazenar na geladeira (2°C - 8°C).
- Não congelar.
- Armazenar na embalagem exterior para proteger da luz.
- Cluvot não contém conservantes. O medicamento deve ser usado imediatamente após a reconstituição. Se não for usado imediatamente, o armazenamento à temperatura ambiente não deve exceder 4 horas. Não armazenar na geladeira e não congelar a solução após a reconstituição.
- O medicamento deve ser armazenado em local não acessível e invisível para crianças.
- Não usar Cluvot após a data de validade impressa na etiqueta e embalagem exterior após a abreviação EXP.
- O número de lote do produto medicamentoso está impresso na embalagem exterior e etiqueta após a abreviação: Lote.
6. Conteúdo da embalagem e outras informações
O que contém Cluvot Substância ativa:
Concentrado de fator XIII da coagulação sanguínea humano (FXIII) contendo 1250 j.m. por frasco.
Substâncias auxiliares:
Albumina humana, glicose monohidratada, cloreto de sódio, hidróxido de sódio (em pequenas quantidades para ajustar o pH).
Solvente:Água para injeção
Como é Cluvot e o que a embalagem contém
Cluvot é apresentado em forma de pó branco e solvente anexo, que é água para injeção. A solução preparada deve ser incolor, clara ou ligeiramente opalescente. Ao ser mantida à luz, não deve ser turva ou conter resíduos (grumos/partículas).
Tamanhos da embalagem
Uma embalagem de 1250 j.m. contém:
1 frasco com pó
1 frasco com 20 ml de água para injeção
1 sistema de transferência 20/20 com filtro (Mix2Vial)
Conjunto para administração (embalagem interior);
1 seringa de uso único de 20 ml
1 conjunto para punção
2 algodões embebidos em álcool
1 adesivo não estéril
Titular da autorização de comercialização e fabricante
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg
Alemanha
Data da última atualização do folheto:agosto de 2021
----------------------------------------------------------------------------------------------------------------------
Informações destinadas exclusivamente ao pessoal médico: Dosagem
1 ml corresponde aproximadamente a 62,5 j.m., e 100 j.m. é equivalente a 1,6 ml.
Importante:
A quantidade necessária para a administração e a frequência de administração devem ser sempre adaptadas à eficácia clínica em cada paciente.
Dosagem
A dosagem deve ser individualizada com base no peso corporal, resultados de exames laboratoriais e estado clínico do paciente.
Esquema de dosagem rotineiro para profilaxia
Dose inicial
- 40 unidades internacionais (j.m.) por quilograma de peso corporal.
- A velocidade de infusão não deve ser maior que 4 ml por minuto
Doses subsequentes
- A dosagem deve ser determinada com base no nível atual de atividade do FXIII, e as doses devem ser administradas em intervalos de 28 dias (4 semanas) para manter a atividade mínima do F XIII em níveis de aproximadamente 5 a 20%.
- Ajuste da dosagem recomendado de +/- 5 j.m. por kg de peso corporal deve ser calculado com base no nível mínimo de atividade do F XIII, como mostrado na tabela 1, e no estado clínico do paciente.
- O ajuste da dosagem deve ser feito com base em um teste específico e sensível usado para determinar o nível de F XIII. Exemplos de ajuste usando o teste de atividade Berichrom são apresentados na tabela 1 abaixo.
Tabela 1: Ajuste da dosagem usando o teste de atividade Berichrom
A atividade expressa em unidades é determinada usando o teste de atividade Berichrom, referenciado ao Padrão Internacional atual para o Fator XIII da Coagulação Sanguínea. Portanto, a unidade corresponde à Unidade Internacional.
| Nível mínimo de atividade do fator XIII (%) | Mudança na dosagem |
| Um nível mínimo <5% | Aumento de 5 unidades por kg. |
| Nível mínimo 5% a 20% | Sem alterações |
| Dois níveis mínimos > 20% | Redução de 5 unidades por kg. |
| Um nível mínimo > 25% | Redução de 5 unidades por kg. |
Profilaxia pré-operatória.
Após a última dose administrada na profilaxia rotineira, em caso de procedimento cirúrgico planejado:
- Entre 21 e 28 dias após a última dose - deve-se administrar ao paciente a dose completa imediatamente antes do procedimento cirúrgico, e a próxima dose de profilaxia deve ser administrada 28 dias depois.
- Entre 8 e 21 dias após a última dose - uma dose adicional (completa ou parcial) pode ser administrada antes do procedimento cirúrgico. A dose deve ser baseada no nível de atividade do FXIII do paciente, seu estado clínico e deve ser adaptada de acordo com o período de meia-vida do produto medicamentoso Cluvot.
- Dentro de 7 dias após a última dose - a administração adicional pode não ser necessária.
O ajuste da dosagem pode ser diferente da dosagem recomendada e deve ser individualizado com base no nível de atividade do F XIII e no estado clínico do paciente. Todos os pacientes devem ser monitorados cuidadosamente durante e após o procedimento cirúrgico.
Portanto, é recomendado monitorar o aumento do nível de atividade do F XIII com base no teste do fator XIII. Em caso de procedimentos cirúrgicos graves e sangramentos significativos, o objetivo deve ser atingir níveis próximos dos normais (indivíduos saudáveis: 70%-140%).
Crianças e adolescentes
A dosagem e a forma de administração em crianças e adolescentes são baseadas no peso corporal e, portanto, geralmente não diferem das diretrizes para adultos. A dosagem e/ou a frequência de administração para cada paciente devem ser sempre adaptadas com base na eficácia clínica e no nível de atividade do FXIII.
Pacientes idosos
A dosagem e a forma de administração em pacientes idosos (> 65 anos) não foram documentadas em estudos clínicos.
Forma de administração
Recomendações gerais
A solução deve ser clara ou ligeiramente opalescente. Após a filtragem/retirada do conteúdo do frasco (ver abaixo), o produto reconstituído antes da administração deve ser submetido a uma avaliação visual; deve-se verificar se não ocorreram contaminações ou alterações na cor.
Não usar soluções turvas ou que contenham partículas ou grumos.
A reconstituição e a retirada do frasco devem ser realizadas em condições assépticas.
Reconstituição
Levar o solvente à temperatura ambiente. Retirar as tampas plásticas dos frascos contendo o pó e o solvente e limpar os cortes com solução asséptica. Após a secagem, abrir o sistema que contém o conector Mix2Vial.
1 |
|
2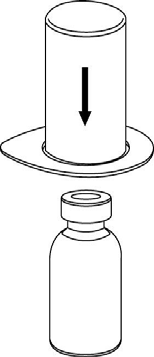 |
|
3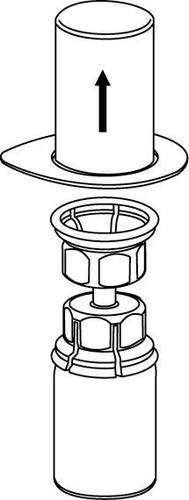 |
|
4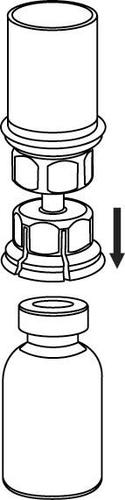 |
|
5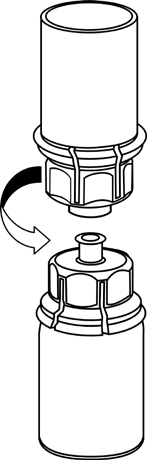 |
|
6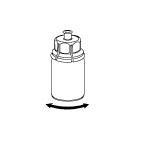 |
|
7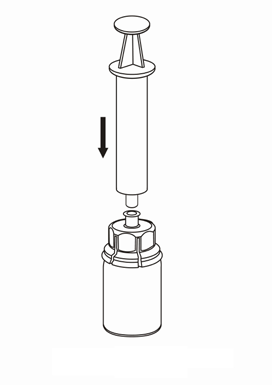 |
|
Retirada e forma de administração
8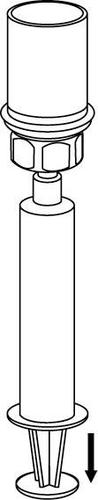 |
|
9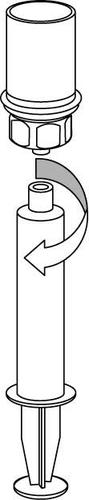 |
|
Deve-se ter cuidado para que o sangue não entre na seringa contendo o produto medicamentoso, pois há o risco de que o sangue coagule na seringa e que coágulos de fibrina sejam administrados ao paciente.
A solução reconstituída deve ser administrada em conjuntos de injeção/infusão separados (fornecidos com o produto), em injeção intravenosa lenta, com velocidade não superior a 4 ml por minuto.
Qualquer produto medicamentoso não utilizado e seus resíduos devem ser eliminados de acordo com os requisitos locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorCSL Behring GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Cluvot 1250 i.m.Forma farmacêutica: Pó, 250 UISubstância ativa: coagulation factor XIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 2000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Cluvot 1250 i.m. noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Cluvot 1250 i.m. em Espanha
Médicos online para Cluvot 1250 i.m.
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Cluvot 1250 i.m. – sujeita a avaliação médica e regras locais.














