
Cernevit

Pergunte a um médico sobre a prescrição de Cernevit

Como usar Cernevit
Folheto informativo para o utilizador
CERNEVIT, pó de vitamina para solução para injeção e infusão
Antes de tomar o medicamento, deve ler atentamente o conteúdo do folheto, pois contém informações importantes para o paciente.
informações importantes para o paciente.
- Deve conservar este folheto para poder reler caso necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- O medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento CERNEVIT e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento CERNEVIT
- 3. Como tomar o medicamento CERNEVIT
- 4. Efeitos não desejados
- 5. Como conservar o medicamento CERNEVIT
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento CERNEVIT e para que é utilizado
O CERNEVIT é um pó de vitamina para solução para injeção e infusão.
Contém 12 vitaminas:
| Substâncias ativas | O que corresponde | ||
| retinol palmítico | 3500 UI | vitamina A | 3500 UI |
| colecalciferol | 220 UI | vitamina D3 | 220 UI |
| DL-α-tocoferol | 10,20 mg | vitamina E | 11,20 UI |
| ácido ascórbico | 125 mg | vitamina C | 125 mg |
| co carboksilase tetrahidratada | 5,80 mg | vitamina B1 (tiamina) | 3,51 mg |
| sódio fosfato de riboflavina | 5,67 mg | vitamina B2 (riboflavina) | 4,14 mg |
| piridoxina cloridrato | 5,50 mg | vitamina B6 (piridoxina) | 4,53 mg |
| ciânocobalamina | 6 µg | vitamina B12 | 6 µg |
| ácido fólico | 414 µg | ácido fólico | 414 µg |
| dexpanthenol | 16,15 mg | ácido pantotênico | 17,25 mg |
| biotina | 69 µg | biotina | 69 µg |
| nicotinamida | 46 mg | vitamina PP | 46 mg |
O CERNEVIT fornece vitaminas aos pacientes alimentados por via intravenosa (gotejamento).
2. Informações importantes antes de tomar o medicamento CERNEVIT
Quando não tomar o medicamento CERNEVIT
- se o paciente tiver alergia (hipersensibilidade) às substâncias ativas ou a qualquer um dos outros componentes do medicamento, especialmente vitamina B1, proteínas de soja ou amendoins (ver ponto 6. Conteúdo do pacote e outras informações)
- em pacientes com menos de 11 anos de idade
- se o paciente tiver hipervitaminose de qualquer uma das vitaminas contidas no produto CERNEVIT
Precauções e advertências
Antes de iniciar o tratamento com CERNEVIT, deve informar o médico, farmacêutico ou enfermeiro:
- se o paciente tiver doença hepática,
- se o paciente tiver doença renal,
- se o paciente tiver epilepsia,
- se o paciente tiver doença de Parkinson.
Interacções com outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o paciente planeja tomar, incluindo os disponíveis sem prescrição.
Deve ter cuidado especial se o paciente estiver tomando algum dos seguintes tipos de medicamentos:
- L-Dopa (usado no tratamento da doença de Parkinson),
- fenobarbital, fenitoína e (ou) primidona (usados no tratamento da epilepsia) O médico pode monitorar os níveis desses medicamentos no sangue do paciente e ajustar as doses adequadamente quando o paciente iniciar ou parar de tomar o medicamento CERNEVIT.
Alterações nos testes laboratoriais
O CERNEVIT contém 69 microgramas de biotina por 5 ml. Se o paciente for submetido a testes laboratoriais, deve informar o médico ou o pessoal do laboratório de que tomou recentemente o medicamento CERNEVIT, pois a biotina pode interferir nos resultados desses testes. Dependendo do teste, os resultados podem ser falsamente elevados ou falsamente baixos devido à biotina. O médico pode ordenar a interrupção da administração do medicamento CERNEVIT antes de realizar os testes laboratoriais. Além disso, também é importante lembrar que outros produtos eventualmente tomados, como suplementos multivitamínicos ou suplementos dietéticos usados para melhorar o cabelo, a pele e as unhas, também podem conter biotina e afetar os resultados dos testes laboratoriais. Se o paciente estiver tomando esses produtos, deve informar o médico ou o pessoal do laboratório.
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou amamentando, achar que pode estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
Gravidez
Se necessário, o medicamento pode ser administrado a uma mulher grávida, desde que sejam seguidas as indicações e doses recomendadas, para evitar a sobredose de vitaminas.
Amamentação
A administração do produto CERNEVIT durante a amamentação não é recomendada.
Se a paciente estiver amamentando e também estiver tomando CERNEVIT, há o risco de sobredose de vitamina A no bebê.
Fertilidade
Não há dados disponíveis sobre o efeito do medicamento CERNEVIT na fertilidade de homens ou mulheres.
3. Como tomar o medicamento CERNEVIT
O CERNEVIT será administrado por pessoal médico qualificado. Geralmente, é administrado por injeção intravenosa.
A dose recomendada é de 1 frasco por dia.
Sobredose do medicamento CERNEVIT
Nesse caso, os sintomas de sobredose do medicamento CERNEVIT são principalmente sintomas relacionados à sobredose de vitamina A:
- os sintomas de sobredose aguda de vitamina A são:
- distúrbios gastrointestinais (náuseas, vômitos),
- distúrbios do sistema nervoso (dor de cabeça, edema do nervo óptico, convulsões) causados pelo aumento da pressão intracraniana do paciente,
- distúrbios psiquiátricos (irritabilidade),
- distúrbios da pele (descamação retardada da pele).
- os sintomas de sobredose crônica de vitamina A são:
- dor de cabeça causada pelo aumento da pressão intracraniana do paciente,
- doenças ósseas (sensibilidade ou inchaço doloroso nas extremidades).
Se ocorrer algum desses sintomas de sobredose, deve informar o médico. O médico pode interromper a administração do medicamento CERNEVIT.
Em caso de dúvidas adicionais relacionadas à administração deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Os seguintes efeitos não desejados são comuns e ocorrem em 1 a 10 de cada 100 pacientes:
- dor no local da injeção.
Os seguintes efeitos não desejados são raros e ocorrem em 1 a 10 de cada 1000 pacientes:
- náuseas (enjoo), vômitos.
Os seguintes efeitos não desejados ocorrem com frequência não conhecida:
- reações alérgicas, com distúrbios respiratórios, dor no peito, edema da garganta, urticária, erupção cutânea, rubor, desconforto abdominal, bem como com parada cardíaca,
- aumento dos níveis de vitamina A e proteínas transportadoras de vitamina A no sangue,
- distúrbios do paladar (sabor metálico na boca),
- taquicardia,
- taquipneia,
- diarreia,
- aumento dos níveis de enzimas hepáticas e ácidos biliares,
- prurido,
- febre, dor generalizada, reações no local da injeção, como sensação de queimadura, erupção cutânea.
Deve informar o médico imediatamente se ocorrerem sintomas de reação alérgica, como distúrbios respiratórios, dor no peito, edema da garganta, urticária, erupção cutânea, rubor, desconforto abdominal. O médico pode interromper a administração do medicamento e tomar as medidas necessárias.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, deve consultar o médico ou enfermeiro.
Isso inclui qualquer efeito não desejado não mencionado neste folheto.
Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
PL 02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
e-mail: [email protected]
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento CERNEVIT
O medicamento deve ser conservado em local não visível e inacessível às crianças.
Conservar em temperatura ambiente, entre 15°C e 25°C. Proteger da luz.
Conservar no pacote exterior de cartão.
Após a reconstituição, o produto mantém a estabilidade química e física por 24 horas a 25°C.
Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente após a reconstituição.
Caso contrário, a responsabilidade pelo tempo e condições de armazenamento até o uso cabe à pessoa que administra o medicamento, e o armazenamento não deve exceder 24 horas a 2-8°C, a menos que a reconstituição tenha sido feita em condições assépticas controladas e validadas.
Não usar este medicamento após o prazo de validade impresso no pacote após "Prazo de validade". O prazo de validade é o último dia do mês indicado.
Os medicamentos não devem ser jogados na canalização ou lixeiras domésticas. Deve-se perguntar ao farmacêutico como descartar os medicamentos que não são mais necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento CERNEVIT
- As substâncias ativas do medicamento são:
1 frasco de 5 ml contém:
| Substâncias ativas | O que corresponde | ||
| retinol palmítico | 3500 UI | vitamina A | 3500 UI |
| colecalciferol | 220 UI | vitamina D3 | 220 UI |
| DL-α-tocoferol | 10,20 mg | vitamina E | 11,20 UI |
| ácido ascórbico | 125 mg | vitamina C | 125 mg |
| co carboksilase tetrahidratada | 5,80 mg | vitamina B1 (tiamina) | 3,51 mg |
| sódio fosfato de riboflavina | 5,67 mg | vitamina B2 (riboflavina) | 4,14 mg |
| piridoxina cloridrato | 5,50 mg | vitamina B6 (piridoxina) | 4,53 mg |
| ciânocobalamina | 6 µg | vitamina B12 | 6 µg |
| ácido fólico | 414 µg | ácido fólico | 414 µg |
| dexpanthenol | 16,15 mg | ácido pantotênico | 17,25 mg |
| biotina | 69 µg | biotina | 69 µg |
| nicotinamida | 46 mg | vitamina PP | 46 mg |
UI = Unidades Internacionais
mg = miligramas
Os outros componentes são: glicina, fosfolipídios de soja, ácido glicocólico, hidróxido de sódio e ácido clorídrico.
O CERNEVIT contém 24 mg de sódio (1 mmol) por frasco. Isso deve ser considerado em pacientes com dieta controlada de sódio.
Como é o medicamento CERNEVIT e o que contém o pacote
O CERNEVIT é fornecido em frascos de vidro marrom. Para preparar a solução para infusão, o pessoal médico qualificado pode usar um kit BIO-SET, que facilita a reconstituição do medicamento CERNEVIT.
O CERNEVIT é fornecido em pacotes contendo 10 ou 20 frascos, com ou sem o kit BIO-SET.
Nem todos os tamanhos de pacotes podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Varsóvia
Fabricante
Baxter SA
Boulevard René Branquart 80
7860 Lessines, Bélgica
Para obter mais informações, deve contatar o representante do titular da autorização de comercialização.
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Varsóvia
tel.: (22) 488 37 77
Data da última atualização do folheto: 26.03.2019
--------------------------------------------------------------------------------------------------------------
As seguintes informações são destinadas apenas ao médico ou pessoal médico qualificado
Composição qualitativa e quantitativa
1 frasco de 5 ml contém:
| Substâncias ativas | O que corresponde | ||
| retinol palmítico | 3500 UI | vitamina A | 3500 UI |
| colecalciferol | 220 UI | vitamina D3 | 220 UI |
| DL-α-tocoferol | 10,20 mg | vitamina E | 11,20 UI |
| ácido ascórbico | 125 mg | vitamina C | 125 mg |
| co carboksilase tetrahidratada | 5,80 mg | vitamina B1 (tiamina) | 3,51 mg |
| sódio fosfato de riboflavina | 5,67 mg | vitamina B2 (riboflavina) | 4,14 mg |
| piridoxina cloridrato | 5,50 mg | vitamina B6 (piridoxina) | 4,53 mg |
| ciânocobalamina | 6 µg | vitamina B12 | 6 µg |
| ácido fólico | 414 µg | ácido fólico | 414 µg |
| dexpanthenol | 16,15 mg | ácido pantotênico | 17,25 mg |
| biotina | 69 µg | biotina | 69 µg |
| nicotinamida | 46 mg | vitamina PP | 46 mg |
Os componentes inertes são: glicina, fosfolipídios de soja, ácido glicocólico, hidróxido de sódio e ácido clorídrico
Aparência da solução
Após a reconstituição, a solução obtida tem cor amarelo-alaranjada.
Posologia e modo de administração
Apenas para adultos e crianças com mais de 11 anos
1 frasco por dia.
Administrar por injeção lenta intravenosa ou por infusão intravenosa, ou por injeção lenta intramuscular.
Modo de administração
- administração intravenosaModo de reconstituição: ver as instruções abaixo.
Após a reconstituição: injetar lentamente (pelo menos 10 minutos; ver o ponto Advertências) por via intravenosa ou por infusão intravenosa em solução de cloreto de sódio a 0,9% ou glicose a 5%.
A administração pode ser continuada por todo o período de nutrição parenteral. Com o objetivo de atender às necessidades nutricionais e prevenir deficiências e possíveis complicações decorrentes delas
O CERNEVIT pode ser adicionado a misturas nutricionais contendo carboidratos, gorduras, aminoácidos e eletrólitos, desde que seja verificada a compatibilidade e estabilidade em relação a cada produto que compõe a mistura nutricional.
- administração intramuscularModo de reconstituição: ver as instruções abaixo.
Deve-se considerar a quantidade total de vitaminas provenientes de todas as fontes, como outras formas de nutrição, administração de outras vitaminas ou medicamentos que contenham vitaminas como componentes inativos (ver o ponto Interacções).
O estado clínico do paciente e os níveis de vitaminas devem ser monitorados para manter os níveis adequados.
Deve-se considerar que algumas vitaminas, especialmente A, B e B, são sensíveis à luz ultravioleta (por exemplo, luz solar direta e indireta). Além disso, o excesso de oxigênio na solução pode aumentar a perda de vitaminas A, B, C e E. Deve-se considerar esses fatores se os níveis adequados de vitaminas não forem alcançados.
Contraindicações
O produto CERNEVIT não deve ser usado:
- em caso de hipersensibilidade à substância ativa ou a qualquer um dos componentes do medicamento, especialmente vitamina B1 ou a qualquer um dos componentes inertes, incluindo proteínas de soja e amendoins (ver o ponto 6. Conteúdo do pacote e outras informações)
- em crianças com menos de 11 anos de idade
- em caso de hipervitaminose de qualquer uma das vitaminas contidas no produto.
Advertências e precauções especiais
Advertências
Reações de hipersensibilidade
- Para o produto CERNEVIT, outros produtos multivitamínicos e vitaminas individuais (especialmente B1, B2, B6 e ácido fólico) foram relatados casos de reações de hipersensibilidade graves e generalizadas. Para o produto CERNEVIT e outros produtos de vitaminas administrados por via parenteral, foram relatados casos de reações com resultado fatal.
- Foi observada a ocorrência de alergia cruzada entre proteínas de soja e amendoins
- Em alguns casos, a ocorrência de reações de hipersensibilidade após a administração intravenosa de produtos multivitamínicos pode estar relacionada à velocidade de administração. No caso de administração por infusão intravenosa, o produto CERNEVIT deve ser administrado lentamente. No caso de administração por injeção intravenosa, deve-se administrar lentamente (a injeção deve durar pelo menos 10 minutos).
Toxidade das vitaminas
- O estado clínico do paciente e os níveis de vitaminas no sangue devem ser monitorados para evitar a sobredose e a toxicidade, especialmente das vitaminas A, D e E, e especialmente em pacientes que recebem suplementação adicional de vitaminas ou usam outros fatores que aumentam o risco de toxicidade das vitaminas.
- A monitorização é especialmente importante em pacientes que recebem suplementação por longo prazo.
Hipervitaminose A
- O risco de hipervitaminose A e toxicidade da vitamina A (por exemplo, alterações na pele e nos ossos, visão dupla, cirrose hepática) é aumentado, por exemplo:
- em pacientes com deficiência de proteínas
- em pacientes com insuficiência renal (mesmo sem suplementação de vitamina A)
- em pacientes com insuficiência hepática
- em pacientes com baixo peso corporal (por exemplo, pacientes pediátricos)
- e em pacientes submetidos a tratamento crônico.
- Doenças hepáticas agudas em pacientes com grandes reservas de vitamina A no fígado podem levar à ocorrência de sintomas de toxicidade da vitamina A.
Síndrome de realimentação em pacientes submetidos a nutrição parenteral
A suplementação de nutrientes em pacientes gravemente desnutridos pode causar uma síndrome de sintomas relacionados, caracterizada pela transferência de potássio, fósforo e magnésio para o espaço intracelular, pois o paciente começa a predominar o metabolismo anabólico. Também pode ocorrer deficiência de tiamina e retenção de líquidos no organismo. O monitoramento cuidadoso e o aumento gradual da suplementação de nutrientes, evitando a sobrealimentação, podem prevenir essas complicações. Em caso de deficiências nutricionais, pode ser justificada a suplementação adequada.
Precipitação em pacientes submetidos a nutrição parenteral
Em pacientes submetidos a nutrição parenteral, foram relatados casos de precipitação em vasos pulmonares. Alguns casos resultaram em morte. O excesso de cálcio e fosfato pode aumentar o risco de formação de precipitação de fosfato de cálcio. A ocorrência de precipitação foi relatada mesmo na ausência de sais de fosfato na solução. Também foi relatada a ocorrência de precipitação distante do filtro colocado na linha de infusão e a suspeita de formação de precipitação no sistema circulatório.
Além do monitoramento da solução, também é necessário verificar periodicamente o conjunto de infusão e o cateter em busca de precipitação.
Em caso de ocorrência de sintomas de distúrbios da função pulmonar, deve-se interromper a infusão e iniciar a avaliação clínica do paciente.
Verificar se o recipiente não está danificado.
Trabalhar em condições assépticas.
Não armazenar frascos parcialmente usados; não usar se a cor do produto após a reconstituição for inadequada.
Precauções especiais de armazenamento
Efeitos no fígado
- Em pacientes que recebem CERNEVIT, é recomendada a monitorização dos parâmetros de função hepática. É recomendada uma monitorização especial em pacientes com icterícia de origem hepática ou outros sinais de colestase. Em pacientes que recebem CERNEVIT, foram relatados casos de aumento da atividade de enzimas hepáticas, incluindo aumento isolado da atividade da aminotransferase alanina (ALT) em pacientes com doenças inflamatórias do intestino. Além disso, em pacientes que recebem CERNEVIT, foi observado aumento dos níveis de ácidos biliares (todos e individuais) no sangue.
- em alguns pacientes que recebem nutrição parenteral (incluindo nutrição parenteral com suplementação de vitaminas), ocorreu doença hepática e doença das vias biliares, incluindo colestase, esteatose, fibrose e cirrose hepática, que podem levar à insuficiência hepática, bem como pancreatite e colelitíase. Acredita-se que a etiologia dessas doenças seja multifatorial e possa variar de paciente para paciente. Pacientes que desenvolvem anormalidades nos resultados dos testes laboratoriais ou outros sinais de doença hepática e das vias biliares devem ser submetidos a exame por um médico com conhecimento em doenças hepáticas, com o objetivo de identificar os possíveis fatores causais e tomar as medidas terapêuticas e preventivas necessárias.
Uso em pacientes com distúrbios da função hepática
Pacientes com distúrbios da função hepática podem requerer suplementação individualizada de vitaminas.
Deve-se ter cuidado especial para evitar a toxicidade da vitamina A, pois a ocorrência de doença hepática está relacionada a uma maior susceptibilidade à toxicidade da vitamina A, especialmente em combinação com o consumo excessivo de álcool crônico (ver também "Hipervitaminose A" e "Efeitos no fígado").
Uso em pacientes com distúrbios da função renal
Pacientes com distúrbios da função renal podem requerer suplementação individualizada de vitaminas, dependendo do grau de lesão renal e da ocorrência de doenças concomitantes. Em pacientes com insuficiência renal grave, deve-se ter cuidado especial para manter os níveis adequados de vitamina D e evitar a toxicidade da vitamina A, que pode ocorrer nesses pacientes mesmo com a suplementação de pequenas doses de vitamina A ou mesmo sem suplementação.
Hipervitaminose e toxicidade (neuropatia periférica, movimentos involuntários) da piridoxina (vitamina B6) foram relatados em pacientes submetidos a hemodiálise crônica que receberam produtos multivitamínicos por via intravenosa, contendo 4 mg de piridoxina, administrados três vezes por semana.
Monitorização geral
Em pacientes que recebem produtos multivitamínicos por via intravenosa por longo prazo como única fonte de vitaminas, deve-se monitorar o estado clínico e os níveis de vitaminas. Isso é especialmente importante para garantir a suplementação adequada, por exemplo:
- vitamina A em pacientes com úlceras, feridas, queimaduras, síndrome do intestino curto ou fibrose cística
- vitamina B6 em pacientes submetidos a diálise
- vitamina B6 em pacientes com câncer
- vitamina B6 em pacientes com insuficiência renal
- vitaminas individuais cuja necessidade pode ser aumentada devido a interações com outros medicamentos (ver o ponto Interacções).
Deficiências de uma ou mais vitaminas devem ser corrigidas por meio de suplementação específica.
O CERNEVIT não contém vitamina K, que deve ser administrada separadamente, se necessário.
Uso em pacientes com deficiência de vitamina B12
Antes de iniciar a suplementação com o produto CERNEVIT em pacientes com risco de deficiência de vitamina B12 e (ou) quando se planeja administrar o produto CERNEVIT por várias semanas, é recomendada a avaliação do estado da vitamina B12.
Após alguns dias de administração, tanto o nível de cianocobalamina (vitamina B12) quanto o nível de ácido fólico no produto CERNEVIT podem ser suficientes para causar um aumento na contagem de glóbulos vermelhos, reticulócitos e hemoglobina em alguns pacientes com deficiência de vitamina B12 com anemia megaloblástica. Isso pode mascarar a deficiência de vitamina B12.
O tratamento eficaz da deficiência de vitamina B12 requer doses mais altas de cianocobalamina do que as fornecidas pelo produto CERNEVIT.
A suplementação de ácido fólico em pacientes com deficiência de vitamina B12 que também não recebem vitamina B12 não previne o desenvolvimento ou a progressão das alterações neurológicas associadas à deficiência de vitamina B12. Na verdade, sugere-se que a suplementação de ácido fólico possa piorar o estado neurológico.
Ao interpretar os níveis de vitamina B12, deve-se considerar que a ingestão recente de vitamina B12 pode resultar em níveis normais, apesar da deficiência nos tecidos.
Alterações nos testes laboratoriais
A biotina pode interferir nos testes laboratoriais baseados na interação entre biotina e estreptavidina, levando a resultados falsamente baixos ou falsamente altos, dependendo do teste. O risco de interferência é maior em crianças e pacientes com distúrbios da função renal e aumenta com doses mais altas. Ao interpretar os resultados dos testes laboratoriais, deve-se considerar a possível interferência da biotina, especialmente se houver discordância com a apresentação clínica (por exemplo, resultados de testes da tireoide que imitam resultados que indicam doença de Graves em pacientes que tomam biotina sem sintomas da doença ou resultados de testes de troponina falsamente negativos em pacientes com infarto do miocárdio que tomam biotina). Em casos em que se suspeite de interferência, deve-se realizar testes alternativos, não afetados pela biotina, se disponíveis. Se os testes laboratoriais forem solicitados em pacientes que tomam biotina, deve-se consultar o pessoal do laboratório.
Dependendo dos reagentes usados, a presença de ácido ascórbico no sangue e na urina pode causar leituras falsamente altas ou baixas dos níveis de glicose em alguns sistemas de teste de glicose no sangue e na urina, incluindo fitas de teste portáteis e glicosímetros portáteis. Deve-se consultar as informações técnicas de cada teste laboratorial para determinar as possíveis interferências causadas pelas vitaminas.
Uso concomitante com medicamentos antiepilépticos:
Devido à presença de ácido fólico, a administração concomitante do produto CERNEVIT com medicamentos antiepilépticos que contenham fenobarbital, fenitoína ou primidona requer cuidado especial.
Uso concomitante com levodopa:
Devido à presença de piridoxina no produto CERNEVIT, a administração concomitante com levodopa requer cuidado especial, pois pode diminuir a eficácia da levodopa.
Uso em crianças e adolescentes
O CERNEVIT é indicado em crianças e adolescentes com mais de 11 anos de idade (ver também o ponto "Advertências e precauções especiais").
Uso em pacientes idosos
Normalmente, deve-se considerar a redução da dose em pacientes idosos (redução da dose e (ou) aumento do intervalo entre as doses), considerando a maior frequência de deterioração da função hepática, renal ou cardíaca e a ocorrência de doenças concomitantes ou terapia medicamentosa.
Conteúdo de sódio
O CERNEVIT contém 24 mg de sódio (1 mmol) por frasco. Isso deve ser considerado em pacientes com dieta controlada de sódio.
Deve-se verificar a compatibilidade do produto antes de misturá-lo com outras soluções para infusão, especialmente quando o CERNEVIT é adicionado a bolsas que contenham misturas nutricionais duplas para nutrição parenteral, que combinam glicose, eletrólitos e solução de aminoácidos, bem como misturas triplas que combinam glicose, eletrólitos, solução de aminoácidos e gorduras.
Interacções com outros medicamentos e outras formas de interação
Deve-se considerar as interações entre as vitaminas no produto CERNEVIT e outros fatores.
Essas interações incluem:
- fatores que podem causar a ocorrência de pseudotumor cerebral (incluindo algumas tetraciclinas): o risco de ocorrência de pseudotumor cerebral aumenta com a administração concomitante de vitamina A
- álcool (consumo excessivo crônico): aumenta o risco de toxicidade hepática da vitamina A
- medicamentos antiepilépticos: o ácido fólico pode aumentar o metabolismo de alguns medicamentos antiepilépticos, como fenobarbital, fenitoína, fosfenitoína e primidona, o que aumenta o risco de ocorrência de convulsões. Deve-se monitorar os níveis de medicamentos antiepilépticos no sangue durante a administração concomitante de folatos e após a interrupção da terapia com folatos
- medicamentos antiplaquetários (por exemplo, aspirina): a vitamina E pode potencializar o efeito inibidor da agregação plaquetária
- aspirina (terapia com doses altas): pode reduzir os níveis de ácido fólico aumentando a excreção urinária
- certos medicamentos antiepilépticos (por exemplo, fenitoína, carbamazepina, fenobarbital, valproato): podem causar deficiência de folatos, piridoxina e vitamina D
- certos medicamentos antirretrovirais: níveis reduzidos de vitamina D estão associados, por exemplo, ao efavirenz ou zidovudina. A redução da formação de metabolitos ativos da vitamina D está associada a inibidores de protease
- clorafenicol: pode inibir a resposta hematológica ao tratamento com vitamina B12
- deferroxamina: aumenta o risco de insuficiência cardíaca induzida por ferro devido à mobilização aumentada de ferro pela suplementação de vitamina C. Para obter informações específicas sobre as precauções, ver as informações do produto deferroxamina
- etionamida: pode causar deficiência de piridoxina
- fluoropirimidinas (5-fluorouracil, capecitabina, tegafur): aumento da citotoxicidade em combinação com ácido fólico
- antagonistas de folatos, como metotrexato, sulfassalazina, pirimetamina, triamtereno, trimetoprima e altas doses de catequinas presentes no chá: bloqueiam a conversão de folatos em seus metabolitos ativos e reduzem a eficácia da suplementação
- antimetabolitos de folatos (metotrexato, raltitrexede): a suplementação de ácido fólico pode reduzir a eficácia da ação antimetabólica
- levodopa: a vitamina B6 pode reduzir a eficácia da levodopa, pois a descarboxilação da levodopa requer uma enzima dependente da vitamina B6. Para evitar essa interação, pode-se adicionar um inibidor da descarboxilase da dopa, como a carbidopa.
- antagonistas da piridoxina, incluindo cicloserina, hidralazina, isoniazida, penicilamina, fenelzina: podem causar deficiência de piridoxina
- retinoides, incluindo beksaroten: o risco de toxicidade aumenta se administrados com vitamina A (ver "Hipervitaminose A" no ponto "Advertências e precauções especiais")
- teofilina: pode causar deficiência de piridoxina
- solução oral de tipranavir: contém 116 UI/ml de vitamina E, o que excede a dose diária recomendada
- antagonistas da vitamina K (por exemplo, varfarina): potencializam o efeito anticoagulante da vitamina E
Produtos medicamentosos que se ligam à alfa-1-glicoproteína ácida (AAG):
Em um estudo in vitro com soro humano, uma concentração de ácido glicocólico cerca de 4 vezes maior do que a concentração de ácido glicocólico no soro, que poderia ser o resultado da injeção de um bolus do produto CERNEVIT em um adulto, aumentou em 50-80% a fração de produtos medicamentosos que se ligam à AAG.
Não se sabe se esse efeito é clinicamente significativo se a quantidade de ácido glicocólico contida na dose padrão do CERNEVIT (como componente de micelas mistas) for administrada por injeção lenta intravenosa, injeção lenta intramuscular ou infusão por um período prolongado.
Pacientes que recebem CERNEVIT e produtos medicamentosos que se ligam à AAG devem ser monitorados cuidadosamente para o aumento do efeito desses medicamentos. Incluem-se nessa categoria propranolol, prazosina e muitos outros.
Interacções relacionadas à suplementação de outras vitaminas:
Alguns produtos medicamentosos podem interagir com algumas vitaminas em doses significativamente mais altas do que as doses contidas no produto CERNEVIT. Deve-se considerar isso em pacientes que tomam vitaminas de várias fontes e, se isso ocorrer, monitorar os pacientes para essas interações e agir adequadamente.
Sobredose
A sobredose aguda ou crônica de vitaminas (especialmente A, D e E) pode causar hipervitaminose sintomática.
O risco de sobredose é especialmente alto se o paciente receber vitaminas de várias fontes e a suplementação de vitaminas não atender às necessidades individuais do paciente e em pacientes com aumento da susceptibilidade à hipervitaminose (ver o ponto "Advertências e precauções especiais").
Os sintomas de sobredose do produto CERNEVIT resultam principalmente da administração de doses excessivas de vitamina A.
Os sintomas clínicos de sobredose aguda de vitamina A (doses que excedem 150.000 UI)
- distúrbios gastrointestinais, dor de cabeça, aumento da pressão intracraniana, edema do nervo óptico, distúrbios psiquiátricos, irritabilidade e até convulsões. Como sintoma tardio da reação do organismo à sobredose, observou-se descamação generalizada da pele.
Os sintomas clínicos de toxicidade da vitamina A na sobredose crônica (administração prolongada de doses mais altas do que as fisiológicas de vitamina A em pacientes que não necessitam de suplementação de vitamina A)
- aumento da pressão intracraniana, crescimento excessivo da camada cortical dos ossos longos e ossificação prematura das extremidades dos ossos. O diagnóstico é baseado na presença de tumefações dolorosas ou sensíveis à pressão nas extremidades.
A imagem de raios-X mostra espessamento da camada cortical do corpo do osso ulnar, do osso radial, da clavícula e das costelas. O tratamento da sobredose de vitaminas geralmente consiste na interrupção da suplementação de vitaminas e em outras ações de acordo com as indicações clínicas (como limitação da ingestão de cálcio, aumento da diurese e hidratação).
Dados farmacêuticos
Prazo de validade
2 anos
Precauções especiais de armazenamento
Armazenar em temperatura ambiente, entre 15°C e 25°C, proteger da luz.
Armazenar no pacote exterior de cartão.
Após a reconstituição, o produto mantém a estabilidade química e física por 24 horas a 25°C.
Do ponto de vista microbiológico, o medicamento deve ser usado imediatamente após a reconstituição.
Caso contrário, a responsabilidade pelo tempo e condições de armazenamento até o uso cabe à pessoa que administra o medicamento, e o armazenamento não deve exceder 24 horas a 2-8°C, a menos que a reconstituição tenha sido feita em condições assépticas controladas e validadas.
Tipo e conteúdo do pacote
Frasco de vidro laranja contendo 750 mg de pó, em caixa de cartão. Pacotes de 10 e 20 frascos.
Frasco de vidro laranja contendo 750 mg de pó, com sistema BIO-SET, em caixa de cartão. Pacotes de 10 e 20 frascos.
Nem todos os tamanhos de pacotes podem estar disponíveis.
Incompatibilidades, instruções para a eliminação e preparo do medicamento para uso (se aplicável)
- Durante a preparação da solução e adição do componente à mistura para nutrição parenteral, deve-se seguir as condições assépticas.
- Misturar suavemente para dissolver o pó liofilizado.
- O CERNEVIT deve ser completamente dissolvido antes de ser transferido do frasco.
- Não usar o produto se a solução preparada não for clara e o fechamento original estiver violado.
- Após adicionar o CERNEVIT à solução para nutrição parenteral, deve-se verificar se não ocorreu alteração anormal da cor e (ou) se não estão presentes resíduos de complexos insolúveis ou cristais.
- Deve-se misturar cuidadosamente a solução final se o CERNEVIT for usado como componente da mistura para nutrição parenteral.
- O produto reconstituído não utilizado deve ser descartado e não deve ser armazenado para uso posterior.
- Os medicamentos para administração parenteral devem ser inspecionados visualmente antes da administração em busca de partículas sólidas e alterações anormais da cor da solução, se o recipiente e a solução permitirem.
- É recomendada a utilização de um filtro no final da linha de infusão durante a administração de todos os tipos de nutrição parenteral.
Se necessário, deve-se consultar as referências apropriadas sobre compatibilidade e diretrizes. Este medicamento não deve ser misturado com outros medicamentos, a menos que tenha sido comprovada a compatibilidade e estabilidade. Para obter mais informações, deve-se contatar o titular da autorização de comercialização.
Deve-se verificar a compatibilidade das soluções administradas simultaneamente pela mesma linha.
CERNEVIT (frascos sem BIO-SET)
Administração intravenosa
Usar uma seringa para injetar 5 ml de água para injeção ou solução de glicose a 5% ou solução de cloreto de sódio a 0,9% no frasco.
Misturar suavemente até dissolver o pó.
A solução obtida tem cor amarelo-alaranjada.
Administração intramuscular
Dissolver o pó em 2,5 ml de água para injeção, conforme descrito acima.
CERNEVIT BIO-SET
CERNEVIT com o sistema BIO-SET permite a dissolução direta do medicamento nas bolsas (simples e multicompartimentais) com entrada para injeção.
Bolsa de um compartimento:
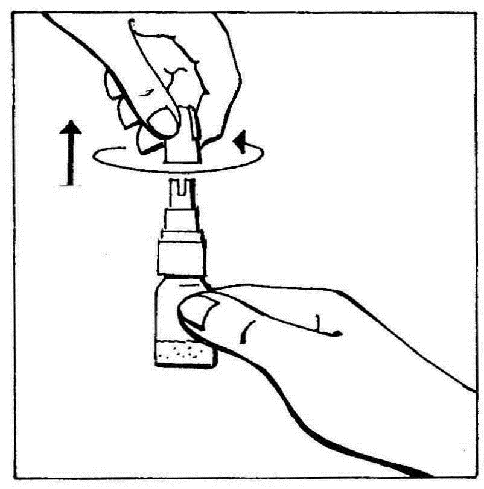
- 1. Remover a tampa, girando-a e, em seguida, puxando para quebrar o anel de segurança.
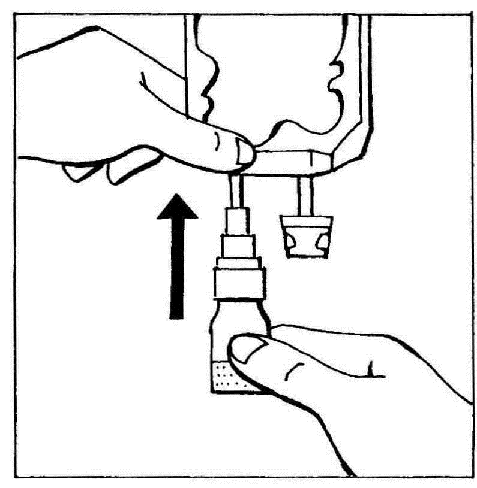
- 2. Ligar o BIO-SET diretamente à entrada para injeção da bolsa.
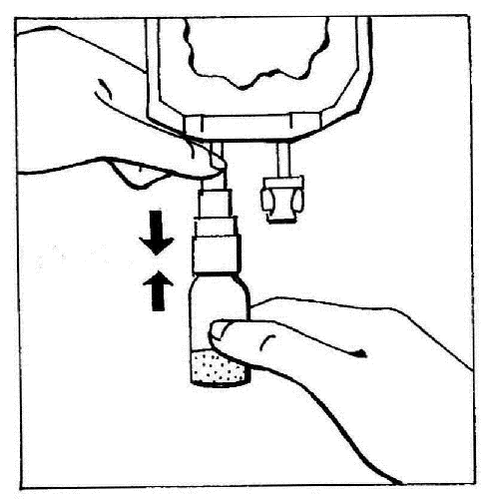
- 3. Ativar o BIO-SET pressionando a parte transparente e móvel. Isso permite perfurar a tampa de borracha da ampola.
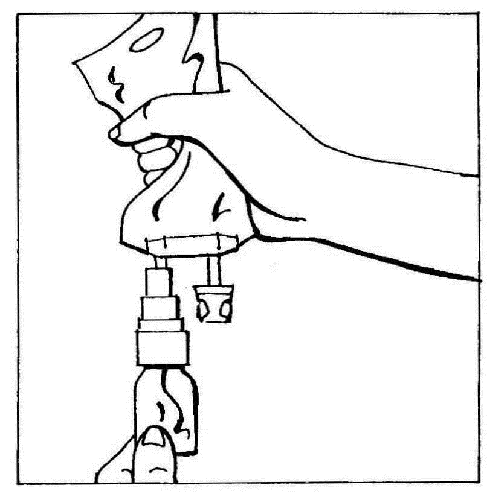
- 4. Posicionar os elementos ligados (CERNEVIT com BIO-SET e a bolsa com o líquido para infusão) na posição vertical, segurando a bolsa no topo. Pressionar suavemente a bolsa várias vezes para fazer com que o líquido flua para a ampola (aproximadamente 5 ml). Agitar a ampola para dissolver o pó.
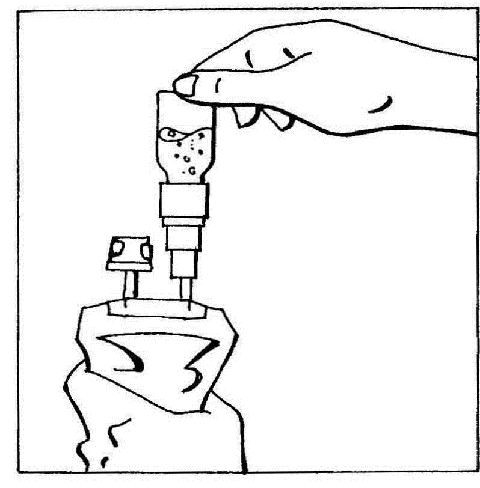
- 5. Inverter os elementos ligados e segurá-los na posição vertical com a ampola no topo. Pressionar suavemente a bolsa várias vezes para mover o ar da bolsa para a ampola. Isso fará com que o líquido flua de volta para a bolsa.
- 6. Repetir os passos 4 e 5 até que a ampola esteja vazia.
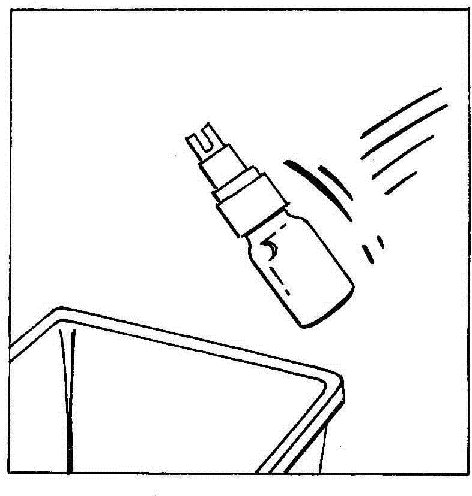
- 7. Desligar e descartar a ampola com o BIO-SET.
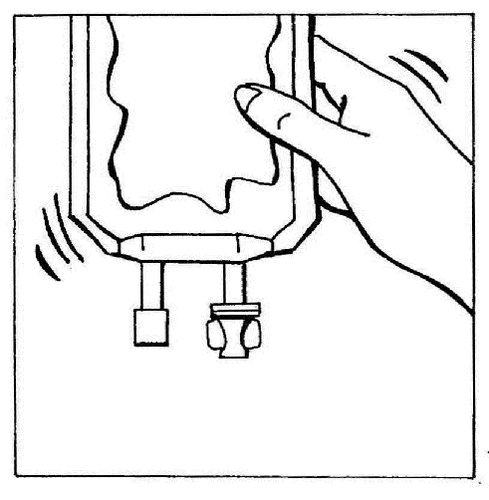
- 8. Misturar suavemente o conteúdo da bolsa.
Bolsa multicompartimental:
A dissolução do medicamento CERNEVIT com o kit BIO-SET deve ser feita antes da ativação da bolsa multicompartimental (antes de abrir as soldas separadoras e antes de misturar todos os compartimentos).
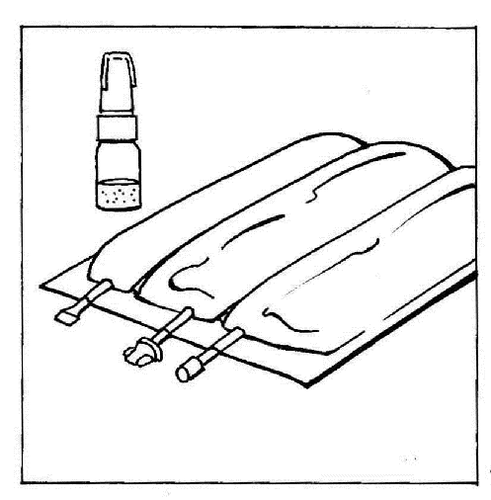
- 1. Colocar a bolsa multicompartimental sobre a mesa.
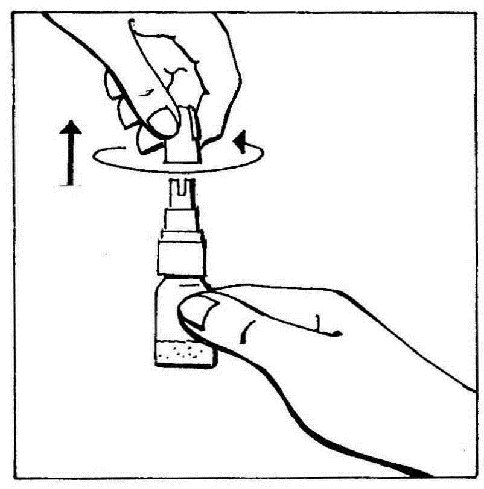
- 2. Remover a tampa, girando-a e, em seguida, puxando para quebrar o anel de segurança.
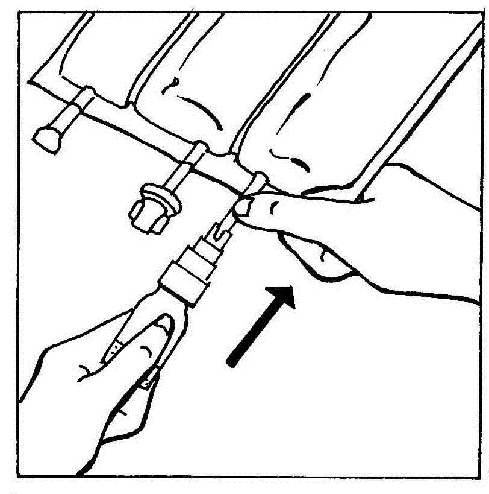
- 3. Ligar o BIO-SET diretamente à entrada para injeção da bolsa.
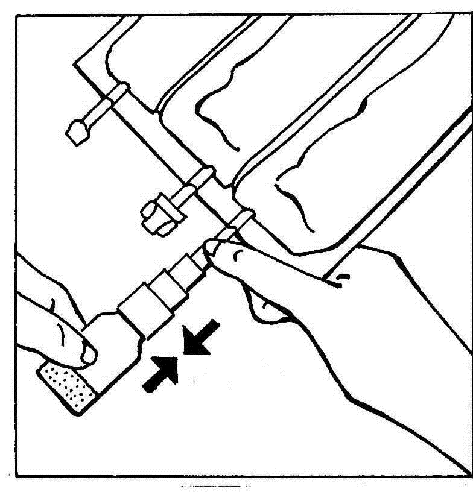
- 4. Ativar o BIO-SET pressionando a parte transparente e móvel. Isso permite perfurar a tampa de borracha da ampola.
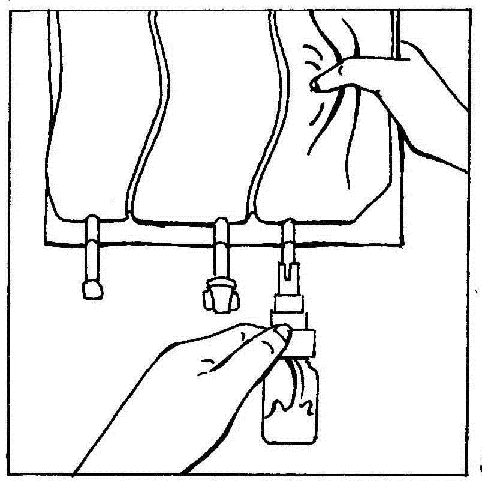
- 5. Segurar a ampola na posição vertical. Pressionar suavemente o compartimento da bolsa várias vezes para fazer com que o líquido flua para a ampola (aproximadamente 5 ml). Agitar a ampola para dissolver o pó.
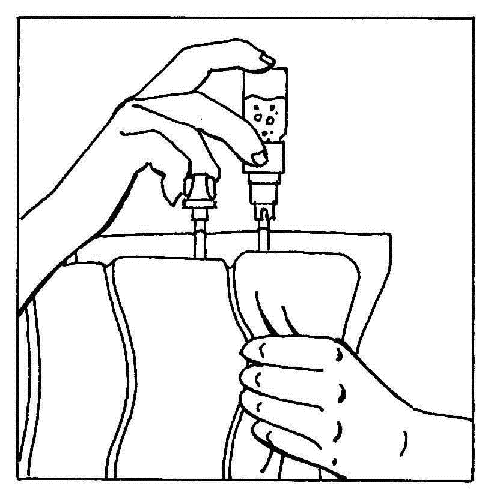
- 6. Inverter os elementos ligados e segurá-los na posição vertical com a ampola no topo. Pressionar suavemente o compartimento da bolsa várias vezes para mover o ar da bolsa para a ampola. Isso fará com que o líquido flua de volta para a bolsa.
- 7. Repetir os passos 5 e 6 até que a ampola esteja vazia.
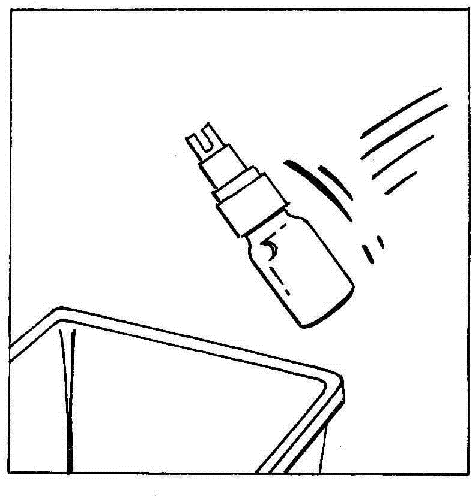
- 8. Desligar e descartar a ampola com o CERNEVIT BIO-SET.
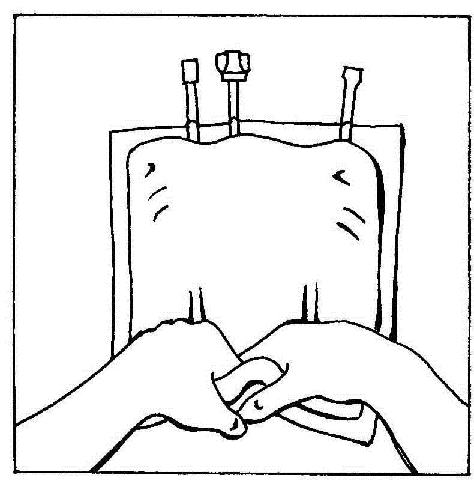
- 9. Quebrar as soldas dos compartimentos da bolsa. Finalmente, ativar a bolsa multicompartimental.
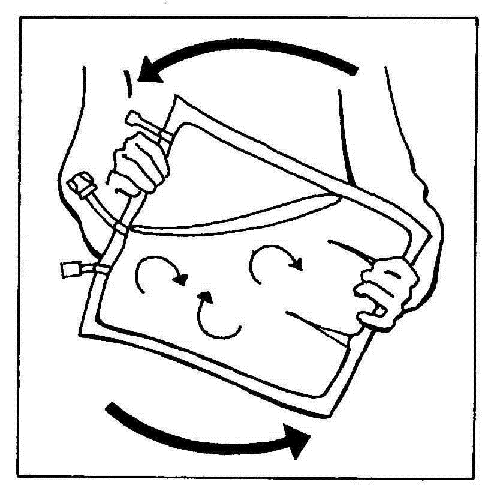
- 10. Misturar suavemente o conteúdo da bolsa, girando-a pelo menos 3 vezes.
AVISO:
Deve-se ter cuidado para não desligar o kit BIO-SET da entrada para injeção da bolsa durante a dissolução do medicamento.
- País de registo
- Requer receita médicaNão
- Fabricante
- ImportadorBaxter S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a CernevitForma farmacêutica: Concentrado, -Substância ativa: electrolytes in combination with other drugsFabricante: Fresenius Kabi Norge ASNão requer receita médicaForma farmacêutica: Concentrado, (170,1 mg + 133,5 mg + 14 mg)/mlSubstância ativa: electrolytes in combination with other drugsNão requer receita médicaForma farmacêutica: Solução, 1 g/10 mlSubstância ativa: calcium chlorideFabricante: Demo S.A.Requer receita médica
Alternativas a Cernevit noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Cernevit em Ukraine
Alternativa a Cernevit em Espanha
Médicos online para Cernevit
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Cernevit – sujeita a avaliação médica e regras locais.














