
Antithrombin Iii Nf Takeda

Pergunte a um médico sobre a prescrição de Antithrombin Iii Nf Takeda

Como usar Antithrombin Iii Nf Takeda
Folheto informativo para o utilizador
Antithrombin III NF Shire, 50 UI/ml, pó e proszek e solvente para solução para infusão
humana
Antitrombina III humana de origem plasmática
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém
informações importantes para o doente.
- Deve guardar este folheto, para que possa lê-lo novamente se necessário.
- Em caso de dúvidas, deve consultar o médico ou o farmacêutico.
- O medicamento foi prescrito apenas para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outras pessoas, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou o farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é Antithrombin III NF Shire e para que é utilizado
- 2. Informações importantes antes de tomar Antithrombin III NF Shire
- 3. Como tomar Antithrombin III NF Shire
- 4. Efeitos não desejados
- 5. Como conservar Antithrombin III NF Shire
- 6. Conteúdo da embalagem e outras informações
1. O que é Antithrombin III NF Shire e para que é utilizado
Antithrombin III NF Shire é apresentado como um pó branco ou amarelado-pálido, com solvente para solução para infusão.
Antithrombin III NF Shire pertence a um grupo farmacoterapêutico conhecido como agentes antitrombóticos.
Antithrombin III NF Shire é utilizado no tratamento de deficiência congênita ou adquirida de antitrombina III, sendo que a deficiência adquirida pode ocorrer em várias condições clínicas.
2. Informações importantes antes de tomar Antithrombin III NF Shire
Quando não tomar Antithrombin III NF Shire:
- se o doente tiver alergia à antitrombina III ou a qualquer um dos outros componentes do medicamento (listados no ponto 6)
- em doentes com trombocitopenia induzida por heparina (ou seja, diminuição do número de plaquetas) na história
Precauções e medidas de precaução
- Deve informar o médico responsável se ocorrerem os primeiros sintomas de reação alérgica (por exemplo, angioedema, urticária generalizada, sensação de pressão no peito, respiração sibilante, hipotensão e choque anafilático). Sintomas graves podem exigir tratamento de emergência.
- Deve informar o médico se o doente estiver tomando ou tiver tomado recentemente medicamentos que contenham heparina (por exemplo, no tratamento de trombose), pois o efeito da antitrombina é significativamente aumentado pela heparina.
- Antithrombin III NF Shire é produzido a partir de plasma humano. No caso de administração de medicamentos obtidos a partir de sangue ou plasma humano, não é possível excluir completamente a transmissão de agentes infecciosos. Isso também se aplica a patógenos ainda desconhecidos. O risco de transmissão de agentes infecciosos é, no entanto, minimizado por meio da seleção cuidadosa de doadores e plasma, testes de banco de plasma e procedimentos de inativação/remoção de vírus.
Crianças
Não administrar este medicamento a crianças com menos de 6 anos, pois não foi estabelecida a segurança ou eficácia neste grupo etário.
Antithrombin III NF Shire e outros medicamentos
- Deve informar o médico sobre os medicamentos que está tomando ou tomou recentemente, incluindo aqueles que contenham heparina (por exemplo, no tratamento de trombose), pois o efeito da antitrombina é significativamente aumentado pela heparina.
- Deve informar o médico ou o farmacêutico sobre todos os medicamentos que está tomando ou tomou recentemente, incluindo aqueles que são vendidos sem receita.
Antithrombin III NF Shire com alimentos e bebidas
Não se aplica.
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou amamentando, acredita que possa estar grávida ou planeja ter um filho, deve consultar o médico antes de tomar este medicamento. O médico decidirá se é possível administrar Antithrombin III NF Shire durante a gravidez ou amamentação.
Antes de tomar qualquer medicamento, deve consultar o médico ou o farmacêutico.
Condução de veículos e uso de máquinas
Embora não tenha sido observado efeito na capacidade de conduzir veículos ou operar máquinas, não é possível excluir tal efeito. Portanto, é recomendado que o doente não conduza veículos ou não opere máquinas sem consultar previamente o médico.
Antithrombin III NF Shire contém sódio
Este medicamento contém aproximadamente 3,77 mg de sódio por ml. Deve ser considerado em doentes que controlam o sódio na dieta.
3. Como tomar Antithrombin III NF Shire
Antithrombin III NF Shire será administrado exclusivamente sob supervisão médica. A dose depende do peso corporal e das necessidades individuais do doente. O médico responsável determinará a dose a ser administrada. Antithrombin III NF Shire será administrado por infusão intravenosa.
Uso de dose maior do que a recomendada de Antithrombin III NF Shire
Não foram relatados sintomas de superdose de antitrombina.
Omissão da administração de Antithrombin III NF Shire
Não se aplica.
Interrupção da administração de Antithrombin III NF Shire
Não se aplica.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não em todos os doentes.
- Sensibilidade ou reações alérgicas, como: angioedema, ardor e picada no local da infusão, calafrios, ondas de calor, urticária generalizada, dor de cabeça, erupção cutânea pruriginosa, hipotensão, sonolência, náuseas, ansiedade, taquicardia, sensação de pressão no peito, formigamento, vômitos, respiração sibilante, foram observados raramente, mas podem ser graves o suficiente para exigir tratamento de emergência.
- Em casos raros, foi observada febre.
- Em casos raros, pode ocorrer trombocitopenia (ou seja, diminuição do número de plaquetas), que é mediada por anticorpos induzidos pela heparina. Foi observada uma diminuição do número de plaquetas abaixo de 100.000/µl ou uma diminuição do número de plaquetas em 50%.
Outros efeitos não desejados observados após a comercialização de Antithrombin III NF Shire incluem sensibilidade, reação anafilática, calafrios e ondas de calor.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no folheto, deve informar o médico ou o farmacêutico. Efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Vigilância Sanitária:
Rua São Paulo, 1000
01311-100 São Paulo
Telefone: +55 11 3207 6000
Fax: +55 11 3207 6001
e-mail: [[email protected]](mailto:[email protected])
Efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
Obrigado por notificar efeitos não desejados, pois isso pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar Antithrombin III NF Shire
Manter o medicamento em um local seguro e fora do alcance das crianças.
Manter na geladeira (2°C a 8°C). Não congelar.
Manter na embalagem original para proteger da luz.
Não usar Antithrombin III NF Shire após o prazo de validade impresso na embalagem e na caixa. O prazo de validade é o último dia do mês indicado.
Não usar Antithrombin III NF Shire se a solução estiver turva ou contiver depósitos.
Medicamentos não devem ser jogados na canalização ou lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais necessários. Isso ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Antithrombin III NF Shire
- O princípio ativo do medicamento é a antitrombina humana de origem plasmática
- Os outros componentes são glicose, cloreto de sódio, citrato de sódio diidratado e Tris(hidroximetil)aminometano
Como é Antithrombin III NF Shire e o que a embalagem contém
Antithrombin III NF Shire é apresentado como um pó para solução para infusão contendo nominalmente 500 UI (ou 1000 UI) de antitrombina humana de origem plasmática em uma ampola e solvente.
Após reconstituição em 10 ml (ou 20 ml) de água para injeção, o medicamento contém aproximadamente 50 UI/ml (500 UI/10 ml ou 1000 UI/20 ml) de antitrombina humana de origem plasmática.
Antithrombin III NF Shire é um pó branco ou amarelado-pálido.
Cada embalagem também contém:
- 1 agulha para transferência
- 1 agulha com filtro
- 1 agulha para ventilação
- 1 agulha para uso único
- 1 conjunto para infusão
Responsável e fabricante
Responsável
Shire Farmacêuticos Ltda.
Rua Fidélis, 123
01306-000 São Paulo
Fabricante
Baxter SA
Rua das Fábricas, 123
2415-844 Leça do Balio, Portugal
Data da última atualização do folheto: ------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico especializado:
Dosagem e modo de administração
O tratamento deve ser conduzido sob supervisão médica, com experiência no tratamento de doentes com deficiência de antitrombina.
Dosagem
A dose deve ser individualizada para cada doente e considerar a história familiar de eventos tromboembólicos, fatores de risco atuais e resultados de exames laboratoriais.
A dose e a duração da terapia de substituição na deficiência adquirida dependem do nível de antitrombina no plasma, da presença de sintomas de consumo aumentado, da causa da perturbação e da gravidade da condição clínica do doente. Em cada caso, a dose e a frequência de administração devem ser determinadas com base nos resultados laboratoriais e na avaliação da condição clínica do doente e da resposta ao tratamento.
A quantidade de unidades de antitrombina é expressa em unidades internacionais (UI), que se referem ao padrão atual da OMS para antitrombina.
A atividade da antitrombina no plasma é expressa em porcentagem (em relação ao plasma humano normal) ou em unidades internacionais (referentes ao Padrão Internacional de Antitrombina no Plasma).
A atividade de uma unidade internacional (UI) de antitrombina corresponde à quantidade de antitrombina em 1 ml de plasma humano normal. O cálculo da dose necessária de antitrombina é baseado em dados empíricos de que a administração de 1 UI de antitrombina por quilograma de peso corporal aumenta a atividade da antitrombina no plasma em aproximadamente 2%.
A dose inicial é calculada de acordo com a seguinte fórmula:
Quantidade necessária = peso corporal (kg) x (Nível alvo – atividade atual de antitrombina [%]) x 0,5
A atividade alvo inicial da antitrombina no plasma depende da avaliação da condição clínica do doente.
Após a determinação da indicação para a substituição da antitrombina, uma dose única deve garantir o alcance da atividade alvo da antitrombina no plasma e, subsequentemente, manter o nível adequado. A dose a ser administrada deve ser determinada com base nos resultados dos exames laboratoriais, que devem ser realizados pelo menos duas vezes ao dia até que a condição do doente se estabilize e, subsequentemente, uma vez ao dia, preferencialmente logo antes da próxima infusão. Ajustes da dose devem considerar tanto o consumo aumentado de antitrombina quanto os resultados laboratoriais e os sintomas clínicos. Durante o tratamento, a atividade da antitrombina deve ser mantida em um nível superior a 80%, a menos que razões clínicas exijam um nível diferente.
A dose inicial recomendada na deficiência congênita é de 30-50 UI/kg de peso corporal.
Posteriormente, a dose e a frequência de administração, bem como a duração do tratamento, devem ser adaptadas com base nos resultados laboratoriais e na condição clínica do doente.
Crianças e adolescentes;
Não foi estabelecida a segurança ou eficácia do medicamento Antithrombin III NF Shire em crianças com menos de 6 anos. Portanto, não é recomendado o uso do medicamento neste grupo de doentes.
Modo de administração
Administrar por via intravenosa. A velocidade máxima de infusão é de 5 ml/min.
Medidas especiais de precaução para a eliminação e preparação do medicamento para uso
Antithrombin III NF Shire deve ser reconstituído imediatamente antes da administração.
Deve ser usado apenas o conjunto de infusão fornecido. Durante a preparação da solução, devem ser usadas técnicas assépticas. A solução pronta para uso deve ser administrada imediatamente após a preparação (pois não contém conservantes).
Antes da administração, deve ser verificado se o medicamento reconstituído não contém partículas insolúveis e se não mudou de cor. A solução deve ser clara ou ligeiramente opalescente. Não usar soluções que estejam turvas ou contenham depósitos.
Qualquer sobra do medicamento ou resíduos deve ser eliminado de acordo com as regulamentações locais.
Preparação da solução:
- 1. Levar a ampola fechada contendo o solvente (água para injeção) à temperatura ambiente (máximo 37°C).
- 2. Retirar as cápsulas protetoras das ampolas com o pó e o solvente (fig. A) e desinfetar as tampas de borracha das duas ampolas.
- 3. Retirar a tampa protetora de uma das extremidades da agulha para transferência, girando e puxando (fig. B). Introduzir a extremidade exposta da agulha na tampa de borracha da ampola com o solvente (fig. C).
- 4. Retirar a tampa protetora da outra extremidade da agulha para transferência, tomando cuidado para não tocar na parte exposta.
- 5. Inverter a ampola com o solvente e introduzir a extremidade livre da agulha para transferência na tampa da ampola com o pó (fig. D). O solvente será aspirado para a ampola com o pó por sucção.
- 6. Retirar as duas ampolas da agulha para transferência (fig. E). Agitar suavemente a ampola para acelerar a dissolução.
- 7. Após a dissolução completa do pó, introduzir a agulha para ventilação (fig. F), e a espuma formada desaparecerá. Retirar a agulha para ventilação.
Administração:
- 8. Retirar a proteção da agulha com filtro, girando e puxando, e colocá-la em uma seringa estéril para uso único. Aspirar a solução para a seringa (fig. G).
- 9. Retirar a agulha com filtro da seringa e, após colocar a agulha para uso único (ou o conjunto para infusão fornecido), administrar a solução por via intravenosa, lentamente (velocidade máxima de administração: 5 ml/min).
Se o medicamento não foi filtrado durante a reconstituição, deve ser usado um conjunto para infusão de uso único com filtro apropriado (velocidade máxima de infusão: 5 ml/min).
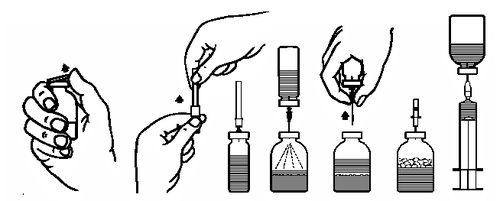
fig. A fig. B
fig. C fig. D
fig. E fig. F fig. G
Incompatibilidades farmacêuticas
O medicamento não deve ser misturado com outros medicamentos.
Precauções e medidas de precaução especiais para o uso
Como no caso de outros medicamentos que contenham proteínas administrados por via intravenosa, a administração de Antithrombin III NF Shire pode causar reações de sensibilidade do tipo alérgico. Durante a infusão, os doentes devem ser monitorados de perto e observados cuidadosamente para detectar qualquer efeito não desejado. Deve ser informado ao doente sobre os primeiros sintomas de reação de sensibilidade, como erupção cutânea pruriginosa, urticária generalizada, sensação de pressão no peito, respiração sibilante, hipotensão e choque anafilático. Se esses sintomas ocorrerem após a administração do medicamento, o doente deve contatar o médico responsável.
Em caso de choque, deve ser aplicado o tratamento padrão.
Shire é uma marca registrada da Shire Pharmaceutical Holdings Ireland Limited ou suas empresas afiliadas.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorTakeda Manufacturing Austria AG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Antithrombin Iii Nf TakedaForma farmacêutica: Pó, 500 UISubstância ativa: antithrombin IIIFabricante: Instituto Grifols S.A.Não requer receita médicaForma farmacêutica: Pó, 1000 UISubstância ativa: antithrombin IIIFabricante: Instituto Grifols S.A.Não requer receita médicaForma farmacêutica: Pó, 50 UI/ml; 500 UISubstância ativa: antithrombin IIIFabricante: Takeda Manufacturing Austria AGNão requer receita médica
Alternativas a Antithrombin Iii Nf Takeda noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Antithrombin Iii Nf Takeda em Ukraine
Alternativa a Antithrombin Iii Nf Takeda em Espanha
Médicos online para Antithrombin Iii Nf Takeda
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Antithrombin Iii Nf Takeda – sujeita a avaliação médica e regras locais.














