
Anbinex

Pergunte a um médico sobre a prescrição de Anbinex

Como usar Anbinex
folheto INCLUÍDO NA EMBALAGEM: INFORMAÇÃO PARA O UTILIZADOR
Anbinex
50 UI/ml; 500 UI e 1000 UI
Pó de antitrombina humana e solvente para solução para infusão. Antithrombinum III humanum densatum
Deve ler-se atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente
- Deve conservar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é Anbinex e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Anbinex
- 3. Como tomar Anbinex
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Anbinex
- 6. Conteúdo da embalagem e outras informações
1. O que é Anbinex e para que é utilizado
Anbinex é um
medicamento
anticoagulante,
pertence
à
classe
dos
medicamentos
anticoagulantes
parenterais.
Este medicamento é utilizado no tratamento da deficiência congénita de antitrombina, na prevenção
da
formação
de
tromboses
venosas
profundas
dos
membros
inferiores
e
de
alterações
tromboembólicas
em
outros
vasos
sanguíneos.
Se
houver
indicação
para
isso,
também
é
administrado
durante
intervenções
cirúrgicas
e
no
período
pós-parto.
Em
alguns
casos,
pode
ser
administrado
em
combinação
com
heparina.
Anbinex
também
é
utilizado
no
tratamento
da
deficiência
adquirida
de
antitrombina.
2. Informações importantes antes de tomar o medicamento Anbinex
Quando não tomar o medicamento Anbinex
Se o doente tiver alergia à antitrombina ou a qualquer um dos outros componentes deste
medicamento
(listados
no
ponto
6).
Deve
ler
atentamente
as
informações
importantes
no
final
deste
ponto.
Precauções e advertências
Antes de começar a tomar o medicamento Anbinex, deve discutir com o médico, farmacêutico ou
enfermeiro.
Tal
como
no
caso
de
outros
produtos
administrados
por
via
intravenosa,
é
possível
ocorrer
reações
alérgicas.
Durante
a
infusão,
o
doente
deve
ser
monitorizado
de
perto
devido
ao
risco
de
ocorrer
efeitos
não
desejados.
Em
caso
de
sintomas
de
reação
de
hipersensibilidade,
incluindo
erupções
cutâneas,
urticária
generalizada,
sensação
de
opressão
no
peito,
respiração
sibilante
(dificuldade
em
respirar),
hipotensão
e
sintomas
de
anafilaxia,
deve
informar
imediatamente
o
médico
que
o
está
a
tratar.
No
processo
de
fabrico
de
medicamentos
a
partir
de
sangue
ou
plasma
humano,
são
utilizadas
procedimentos
específicos
para
prevenir
a
transmissão
de
infecções
aos
doentes.
Estes
procedimentos
incluem:
- seleção
rigorosa
dos
doadores
de
sangue
e
plasma,
com
o
objetivo
de
excluir
doadores
que
possam
ser
fonte
de
infecção; - análise
de
cada
doação
e
de
cada
lote
de
plasma
coletado
para
detectar
a
presença
de
vírus/
agentes
infecciosos; - inclusão
de
etapas
no
processo
de
tratamento
do
plasma,
durante
as
quais
os
vírus
podem
ser
inativados
ou
eliminados.
Apesar
da
utilização
destes
procedimentos
de
prevenção,
não
é
possível
excluir
completamente
a
possibilidade
de
transmissão
de
infecção,
caso
sejam
administrados
medicamentos
fabricados
a
partir
de
sangue
ou
plasma
humano.
Isto
também
se
aplica
a
vírus
desconhecidos
ou
recentemente
descobertos
e
a
outros
patógenos.
Considera-se
que
as
medidas
de
prevenção
adotadas
são
eficazes
contra
vírus
envelopados,
como
o
vírus
da
imunodeficiência
humana
(HIV),
o
vírus
da
hepatite
B,
o
vírus
da
hepatite
C
e
o
vírus
da
hepatite
A
não
envelopado.
As
medidas
de
prevenção
podem
ter
um
valor
limitado
no
caso
de
vírus
não
envelopados,
como
o
parvovirus
B19.
A
infecção
por
parvovirus
B19
pode
ser
particularmente
grave
em
mulheres
grávidas
(infecção
do
feto)
e
em
pessoas
com
sistema
imunológico
debilitado
ou
com
certos
tipos
de
anemia
(por
exemplo,
anemia
falciforme,
anemia
hemolítica).
Em
doentes
que
recebem
regularmente/
repetidamente
antitrombina
humana
derivada
do
plasma,
o
médico
pode
recomendar
a
vacinação
contra
a
hepatite
A
e
B.
É
fortemente
recomendado
que,
em
cada
administração
do
medicamento
Anbinex
ao
doente,
se
registe
o
nome
do
doente
e
o
número
de
série
do
produto,
para
que
se
possa
estabelecer
uma
ligação
entre
o
doente
e
a
série
do
medicamento.
Anbinex e outros medicamentos
Deve
informar
o
médico
ou
farmacêutico
sobre
todos
os
medicamentos
que
o
doente
está
a
tomar
atualmente
ou
recentemente,
bem
como
sobre
os
medicamentos
que
o
doente
planeia
tomar.
A
administração
de
antitrombina
em
conjunto
com
doses
terapêuticas
de
heparina
aumenta
o
risco
de
sangramento.
O
efeito
da
antitrombina
é
significativamente
potenciado
pela
heparina.
A
administração
concomitante
de
heparina
a
doentes
com
risco
aumentado
de
sangramento
deve
ser
cuidadosamente
monitorizada
do
ponto
de
vista
clínico
e
biológico.
Gravidez e amamentação
Se
a
doente
estiver
grávida
ou
a
amamentar,
suspeitar
que
possa
estar
grávida
ou
planeia
ter
um
filho,
deve
consultar
o
médico
ou
farmacêutico
antes
de
tomar
este
medicamento.
Anbinex
deve
ser
utilizado
durante
a
gravidez
e
no
período
de
amamentação
apenas
se
for
claramente
necessário.
A
decisão
deve
ser
tomada
após
considerar
o
facto
de
que,
durante
a
gravidez,
existe
um
risco
aumentado
de
ocorrer
eventos
tromboembólicos.
Condução de veículos e utilização de máquinas
Anbinex
não
tem
ou
tem
um
efeito
negligenciável
na
capacidade
de
conduzir
veículos
e
utilizar
máquinas.
Anbinex contém sódio
Anbinex
500
UI
contém
1,45
mmol
(33,35
mg)
de
sódio
em
10
ml.
Anbinex
1000
UI
contém
2,90
mmol
(66,7
mg)
de
sódio
em
20
ml
Deve
chamar
a
atenção
dos
doentes
com
dietas
com
restrição
de
sal.
3. Como tomar Anbinex
O
medicamento
Anbinex
para
administração
por
infusão
intravenosa
é
preparado
pelo
médico
ou
enfermeiro.
Uso em crianças e adolescentes
Devido
à
falta
de
dados
suficientes,
não
se
recomenda
a
administração
do
medicamento
Anbinex
em
crianças
com
menos
de
6
anos
de
idade.
Frequência de administração
O
médico
determinará
a
frequência
de
administração
do
Anbinex
e
os
intervalos
entre
as
doses.
Duração do tratamento
O
médico
determinará
a
duração
do
tratamento
com
o
medicamento
Anbinex.
Em caso de administração de uma dose maior do que a recomendada do medicamento Anbinex
Não
foram
relatados
casos
de
superdose.
4. Efeitos não desejados
Como
qualquer
medicamento,
este
medicamento
pode
causar
efeitos
não
desejados,
embora
não
ocorram
em
todos
os
doentes.
Em
casos
raros,
observou-se
um
aumento
da
temperatura
corporal
e
reações
alérgicas
ou
anafiláticas,
tais
como
rubor
facial,
erupções
cutâneas,
aumento
ou
diminuição
da
pressão
arterial,
taquicardia
(aceleração
do
ritmo
cardíaco),
arrepios,
respiração
sibilante
e
edemas,
bem
como
reações
generalizadas
(incluindo
dores
no
peito,
febre,
dores
de
cabeça,
náuseas
e/ou
vómitos),
que
em
alguns
casos
levaram
ao
desenvolvimento
de
uma
reação
anafilática
grave
(incluindo
choque).
Em
casos
raros,
observou-se
um
aumento
da
temperatura
corporal.
Lista
de
efeitos
não
desejados
em
formato
de
tabela.
A
frequência
de
ocorrência
foi
avaliada
utilizando
os
seguintes
critérios:
- muito
frequente (
1/10), - frequente (
1/100,
<1> - menos
frequente (
1/1000,
<1> - raros (
1/10
000,
<1> - muito
raros (
1/10
000) - frequência
desconhecida
(frequência
não
pode
ser
determinada
com
base
nos
dados
disponíveis)
| Sistema de classificação de órgãos MedDRA (SOC) | Efeito não desejado | Frequência de ocorrência |
| Perturbações do sistema imunológico | Reações alérgicas, hipersensibilidade | Menos frequente |
| Perturbações psiquiátricas | Ansiedade | Menos frequente |
| Perturbações do sistema nervoso | Dores de cabeça, letargia | Menos frequente |
| Perturbações do sistema cardiovascular | Taquicardia | Menos frequente |
| Perturbações dos vasos sanguíneos | Rubor facial, diminuição da pressão arterial, choque | Menos frequente |
| Perturbações do sistema respiratório, torácico e mediastínico | Sensação de opressão no peito e sibilância | Menos frequente |
| Perturbações do sistema gastrointestinal | Náuseas, vómitos, | Menos frequente |
| Perturbações da pele e do tecido subcutâneo | Edema angioneurótico, urticária generalizada, erupções cutâneas | Menos frequente |
| Perturbações gerais e condições no local de administração | Dor ou sensação de queimadura no local de administração, arrepios | Menos frequente |
| Febre | Raro |
Deve
informar
o
médico
se
ocorrer
algum
destes
sintomas.
Informações
sobre
medidas
de
prevenção
contra
a
transmissão
de
agentes
infecciosos - ver
ponto
2.
Se
ocorrerem
algum
efeito
não
desejado,
incluindo
qualquer
efeito
não
desejado
não
mencionado
neste
folheto,
deve
informar
o
médico,
farmacêutico
ou
enfermeiro.
Efeitos
não
desejados
podem
ser
notificados
diretamente
ao
Departamento
de
Monitorização
de
Efeitos
Não
Desejados
de
Medicamentos
da
Agência
Nacional
de
Vigilância
Sanitária:
Al.
Jerozolimskie
181C,
02-222
Varsóvia,
Tel.:
+
48
22
49
21
301,
Fax:
+
48
22
49
21
309,
e-mail:
[email protected]
Efeitos
não
desejados
também
podem
ser
notificados
ao
titular
da
autorização
de
comercialização.
A
notificação
de
efeitos
não
desejados
permite
reunir
mais
informações
sobre
a
segurança
do
medicamento.
5. Como conservar o medicamento Anbinex
O
medicamento
deve
ser
conservado
em
local
não
acessível
às
crianças.
Não
utilizar
o
medicamento
após
o
prazo
de
validade
(EXP)
impresso
na
embalagem.
O
prazo
de
validade
é
o
último
dia
do
mês
indicado.
Não
conservar
a
uma
temperatura
superior
a
30
°C.
Não
congelar.
Após
reconstituição:
- Os
estudos
de
estabilidade
indicam
um
período
de
validade
de
até
12
horas
a
25
°C.
Do
ponto
de
vista
microbiológico,
o
produto
deve
ser
utilizado
imediatamente.
Se,
após
a
reconstituição,
o
produto
não
for
utilizado,
pode
ser
conservado
por
um
período
máximo
de
24
horas
a
uma
temperatura
de
2
°C
-
8
°C,
mas
apenas
se
a
responsabilidade
por
isso
for
assumida
pelo
utilizador
e
se
a
preparação
da
solução
for
feita
de
acordo
com
as
regras
de
assepsia.
A
solução
deve
ser
transparente
e
ligeiramente
opalescente.
Não
utilizar
o
medicamento
se
se
verificar
a
presença
de
precipitação
ou
depósito.
Os
medicamentos
não
devem
ser
eliminados
na
canalização
ou
em
recipientes
de
lixo
doméstico.
Deve
perguntar
ao
farmacêutico
como
eliminar
os
medicamentos
que
já
não
são
necessários.
Este
procedimento
ajudará
a
proteger
o
meio
ambiente.6. Conteúdo da embalagem e outras informações
O que contém o medicamento Anbinex
A
substância
ativa
do
medicamento
é
a
antitrombina
humana.
A
ampola
de
pó
contém
500
UI
ou
1000
UI
de
antitrombina
humana.
Após
reconstituição,
o
produto
contém
50
UI/ml
(500
UI/10
ml
ou
1000
UI/20
ml)
de
antitrombina
humana.
Os
outros
componentes
são:
D-mannitol,
cloreto
de
sódio
e
citrato
de
sódio.
A
ampola
injetável
contém
10
ml
ou
20
ml
de
água
para
injeção.
Mais
informações
sobre
os
componentes,
ver
ponto
2.Como é o medicamento Anbinex e que conteúdo tem a embalagem
A
embalagem
contém
uma
ampola
com
uma
substância
sólida
ou
pó
branco
e
higroscópico
e
uma
ampola
injetável
com
água
para
injeção.
Cada
embalagem
de
Anbinex
500
UI
contém
uma
ampola
com
500
UI
de
antitrombina
humana
(pó
para
solução
para
infusão)
e
1
ampola
injetável
com
10
ml
de
água
para
injeção
(solvente).
Cada
embalagem
de
Anbinex
1000
UI
contém
uma
ampola
com
1000
UI
de
antitrombina
humana
(pó
para
solução
para
infusão)
e
1
ampola
injetável
com
20
ml
de
água
para
injeção
(solvente).
A
cada
embalagem
de
Anbinex
é
anexado
um
conjunto
para
preparar
a
solução
que
inclui
um
conector
para
fixar
à
ampola
e
um
microfiltro.Titular da autorização de comercialização e fabricante
Instituto
Grifols,
S.A.
Polígono
Levante,
c/Can
Guasch,
2
Parets
del
Vallès
08150
Barcelona,
ESPANHA.
Para
obter
informações
mais
detalhadas,
deve
contactar
o
representante
do
titular
da
autorização
de
comercialização.
Grifols
Portugal,
Unipessoal
Lda
Rua
do
Viriato,
Edifício
Álvares
Cabral,
4º
andar,
fração
B
1050-125
Lisboa
Tel.:
+
351
213
211
400
Data
da
última
revisão
do
folheto:
----------------------------------------------------------------------------------------------------------------
Informações
destinadas
apenas
ao
pessoal
médico
especializado:
No
caso
de
deficiência
congénita,
a
dosagem
e
a
duração
do
tratamento
devem
ser
adaptados
individualmente
para
cada
doente,
com
base
nos
resultados
da
anamnese
familiar,
incluindo
casos
de
eventos
tromboembólicos,
fatores
de
risco
clínicos
atuais
e
resultados
de
exames
laboratoriais.
A
dosagem
e
a
duração
do
tratamento
de
substituição
na
deficiência
adquirida
de
antitrombina
dependem
do
nível
de
antitrombina
no
plasma,
da
presença
de
sintomas
de
consumo
acelerado,
da
doença
de
base
e
da
gravidade
dos
sintomas
clínicos.
O
tamanho
das
doses
e
a
frequência
de
administração
devem
ser
sempre
adaptados
individualmente
para
cada
doente,
com
base
nos
efeitos
clínicos.
A
atividade
da
antitrombina
no
plasma
pode
ser
expressa
em
percentagem
(em
relação
à
atividade
em
plasma
normal)
ou
em
unidades
internacionais
(de
acordo
com
o
padrão
internacional
para
antitrombina
plasmática).
Uma
unidade
internacional
(UI)
de
atividade
da
antitrombina
corresponde
à
quantidade
média
de
antitrombina
em
1
ml
de
plasma
humano
normal.
O
cálculo
da
dose
necessária
de
antitrombina
baseia-se
na
observação
empírica
de
que
a
administração
de
1
UI
de
antitrombina
por
quilograma
de
peso
corporal
aumenta
a
atividade
da
antitrombina
no
plasma
em
cerca
de
1,1
%
a
1,6
%.
A
dose
inicial
é
calculada
com
base
na
seguinte
fórmula:Número
de
unidades
necessárias = peso
corporal (kg)
x
(100
-
atividade
da
antitrombina
inicial
(em
percentagem))
x
0,8No
início
do
tratamento,
deve
ser
estabelecido
o
nível
desejado
de
atividade
da
antitrombina
com
base
na
situação
clínica.
Após
a
determinação
das
indicações
para
a
administração
da
antitrombina,
deve
ser
administrada
uma
dose
que
permita
atingir
o
nível
desejado
de
atividade
da
antitrombina
e,
subsequentemente,
manter
esse
nível
para
garantir
a
eficácia
do
tratamento.
A
dose
deve
ser
calculada
e
monitorizada
com
base
nas
determinações
laboratoriais
da
atividade
da
antitrombina
no
plasma.
As
determinações
devem
ser
realizadas
pelo
menos
duas
vezes
ao
dia,
e,
quando
o
estado
do
doente
se
estabilizar,
uma
vez
ao
dia;
sempre
imediatamente
antes
da
próxima
administração
do
medicamento.
Deve
ter-se
em
mente
que,
em
casos
de
estados
clínicos
graves,
como
a
síndrome
de
coagulação
intravascular
disseminada,
o
tempo
de
meia-vida
da
antitrombina
pode
ser
significativamente
reduzido.
A
correção
do
tamanho
da
dose
deve
ser
feita
com
base
tanto
na
velocidade
de
consumo
da
antitrombina,
determinada
com
base
nas
determinações
laboratoriais,
como
no
curso
clínico.
A
atividade
da
antitrombina
deve
ser
mantida
acima
de
80
%
do
normal
durante
todo
o
período
de
tratamento
ou
adaptada
conforme
os
sintomas
clínicos
indiquem
que
um
nível
diferente
possa
ser
mais
eficaz.
No
tratamento
da
deficiência
congénita,
a
dose
inicial
é
de
30
a
50
UI/kg
de
peso
corporal.
Posteriormente,
o
tamanho
da
dose,
a
frequência
de
administração
e
a
duração
do
tratamento
dependem
da
resposta
biológica
na
situação
clínica
específica.Instruções
para
a
preparação
do
medicamento
para
administração- 1.
Aquecer
as
ampolas
a
uma
temperatura
não
superior
a
30
°C
(figura
n.º
1). - 2.
Fixar
o
êmbolo
na
ampola
injetável
com
solvente
(figura
n.º
2). - 3.
Retirar
o
filtro
da
embalagem.
Retirar
a
cobertura
de
plástico
da
extremidade
da
ampola
injetável
e
fixar
o
filtro
(figura
n.º
3). - 4.
Retirar
o
conector
para
fixar
à
ampola
e
ligar
a
ampola
injetável
com
filtro
(figura
n.º
4). - 5.
Retirar
a
cobertura
de
plástico
da
ampola
e
desinfetar
a
parte
superior
do
batoque
de
borracha
com
um
desinfetante
(figura
n.º
5). - 6.
Perfurar
o
batoque
da
ampola
com
a
agulha
do
conector
(figura
n.º
6). - 7.
Injetar
todo
o
solvente
na
ampola
(figura
n.º
7). - 8.
Agitar
suavemente
a
ampola
até
que
o
pó
se
dissolva
completamente
(figura
n.º
8). - 9.
Desligar
a
ampola
injetável
com
filtro
da
ampola.
Puxar
o
êmbolo
para
introduzir
ar
na
ampola
injetável
em
uma
quantidade
igual
ao
volume
do
solvente.
Voltar
a
ligar
a
ampola
injetável
com
filtro
à
ampola
com
conector
(figura
n.º
9). - 10.
Inverter
a
ampola
e
aspirar
a
solução
para
a
ampola
injetável
(figura
n.º
10). - 11.
Desligar
a
ampola
injetável
do
filtro
e
da
ampola
e
administrar
lentamente
por
via
intravenosa
a
uma
velocidade
não
superior
a
0,08
ml/kg/min
(figura
n.º
11).
Não
deixar
o
produto
não
utilizado
para
uso
posterior.
Não
reutilizar
o
conjunto
para
administração.
Ao
utilizar
o
conjunto
para
infusão,
deve
verificar
a
compatibilidade
com
a
ampola
injetável.
Deve
utilizar
adaptadores
adequados
para
garantir
a
administração
correcta
do
produto.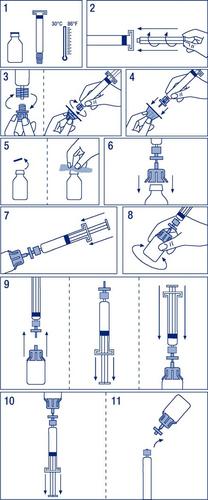
- 1.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorInstituto Grifols, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a AnbinexForma farmacêutica: Pó, 1000 UISubstância ativa: antithrombin IIIFabricante: Instituto Grifols S.A.Não requer receita médicaForma farmacêutica: Pó, 50 UI/ml; 500 UISubstância ativa: antithrombin IIIFabricante: Takeda Manufacturing Austria AGNão requer receita médicaForma farmacêutica: Pó, 50 UI/mlSubstância ativa: antithrombin IIIFabricante: Takeda Manufacturing Austria AGNão requer receita médica
Alternativas a Anbinex noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Anbinex em Ukraine
Alternativa a Anbinex em Espanha
Médicos online para Anbinex
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Anbinex – sujeita a avaliação médica e regras locais.














