WILLFACT 2000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar WILLFACT 2000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Willfact 500UI polvo y disolvente para solución inyectable
Willfact 1000UIpolvo y disolvente para solución inyectable
Willfact 2000UIpolvo y disolvente para solución inyectable
factor de von Willebrand humano
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto:
- Qué es Willfact y para qué se utiliza
- Qué necesita saber antes de empezar a usar Willfact
- Cómo usar Willfact
- Posibles efectos adversos
- Conservación de Willfact
- Contenido del envase e información adicional
1. Qué es Willfact y para qué se utiliza
Willfact se obtiene a partir de plasma humano (la parte líquida de la sangre) y es un medicamento que contiene el principio activo llamado factor de von Willebrand (FVW).
FVW interviene en la coagulación de la sangre. La falta de este factor, como ocurre en la enfermedad de von Willebrand, significa que la sangre no coagula tan rápidamente como debería, por lo que hay una mayor tendencia a sangrar. La sustitución del VWF por Willfact reparará temporalmente los mecanismos de coagulación de la sangre.
Willfact está indicado en la prevención y el tratamiento de hemorragias quirúrgicas o de otro tipo en pacientes con la enfermedad de von Willebrand cuando el tratamiento con desmopresina (DDAVP) sola no es eficaz o está contraindicado.
Willfact puede usarse en todos los grupos de edad.
Willfact no debe ser usado como tratamiento de la Hemofilia A.
2. Qué necesita saber antes de empezar a usar Willfact
No useWillfact
- si es alérgico al factor de von Willebrand humano o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si padece HemofiliaA.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Willfact.
El tratamiento con Willfact debe estar siempre supervisado por un médicocon experiencia en el tratamiento de trastornos de la hemostasia.
Si presenta una hemorragia severa y un análisis de sangre indica que el valor de factor VIII en sangre está bajo, recibirá el preparado de FVW además de un preparado de factor VIII en las primeras 12 horas.
Reacciones alérgicas
Al igual que sucede con todas las proteínas derivadas de la sangre o del plasma humanos que se administran por vía intravenosa, pueden ocurrir reacciones de hipersensibilidad en forma de alergia. Durante la inyección, será monitorizado para detectar cualquier signo temprano de hipersensibilidad. Esto incluye,erupción (habones o urticaria generalizada), opresión de pecho, dificultad respiratoria, tensión arterial baja (hipotensión) y reacciones alérgicas graves (anafilaxia).
Su médico le informará de los signos de alarma de una reacción alérgica.
En caso de que aparezcan signos o síntomas de hipersensibilidad, debe interrumpirse el tratamiento y solicitar atención médica inmediata.
Seguridad frente a virus
Cuando los medicamentos se elaboran a partir de sangre o plasma humanos, se toman ciertas medidas para evitar que se transmitan infecciones a los pacientes. Entre ellas se incluyen:
- Una cuidadosa selección de los donantes de sangre y plasma para asegurarse de que se excluye a aquellos con riesgo de ser portadores de infecciones,
- Análisis de cada donación y de los grupos de plasma para detectar signos de virus/infecciones,
- Inclusión de pasos en el procesamiento de la sangre o el plasma que puedan inactivar o eliminar los virus.
A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humanos, no puede excluirse totalmente la posibilidad de transmitir la infección. Esto también se aplica a cualquier virus desconocido o emergente o a otros tipos de infecciones.
Las medidas adoptadas se consideran eficaces para los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH-SIDA), el virus de la hepatitis B y el virus de la hepatitis C.
Las medidas adoptadas pueden tener un valor limitado contra los virus no envueltos, como el virus de la hepatitis A y el parvovirus B19. La infección por parvovirus B19 puede ser grave para las mujeres embarazadas (ya que existe riesgo de infección del feto) y para las personas cuyo sistema inmunitario está deprimido o que padecen algunos tipos de anemia (por ejemplo, anemia falciforme o anemia hemolítica).
Vacunas
Su médico puede recomendarle que considere la vacunación contra la hepatitis A y B si recibe regularmente/repetidamente factor von Willebrand derivado de plasma humano.
Registro del número de lote
Se recomienda encarecidamente que cada vez que reciba una dosis de Willfact, se anote el nombre y el número de lote del medicamento para mantener un registro de los lotes utilizados.
Riesgo de trombosis
Los coágulos de sangre (trombosis) pueden también obstruir los vasos sanguíneos. Existe el riesgo especialmente si su historia clínica previa o los resultados de las analíticas señalan que tiene ciertos factores de riesgo. En este caso, se le vigilará estrechamente para detectar cualquier signo temprano de trombosis, y se le deberá administrar un tratamiento preventivo (profilaxis) contra la obstrucción de las venas debido a los coágulos de sangre.
Cuando se usa un producto de factor de von Willebrand que contiene factor VIII, el médico deberá tener en cuenta que el tratamiento continuado puede producir un incremento excesivo del FVIII. Si usted recibe un producto de FVW que contiene FVIII, el médico le controlará periódicamente los niveles plasmáticos de FVIII. De este modo se garantiza que no se produzca un exceso sostenido de los niveles plasmáticos de FVIII, lo que podría aumentar el riesgo de eventos trombóticos.
Eficacia limitada
Es posible que, en los pacientes con enfermedad de von Willebrand, especialmente los pacientes con el Tipo 3, se formen proteínas que neutralizan el efecto del FVW. Estas proteínas se llaman anticuerpos neutralizantes o inhibidores. Si los resultados de laboratorio muestran que tus niveles del FVW no se están reponiendo o si la hemorragia no se detiene a pesar de la administración de una dosis adecuada de Willfact, su médico comprobará si su organismo ha desarrollado inhibidores del FVW.
Si hay presencia de estos inhibidores en una concentración alta, el tratamiento con FVW podrá no ser eficaz, y deberán considerarse otras opciones de tratamiento. El nuevo tratamiento se lo administrará un médico con experiencia en el tratamiento de trastornos de la hemostasia.
Otros medicamentos y Willfact
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
No debe utilizarse Willfact durante el embarazo o la lactancia a menos que esté claramente indicado.
No se ha estudiado la seguridad de Willfact durante el embarazo y la lactancia en estudios clínicos controlados. Los estudios realizados en animales son insuficientes para establecer la seguridad con respecto a la fertilidad, embarazo y desarrollo del niño durante el embarazo y después del nacimiento.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
No se han observado efectos sobre la capacidad para conducir y utilizar máquinas.
Willfact contienesodio
Un vial de 5 ml (500 UI) de Willfact contiene 0,15 mmol (3,4 mg) de sodio.
Esto equivale al 0,17 % de la ingesta diaria máxima recomendada de sodio para un adulto.
Un vial de 10 ml (1000 UI) de Willfact contiene 0,3 mmol (6,9 mg) de sodio.
Esto equivale al 0,35 % de la ingesta diaria máxima recomendada de sodio para un adulto.
Un vial de 20 ml (2000 UI) de Willfact contiene 0,6 mmol (13,8 mg) de sodio.
Esto equivale al 0,69 % de la ingesta diaria máxima recomendada de sodio para un adulto.
3. Cómo usar Willfact
Su tratamiento deberá iniciarse y monitorizarse por un médico con experiencia en el tratamiento de trastornos hermorrágicos.
Si su médico considera que la administración puede realizarse en su domicilio, le proporcionará las instrucciones adecuadas.
Posología
Tome siempre este medicamento exactamente como le haya indicado su médico. Si no está seguro, consulte a su médico.
Preferiblemente, Willfact debe ser administrado por su médico o enfermera. No obstante, si le han recetado Willfact para que se lo administre en casa, su médico se asegurará de que le enseñen cómo inyectárselo y qué cantidad debe utilizar. Siga las instrucciones que le dé su médico y pida ayuda si tiene problemas para manejar la jeringa; ésta debe ser utilizada siempre por una persona capacitada para ello.
Su médico calculará su dosis de Willfact (en unidades internacionales o UI).
La dosis que se le administrará dependerá de :
- Peso corporal,
- Lugar de la hemorragia,
- Intensidad de la hemorragia,
- Estado clínico,
- Cirugía requerida,
- Niveles de actividad del FVW en su sangre después de la cirugía,
- Gravedad de su enfermedad
Esta dosis varía entre 40 a 80 UI/kg.
Su médico le recomendará que se someta a análisis de sangre durante el tratamiento para controlar
- los niveles de factor VIII (FVIII:C),
- los niveles del factor von Willebrand (FVW:Rco),
- la presencia de inhibidores,
- signos preliminares de formación de coágulos si corre el riesgo de sufrir tales complicaciones.
En función de los resultados de estas pruebas, su médico puede decidir adaptar la dosis y la frecuencia de sus inyecciones.
En ciertos casos, puede ser necesario utilizar un preparado de factor VIII (otra proteína de la coagulación) además de Willfact para tratar o prevenir más rápidamente las hemorragias (en situaciones de emergencia o hemorragias agudas).
Willfact puede administrase como profilaxis a largo plazo; el nivel de dosis también se determina de forma individual en este caso. Las dosis entre 40 y 60 UI/kg de Willfact, administradas dos o tres veces a la semana, reducen el número de episodios hemorrágicos.
Uso en niños y adolescentes
La dosis para niños y adolescentes se basa en el peso corporal. En algunos casos, especialmente en los pacientes más jóvenes (de menos de 6 años), pueden ser necesarias dosis más altas (de hasta 100 UI/kg).
Informe a su médico si cree que el efecto de Willfact es demasiado fuerte o demasiado débil.
Método de administración
Las instrucciones detalladas para la reconstitución y administración del medicamento figuran al final del prospecto.
Si usa másWillfactdel que debe
No se han descrito síntomas de sobredosis con Willfact.
Sin embargo, no puede descartarse el riesgo de trombosis en el caso de una sobredosificación importante.
Si olvida utilizar Willfact
Si olvida tomar WILLFACT, consulte a su médico.
No tome una dosis doble para compensar la dosis olvidada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
En caso de sobredosis o ingestión accidental, consulte con su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono 91 562 04 20, indicando el medicamento y la cantidad ingerida.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Póngase en contacto con su médico inmediatamente si:
- Nota síntomas de hipersensibilidad o reacciones alérgicas (observado con poca frecuencia: puede afectar a 1 de cada 100 personas).
En algunos casos, estas reacciones pueden evolucionar a una reacción alérgica grave (anafilaxia) incluyendo shock anafiláctico (observado con una frecuencia desconocida).
Los signos de alarma de las reacciones alérgicas son
- Dificultad para respirar y tragar
- Sibilancias
- Opresión en el pecho
- Aumento de la frecuencia cardíaca
- Disminución o caída de la tensión arterial
- Desmayo
- Fatiga extrema
- Inquietud, nerviosismo
- Dolor de cabeza
- Escalofríos, sensación de frío
- Rubor, sofocos
- Hinchazón en diferentes partes del cuerpo
- Erupción cutánea, urticaria generalizada
- Ardor y escozor en el lugar de infusión
- Hormigueo
- Vómitos
- Náuseas
Si se produce uno de estos efectos, interrumpa el tratamiento inmediatamente y póngase en contacto con su médicopara iniciar un tratamiento adecuado según el tipo y la gravedad de la reacción. |
- Nota que el medicamento deja de funcionar correctamente (la hemorragia no se controla). Esto puede deberse a la inhibición del factor de von Willebrand (observada con una frecuencia desconocida).
En los pacientes con enfermedad de von Willebrand, especialmente en los de tipo 3, pueden formarse proteínas que neutralizan el efecto del FvW. Estas proteínas se denominan anticuerpos neutralizantes o inhibidores. Los pacientes tratados con FvW deben ser controlados cuidadosamente por sus médicos para detectar la aparición de inhibidores mediante observaciones clínicas y pruebas de laboratorio adecuadas. Si se producen tales inhibidores, la afección puede manifestarse como una respuesta clínica inadecuada u ocurrir concomitantemente a reacciones alérgicas graves.
- Nota algún síntoma de deterioro de la perfusión en las extremidades (por ejemplo, extremidades frías y pálidas) o en los órganos vitales (por ejemplo, dolor torácico intenso). Esto puede deberse a la formación de coágulos sanguíneos en los vasos sanguíneos (observados con una frecuencia desconocida).
Existe riesgo de formación de coágulos sanguíneos (trombosis), especialmente en pacientes con factores de riesgo conocidos. Tras la corrección de la deficiencia del factor von Willebrand, debe ser vigilado para detectar signos precoces de trombosis o coagulación intravascular diseminada y recibir tratamiento para prevenir la trombosis en situaciones que impliquen un mayor riesgo de trombosis (después de operaciones, durante el confinamiento en cama, en casos de deficiencia de un inhibidor de la coagulación o de una enzima fibrinolítica).
Si recibe preparados de FVIII que contienen FVW, el riesgo de trombosis también puede aumentar debido a los niveles plasmáticos de FVIII persistentemente elevados.
Se ha observado el siguiente efecto adversos frecuentemente(puede afectar hasta 1 de cada 10 personas):
- Reacciones en el punto de infusión
Los siguientes efectos adversos han sido observados de forma poco frecuente(puede afectar hasta 1 de cada 100 personas):
- Mareos
- Parestesia, hipoestesia
- Sofoco
- Picor
- Sensación de opresión
- Escalofríos, sensación de frío
El siguiente efecto adversose ha observado con una frecuencia no conocida:
- Fiebre
Comunicación de efectos adversos:
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Willfact
Mantenga este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del vial y en el envase.
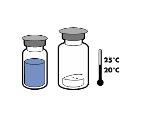
No conservar a temperatura superior a + 25°C. Conservar en el envase original para protegerlo de la luz.
No congelar.
Por razones de esterilidad, el producto debe utilizarse inmediatamente después de la reconstitución física y química. Estabilidad fisicoquímica, sin embargo,ha sido demostrada después de 24 horas a +25ºC.
No utilice este medicamento si observa que la solución está turbia o contiene depósitos.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico o enfermero cómo deshacerse de los envases y los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deWillfact
- El principio activoes: factor de von Willebrand humano (500 UI, 1000 UI o 2000 UI), expresado en Unidades Internacionales (UI) de actividad del cofactor de ristocetina (FVW:RCo).
Tras la reconstitución con 5 ml (500 UI), 10 ml (1000 UI) o 20 ml (2000 UI) de agua para preparaciones inyectables, un vial contiene aproximadamente 100 UI/ml de factor de von Willebrand humano.
Antes de añadir la albúmina, la actividad específica es mayor o igual a 60 UI de FVW:RCo/mg de proteína total.
- Los demás componentesson:
Polvo: albúmina humana, hidrocloruro de arginina, glicina, citrato de sodio y cloruro de calcio dihidrato.
Disolvente: agua para preparaciones inyectables.
Aspecto del productoy contenido del envase
Willfact se presenta como polvo o sólido desmenuzable blanco o amarillo pálido y un disolvente transparente o incoloro para solución inyectable tras la reconstitución con un sistema de transferencia.
Willfact está disponible en envases de 500 UI/5 ml, 1000 UI/10 ml y 2000 UI/20 ml.
La solución reconstituida debe ser transparente o ligeramente opalescente, incolora o ligeramente amarilla.
Titular de la autorización de comercialización
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 Les Ulis
FRANCIA
Responsable de la fabricación
LFB BIOMEDICAMENTS
3, Avenue des Tropiques, BP 305 - Les Ulis, Courtaboeuf - F-91958 – Francia
ó
LFB BIOMEDICAMENTS
59 Rue de Trevise. BP 2006 - Lille - F-59011 - Francia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
LFB BIOTERAPIAS HISPANIA,S.L.
C/ Diego de León 47
28006 Madrid
(España)
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en Reino Unido (Irlanda del norte) con los siguientes nombres:
Austria Willfact
República Checa WILLFACT
Dinamarca Willfact
Alemania WILLFACT
Hungría Willfact
Noruega Willfact
Polonia Willfact
República Eslovaca Willfact
España Willfact
Suecia Willfact
Reino Unido(Irlanda del Norte) Willfact
Fecha de la última revisión de este prospecto:Marzo 2024
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
_____________________________________________________________________________
INSTRUCCIONES DE USO:
Posología
En general, la administración de una UI/kg de factor de von Willebrand eleva el nivel circulante de FvW:RCo en aproximadamente 0,02 UI/mL (2%).
Deben alcanzarse niveles de VWF:RCo de > 0,6 UI/mL (60%) y de FVIII:C de > 0,4 UI/mL (40%).
La hemostasia no puede garantizarse hasta que la actividad coagulante del factor VIII (FVIII:C) haya alcanzado 0,4 UI/ml (40%). La inyección de factor von Willebrand por sí sola no induce un aumento máximo de FVIII:C hasta pasadas al menos 6 a 12 horas. No puede corregir inmediatamente el nivel de FVIII:C. Por lo tanto, si los niveles basales de FVIII:C del paciente están por debajo de este nivel crítico, en todas las situaciones en las que se requiera una corrección rápida de la hemostasia, como el tratamiento de una hemorragia, un traumatismo grave o una intervención quirúrgica de urgencia, debe administrarse factor VIII con la primera inyección de factor de von Willebrand para conseguir un nivel plasmático hemostático de FVIII:C.
Sin embargo, si no es necesario un aumento inmediato de FVIII:C, como en el caso de una intervención quirúrgica programada, o si los niveles basales de FVIII:C son suficientes para garantizar la hemostasia, el médico puede decidir prescindir de la coadministración de FVIII para la primera inyección de factor de von Willebrand.
- Inicio del tratamiento:
La primera dosis de WILLFACT es de 40 a 80 UI/kg para el tratamiento de hemorragias o traumatismos, junto con la cantidad necesaria de producto de factor VIII, calculada en función del nivel plasmático basal de FVIII:C del paciente, a fin de alcanzar un nivel plasmático adecuado de FVIII:C inmediatamente antes de la intervención o lo antes posible tras el inicio del episodio hemorrágico o traumatismo grave. En caso de cirugía, la primera inyección debe administrarse 1 hora antes de la intervención.
Puede ser necesaria una dosis inicial de 80 UI/kg de WILLFACT, especialmente en pacientes con enfermedad de von Willebrand de tipo 3, en los que el mantenimiento de niveles adecuados puede requerir dosis más altas que en otros tipos de EVW.
En caso de cirugía electiva, la primera inyección de WILLFACT debe administrarse entre 12 y 24 horas antes de la intervención y la segunda antes de la misma. En estos casos, no es necesaria la administración conjunta de un producto de factor VIII, ya que el FVIII:C endógeno suele haber alcanzado el nivel crítico de 0,4 UI/mL (40%) antes de la intervención. Sin embargo, esto debe confirmarse en cada paciente.
- Inyecciones posteriores:
En caso necesario, el tratamiento debe continuarse con 40 a 80 UI/kg de WILLFACT solo al día, en una o dos inyecciones diarias durante uno o varios días. La dosis y la frecuencia de las inyecciones deben adaptarse siempre al tipo de intervención quirúrgica, al estado clínico y biológico del paciente (VWF:RCo y FVIII:C) y al tipo y gravedad del episodio hemorrágico.
- Profilaxis a largo plazo:
WILLFACT puede administrarse como profilaxis a largo plazo, a dosis adaptadas a cada paciente. Dosis de WILLFACT de 40 a 60 UI/kg, administradas de 2 a 3 veces por semana, reducen el número de episodios hemorrágicos.
- Tratamiento ambulatorio:
El tratamiento domiciliario puede iniciarse con la aprobación del médico, especialmente en casos de hemorragias leves a moderadas o durante la profilaxis a largo plazo para prevenir hemorragias.
- Población pediátrica
Para cada indicación, la dosis se basa en el peso corporal. La dosis y la duración del tratamiento deben ajustarse en función del estado clínico del paciente y sus niveles plasmáticos de FVIII:C y FVW:Rco.
- Inicio del tratamiento:
- Para menores de 6 años de edad, la dosis inicial puede guiarse por la recuperación incremental (RI) del paciente o, si no hay datos disponibles de RI, puede ser necesaria una dosis inicial de entre 60 y 100 UI/kg con el objetivo de elevar los niveles de FVW:Rco a 100 UI/dl.
- En el caso de los niños de más de 6 años de edad y los adolescentes, la posología es la misma que para los pacientes adultos.
- Inyecciones posteriores:
Para los niños y los adolescentes, las dosis posteriores deben individualizarse conforme al estado clínico y a los niveles de FVW:Rco, y ajustarse según la respuesta clínica.
Cuando exista una intervención quirúrgica programada:
- En menores de 6 años, tras una primera dosis administrada de 12 a 24 horas antes de la intervención, la dosis repetida puede administrarse 30 minutos antes de la intervención.
- En el caso de los niños de más de 6 años de edad y los adolescentes, la posología es la misma que para los pacientes adultos.
- Profilaxis:
Para los niños y los adolescentes, la dosis y la frecuencia de administraciones posteriores deben individualizarse conforme a la recuperación incremental del paciente y los niveles de FVW:Rco, y ajustarse según la respuesta clínica.
Vía y ruta de administración
Administración intravenosa
Reconstitución:
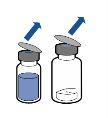
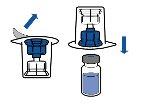
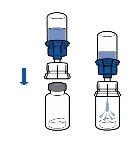
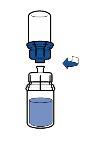
Deben seguirse las directrices actualmente vigentes para procedimientos asépticos. El sistema de transferencia se utilizará únicamente para reconstituir el medicamento, como se describe a continuación. No está concebido para administrar el medicamento al paciente.
|
|
El polvo por lo general se disuelve instantáneamente y deberá disolverse en menos de 10 minutos.
La solución debe ser transparente o poco opalescente, incolora o amarillo claro. El producto reconstituido debe inspeccionarse visualmente en busca de partículas y decoloración antes de su administración.
No utilizar soluciones que estén turbias o presenten sedimentos.
No mezclar con otros medicamentos.
No diluir el producto reconstituido.
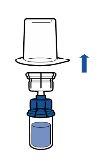
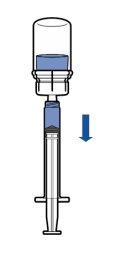
Administración:
|
|
Conservación tras la reconstitución
Por razones de esterilidad, el producto debe utilizarse inmediatamente después de la reconstitución. No obstante, se ha demostrado su estabilidad física y química tras 24 horas a +25°C.
La eliminación de los productos no utilizados o de los envases se realizará de acuerdo con las exigencias locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a WILLFACT 2000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 100 UI/mlPrincipio activo: Factor von willebrandFabricante: Lfb BiomedicamentsRequiere recetaForma farmacéutica: INYECTABLE, 100 UI/mlPrincipio activo: Factor von willebrandFabricante: Lfb BiomedicamentsRequiere recetaForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere receta
Médicos online para WILLFACT 2000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de WILLFACT 2000 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes