VIGZIP 100 MG/ML SOLUCION ORAL

Cómo usar VIGZIP 100 MG/ML SOLUCION ORAL
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Vigzip 100 mg/ml solución oral
vigabatrina
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es Vigzip y para qué se utiliza
- Qué necesita saber antes de empezar a tomar Vigzip
- Cómo tomar Vigzip
- Posibles efectos adversos
- Cómo conservar Vigzip
- Contenido del envase e información adicional
1. Qué es Vigzip y para qué se utiliza
Vigzip contiene el principio activo vigabatrina.
Este medicamento se utiliza para ayudar a controlar diversas formas de epilepsia.
Se utiliza junto con su actual medicación para tratar la epilepsia “difícil de controlar”. Inicialmente se lo prescribirá un especialista. Su respuesta al tratamiento estará vigilada.
Se usa también para controlar los espasmos infantiles (síndrome de West).
2. Qué necesita saber antes de empezar a tomar Vigzip
No tome Vigzip
Si es alérgico a vigabatrina o a cualquiera de los demás componentes de este medicamento (detallados en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a tomar Vigzip si:
- está amamantando
- está embarazada o planea estarlo
- padece o ha padecido depresión o cualquier otra enfermedad psiquiátrica en el pasado
- ha tenido algún problema renal
- ha tenido algún problema visual.

La pérdida del campo visual (pérdida de visión desde los extremos de su campo de visión) puede aparecer durante el tratamiento con vigabatrina. Debe discutir esta posibilidad con su médico antes de empezar el tratamiento con este medicamento. Esta pérdida del campo visual puede ser grave, hasta llevar a visión en túnel o pérdida de vision, e irreversible, por lo que debe ser detectada temprano. No se puede descartar que esta pérdida del campo visual empeore tras la interrupción del tratamiento. Es importante que informe rápidamente a su médico si nota cualquier cambio en su visión. El médico le someterá a un examen del campo visual y de la agudeza visual antes de empezar a tomar Vigzip y a intervalos regulares durante el tratamiento. Vigabatrina podría causar una disminución de la visión debida a problemas oculares tales como trastornos de la retina, visión borrosa, atrofia óptica o neuritis óptica (ver sección 4). Si su visión cambia, consulte a su oftalmólogo.
Si desarrolla síntomas como somnolencia, disminución de la consciencia y de los movimientos (estupor) o confusión, consulte a su médico, quien decidirá si le reduce la dosis o le interrumpe el tratamiento
Un reducido número de personas tratadas con antiepilépticos como vigabatrina ha tenido pensamientos sobre autolesionarse o suicidio. Si en algún momento tiene estos pensamientos, comuníquese de inmediato con su médico
Niños
Se ha informado de trastornos del movimiento y anomalías en las resonancias magnéticas (RMN) cerebrales de niños pequeños tratados para los espasmos infantiles (síndrome de West). Si observa trastornos inusuales del movimiento en su niño, consulte a su médico, quien decidirá si es necesario considerar el cambio de tratamiento.
Otros medicamentos y VIGZIP
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Informe a su médico si está tomando clonazepam, ya que su uso concomitante con Vigzip puede aumentar el riesgo de sedación.
Vigzip no debe ser utilizado en combinación con otros medicamentos que puedan tener efectos adversos relacionados con los ojos.
Embarazo, lactancia y fertilidad
Si está embarazada o amamantando, cree que pudiera estar embarazada o tiene intención de quedar embarazada, consulte a su médico antes de utilizar este medicamento.
No tome Vigzip durante el embarazo a menos que su médico le diga que lo haga. Este medicamento podría causar problemas al feto. No obstante, no interrumpa abruptamente el tratamiento ya que esto puede poner en peligro la salud de la madre y del bebé.
Vigabatrina pasa a la leche materna. Si está amamantando, pregunte a su médico antes de utilizar este medicamento. No se debe amamantar durante el tratamiento.
Conducción y uso de máquinas
No conduzca ni opere máquinas si su epilepsia no está controlada.
Este medicamento, puede producir síntomas tales como somnolencia, mareo o alteraciones en la vista, y disminuir la capacidad de reacción. Estos efectos así como la propia enfermedad pueden dificultar su capacidad para conducir vehículos o manejar máquinas. Por lo tanto no conduzca, ni maneje máquinas, ni practique otras actividades que requieran especial atención, hasta que su médico valore su respuesta a este medicamento.
Algunos pacientes que estabantomando este medicamento han experimentado trastornos visuales que pueden afectar a la capacidad para conducir u operar maquinaria. Si quiere seguir conduciendo, deberá someterse a un examen con regularidad (cada seis meses) para descartar la presencia de trastornos visuales, incluso si no nota ningún cambio en su visión.
Vigzip contiene parahidroxibenzoato de metilo (E 218) y parahidroxibenzoato de propilo (E 216)
pueden producir reacciones alérgicas (posiblemente de forma retardada).
3. Cómo tomar Vigzip
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte a su médico o farmacéutico.
Es importante seguir exactamente las instrucciones de su médico. Nunca cambie la dosis. El médico prescribe la dosis y la ajusta individualmente para cada paciente.
La dosis habitual recomendada para iniciar el tratamiento en adultos es de 1 g de vigabatrina (10 ml de solución) al día. Sin embargo, su médico puede aumentar o disminuir la dosis dependiendo de su respuesta al tratamiento. La dosis diaria habitual para adultos es de 2 a 3 g de vigabatrina (20 ml a 30 ml de solución). La dosis máxima recomendada es de 3 g/día.
La dosis diaria se puede tomar como una dosis única o dividida en dos dosis.
Si usted es un paciente de edad avanzada y/o tiene problemas renales, su médico le prescribirá una dosis inferior.
Uso pediátrico
Epilepsia parcial resistente
En los niños, la dosis se basa en la edad y el peso. La dosis habitualmente recomendada para iniciar el tratamiento en niños es de 40 miligramos por kilo de peso por día. La tabla a continuación indica el número de mililitros que debe administrarse a un niño dependiendo de su peso corporal. Recuerde que esto es tan solo una guía. El médico del niño decidirá si le prescribe una dosis ligeramente diferente.
Peso corporal: | 10 a 15 kg: | 0,5-1 g/día | 5 a 10 ml solución/día |
15 a 30 kg: | 1-1,5 g/día | 10 a 15 ml solución/día | |
30 a 50 kg: | 1,5-3 g/día | 15 a 30 ml solución/día | |
más de 50 kg: | 2 a 3 g/día (dosis adulta) | 20 a 30 ml solución/día (dosis adulta) |
Niños con espasmos infantiles (Síndrome de West)
La dosis inicial recomendada para lactantes con Síndrome de West (espasmos infantiles) es de 50 miligramos de vigabatrina por kilo de peso corporal por día, aunque algunas veces pueden usarse dosis superiores.
Forma de administración
Vigzip es para uso por vía oral
Este medicamento puede tomarse antes o después de las comidas
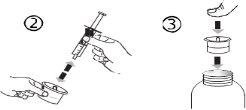
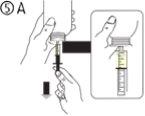
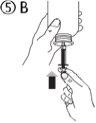
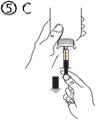
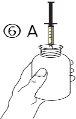
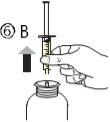
El envase contiene una jeringa para uso oral (10 ml con graduaciones cada 0,25 ml después del primer 1,0 ml) y con un adaptador.
Una jeringa de uso por via oral llena (10 ml) equivale a 1.000 mg (1 g) de vigabatrina. El volumen mínimo que puede extraerse es de 1,0 ml (100 mg de vigabatrina). Los volúmenes superiores a 1,0 ml pueden extraerse en incrementos de 0,25 ml, que equivalen a 25 mg de vigabatrina.
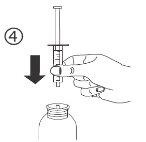
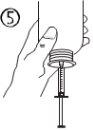
Instrucciones de uso |
|
|
|
|
|
|
|
|
|
|
|
|
Para volúmenes superiores a 10 ml, repita los pasos 4 a 6 hasta administrar la dosis completa. |
|
Si toma másVigzip del que debe
Si usted o su hijo toman accidentalmente demasiado Vigzip o demasiadas dosis, consulte de inmediato a su médico o diríjase al hospital o Servicio de Información Toxicológica más próximos.
Los posibles síntomas de sobredosis incluyen somnolencia o pérdida/disminución del nivel de consciencia.
En caso de sobredosis o ingestion accidental, consulte con su medico o llame al Servicio de Informacion Toxicologica, telefono 91 562 04 20, indicando el medicamento y la cantidad ingerida.
Si olvidó tomar VIGZIP
Si olvidó tomar una dosis, tómela en cuanto lo recuerde. Si es casi el momento de tomar la dosis siguiente, tome únicamente una dosis. No tome una dosis doble para compensar la dosis olvidada.
Si interrumpe el tratamiento con VIGZIP
No debe interrumpir el tratamiento prematuramente sin consultarlo antes con su médico. Si su médico decide interrumpir su tratamiento le dará recomendaciones sobre cómo reducir gradualmente la dosis. No lo interrumpa abruptamente, ya que esto puede hacer que vuelvan sus ataques de nuevo.
Si tiene alguna duda relacionada con el uso de este medicamento, consulte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Algunos pacientes pueden experimentar un aumento del número de ataques (convulsiones) mientras estén tomando este medicamento. Si le ocurre esto a usted o a su hijo, comuníquese con su médico de inmediato.
Informe a su médico de inmediato si experimenta:
- Alteraciones en el campo visual: Alrededor de 1/3 o 33 de cada 100 pacientes tratados con vigabatrina pueden sufrir cambios en el campo visual (estrechamiento del campo visual). Este “defecto del campo visual” puede ser de leve a grave. Generalmente se detectan después de meses o años de tratamiento con vigabatrina. Los cambios en el campo visual pueden ser irreversibles, por lo que es esencial detectarlos temprano. Si usted o su hijo experimenta algún trastorno visual, comuníquese con su médico u hospital de inmediato (muy frecuente: puede afectar a más de 1 de cada 10 personas)
Otros efectos adversos incluyen:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- Cansancio y somnolencia acentuada
- Dolor en las articulaciones.
Frecuentes(pueden afectar hasta 1 de cada 10 personas)
- Dolor de cabeza
- Aumento de peso
- Temblor
- Hinchazón (edema)
- Mareo
- Sensación de entumecimiento u hormigueo
- Alteraciones de concentración y memoria
- Alteraciones psicológicas, incluyendo agitación, agresión, nerviosismo, irritabilidad, depresión, alteraciones del pensamiento y sospechas infundadas (paranoia), insomnio. Estos efectos adversos son por lo general reversibles con la reducción de la dosis o la suspensión gradual del tratamiento. No obstante, no reduzca su dosis sin consultar antes a su médico. Contacte a su médico si experimenta estos efectos adversos
- Náuseas, vómitos y dolor abdominal
- Visión borrosa, visión doble y movimientos rápidos involuntarios de los ojos, que pueden causar mareos
- Trastornos del habla
- Disminución del número de glóbulos rojos (anemia)
- Caída poco habitual del pelo o pelo debilitado (alopecia).
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas)
- Falta de coordinación en los movimientos o torpeza
- Trastornos psicológicos más graves como exaltación o sobre-excitación, que da lugar a conductas inusuales, desconectado de la realidad
- Erupción en la piel.
Raros(pueden afectar hasta 1 de cada 1.000 personas)
- Reacción alérgica grave, que produce hinchazón de la cara o la garganta. Si experimenta alguno de estos síntomas, informe a su médico de inmediato.
- Urticaria
- Marcada sedación, estupor y confusión. Estos efectos adversos son normalmente reversibles al reducir la dosis o interrumpir gradualmente el tratamiento. No obstante no reduzca su dosis sin consultar antes a su médico. Comuníquese con su médico si experimenta estos efectos adversos
- Intento de suicidio
- Otros trastornos oculares como trastorno de la retina, por ejemplo, mala visión nocturna y dificultad para ajustarse de áreas brillantes a áreas más oscuras, pérdida repentina o inexplicable de la vista, pérdida de visión en los bordes del campo de visión, sensibilidad a la luz.
Muy raros(pueden afectar hasta 1 de cada 10.000 personas)
- Otros trastornos del ojo tales como dolor ocular (neuritis óptica) y pérdida de visión, incluyendo distinción de los colores (atrofia óptica)
- Alucinaciones (sentir, ver u oír cosas que no están ahí)
- Trastornos hepáticos.
Frecuencia no conocida(la frecuencia no puede estimarse a partir de los datos disponibles)
- Disminución de la agudeza visual
- Cambios anormales en las imágenes cerebrales tomadas por RMN
- Hinchazón en la capa protectora de células nerviosas en la parte del cerebro observada en las imágenes de RMN
Efectos adversos adicionales en los niños
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- Excitación o inquietud.
Frecuencia no conocida(la frecuencia no puede estimarse a partir de los datos disponibles)
- Trastornos del movimiento en niños pequeños tratados para espasmos infantiles
- Cambios anormales en las imágenes cerebrales tomadas por RMN, en especial en los lactantes
- Hinchazón en la capa protectora de células nerviosas en la parte del cerebro observada en las imágenes de RMN, especialmente en lactantes.
.
Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Vigzip
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el envase y la etiqueta del frasco después de CAD. La fecha de caducidad es el último día del mes que se indica.
- No conservar a temperaturas superiores a 30°C.
- Desechar al cabo de 90 días de la primera apertura del frasco. No conservar a temperaturas superiores a 25°C tras abrir el frasco por primera vez.
- No use este medicamento si nota que la solución ha cambiado de color, o si muestra signos de deterioro. Consulte a su farmacéutico.
- Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el punto Sigre de su farmacia habitual. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composicion deVigzip
El principio activo es vigabatrina.
Cada ml contiene 100 mg de vigabatrina.
Los demás ingredientes son parahidroxibenzoato de metilo (E 218), parahidroxibenzoato de propilo (E 216), sucralosa y sabor a hierbabuena (contiene mentofurano, pulegona, estragol).
Aspecto de producto y contenido del envase
Solución oral
Vigzip es una solución transparente, de incolora a amarillo pálido.
Frasco de HDPE con cierres a prueba de niños, que contiene 150 ml de solución oral.
El envase contiene una jeringa de uso oral de 10 ml con marcas impresas a 1,0 ml, 2,0 ml, 3,0 ml, 4,0 ml, 5,0 ml, 6,0 ml, 7,0 ml, 8,0 ml, 9,0 y 10,0 ml y graduaciones a cada 0,25 ml después de la marca de 1,0 ml; junto con un adaptador para el frasco.
Titular de la Autorización de Comercialización
RIA Generics Limited
The Black Church
St. Mary’s Place, Dublín 7
D07 P4AX, Irlanda
Responsable de la fabricación
RIA Generics Limited
Cube Building, Monahan Road,
Cork, T12 H1XY, Irlanda
Fecha de la última revisión de este prospecto: 02/2024
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a VIGZIP 100 MG/ML SOLUCION ORALForma farmacéutica: COMPRIMIDO, 100 mgPrincipio activo: vigabatrinaFabricante: Orphelia PharmaRequiere recetaForma farmacéutica: COMPRIMIDO, 500 mgPrincipio activo: vigabatrinaFabricante: Orphelia PharmaRequiere recetaForma farmacéutica: COMPRIMIDO, 500 mgPrincipio activo: vigabatrinaFabricante: Sanofi Aventis S.A.Requiere receta
Médicos online para VIGZIP 100 MG/ML SOLUCION ORAL
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de VIGZIP 100 MG/ML SOLUCION ORAL, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes