
VARILRIX POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA

Cómo usar VARILRIX POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Varilrix polvo y disolvente para solución inyectable en jeringa precargada
Vacuna antivaricela (virus vivos)
Lea todo el prospecto detenidamente antes de que usted o su hijo reciba este medicamento, porque contiene información importante para usted/su hijo.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Esta vacuna se le ha recetado solamente a usted o a su hijo, y no debe dárselo a otras personas.
- Si usted o su hijo experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Varilrix y para qué se utiliza
- Qué necesita saber antes de que usted o su hijo reciba Varilrix
- Cómo se administra Varilrix
- Posibles efectos adversos
- Conservación de Varilrix
- Contenido del envase e información adicional
1. Qué es Varilrix y para qué se utiliza
Varilrix es una vacuna para uso en personas a partir de los 12 meses de edad para protegerlos contra la varicela. En algunas circunstancias, Varilrix también se puede administrar a lactantes a partir de los 9 meses de edad.
La vacunación dentro de los 3 días posteriores al contacto con un caso de varicela puede ayudar a prevenir la varicela o a reducir la gravedad de la enfermedad.
Cómo funciona Varilrix
Cuando se vacuna a una persona con Varilrix, el sistema inmunológico (el sistema de defensa natural del cuerpo) producirá anticuerpos para proteger a la persona de la infección por el virus de la varicela. Varilrix contiene virus debilitados, por lo que es muy improbable que cause la varicela en personas sanas.
Al igual que con cualquier vacuna, puede que Varilrix no proteja completamente a todas las personas vacunadas.
2. Qué necesita saber antes de que usted o su hijo reciba Varilrix
No useVarilrix
- Si usted o su hijo padece alguna enfermedad (como trastornos sanguíneos, cáncer, infección por el Virus de la Inmunodeficiencia Humana (VIH) o Síndrome de Inmunodeficiencia adquirida (SIDA)) o está tomando algún medicamento (incluyendo dosis altas de corticosteroides) que pueda debilitar el sistema inmune. Que usted o su hijo reciba la vacuna va a depender del nivel de sus defensas. Ver sección 2 “Advertencias y precauciones”.
- Si usted o su hijo es alérgico a alguno de los componentes de esta vacuna (incluidos en la sección 6). Los signos de una reacción alérgica pueden incluir: erupción de la piel con picazón, dificultad para respirar e hinchazón de la cara o lengua.
- Si usted o su hijo es alérgico a la neomicina (un antibiótico). Los antecedentes de dermatitis de contacto (erupción cutánea producida cuando la piel entra en contacto directo con alérgenos tales como la neomicina) no deben ser una razón para no vacunarse. Sin embargo, consulte primero a su médico.
- Si usted o su hijo ha tenido previamente una reacción alérgica a cualquier vacuna frente a la varicela.
- Si usted o su hija está embarazada. Además, se debe evitar el embarazo durante 1 mes después de la vacunación.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de que usted o su hijo reciba Varilrix:
- Si usted o su hijo padece una infección grave con fiebre alta. Puede que sea necesario posponer la vacunación hasta su recuperación. Una infección de poca importancia, como un resfriado, no requiere posponer la vacunación. Sin embargo, consulte primero con su médico.
- Si usted o su hijo tiene un sistema inmunitario debilitado debido a enfermedades (p.ej., infección por el VIH) y/o tratamientos. Usted o su hijo debe ser vigilado estrechamente ya que la respuesta a la vacunación puede no ser suficiente para asegurar una protección frente a la enfermedad (ver sección 2 “No use Varilrix”).
- si usted padece problemas de sangrado o le salen moratones con facilidad.
Antes o después de cualquier inyección, podría producirse un desmayo (especialmente en los adolescentes), por lo que debe informar a su médico o enfermero si usted o su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Al igual que otras vacunas, puede que Varilrix no le proteja completamente a usted o su hijo frente a la varicela. Sin embargo, las personas que han sido vacunadas y desarrollan la varicela tienen, normalmente, una enfermedad muy leve en comparación con las personas que no han sido vacunadas.
En raras ocasiones, el virus debilitado puede transmitirse de una persona vacunada a otras. Normalmente, esto sucede cuando la persona vacunada tiene algunas manchas o ampollas en la piel. Las personas sanas que se infectan de este modo sólo desarrollan, normalmente, una erupción de la piel leve que no es perjudicial.
Una vez vacunado, usted o su hijo debe evitar, en la medida de lo posible, durante 6 semanas después de la vacunación, una relación estrecha con las siguientes personas:
- personas con un sistema inmunológico debilitado,
- mujeres embarazadas que no hayan sufrido la varicela o no hayan sido vacunadas frente a la varicela,
- lactantes recién nacidos de madres que no hayan sufrido la varicela o no hayan sido vacunadas frente a la varicela.
Otros medicamentos y Varilrix
Informe a su médico o farmacéutico si usted o su hijo está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otra vacuna y/o medicamento.
Informe a su médico si usted o su hijo tiene que hacerse una prueba cutánea para detectar una posible tuberculosis. Si esta prueba se realiza dentro de las 6 semanas posteriores a la administración de Varilrix, puede que el resultado no sea fiable.
Se debe retrasar la vacunación durante al menos 3 meses si usted o su hijo ha recibido una transfusión de sangre o anticuerpos humanos (inmunoglobulinas).
Se debe evitar el uso de aspirina u otros salicilatos (una sustancia presente en algunos medicamentos usados para rebajar la fiebre y aliviar el dolor) durante 6 semanas después de la vacunación con Varilrix, puesto que esto puede producir una enfermedad grave llamada Síndrome de Reye que puede afectar a todos los órganos del cuerpo.
Varilrix se puede administrar al mismo tiempo que otras vacunas. Se empleará un lugar de inyección distinto para cada vacuna.
Embarazo y lactancia
Varilrix no se debe administrar a mujeres embarazadas.
Si usted o su hija está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de que le administren la vacuna. También es importante que usted o su hija no se quede embarazada durante un mes después de la vacunación. Durante este tiempo se debe utilizar un método anticonceptivo efectivo para evitar el embarazo.
Informe a su médico si usted o su hija está dando el pecho o si tiene intención de hacerlo. Su médico decidirá si a usted o a su hija le deben administrar Varilrix.
Conducción y uso de máquinas
Varilrix tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunos de los efectos mencionados en la sección 4 "Posibles efectos adversos" pueden afectar de forma temporal a la capacidad para conducir o utilizar máquinas.
Varilrix contiene sorbitol y fenilalanina
Esta vacuna contiene 6 mg de sorbitol en cada unidad de dosis.
Esta vacuna contiene 331 microgramos de fenilalanina en cada unidad de dosis. La fenilalanina puede ser perjudicial en caso de padecer fenilcetonuria (FCN), una enfermedad genética rara en la que la fenilalanina se acumula debido a que el organismo no es capaz de eliminarla correctamente.
3. Cómo se administra Varilrix
Varilrix se inyecta bajo la piel o en un músculo, ya sea en la parte superior del brazo o en la parte exterior del muslo.
Las personas a partir de los 12 meses de edad deben recibir 2 dosis de Varilrix con al menos 6 semanas de diferencia. El tiempo entre la primera y la segunda dosis no debeser inferior a 4 semanas.
En algunas circunstancias, se puede administrar la primera dosis de Varilrix a bebés de 9 a 11 meses de edad. En estos casos, se necesitan dos dosis y se deben administrar con, al menos, 3 meses de diferencia.
Las personas que tienen riesgo de varicela grave, como las que reciben tratamiento para el cáncer, pueden recibir dosis adicionales. El intervalo entre dosis no debeser inferior a 4 semanas.
Su médico determinará el momento y el número de dosis apropiados en base a las recomendaciones oficiales correspondientes.
Si usted o su hijo recibe más Varilrix del que debe
La sobredosis es muy poco probable porque la vacuna se proporciona en un vial de una sola dosis y es administrada por un médico o enfermero. No obstante, si usted o su hijo recibe más Varilrix del que debe, consulte inmediatamente a su médico, farmacéutico o enfermero o llame al Servicio de Información Toxicológica, teléfono 91 562 04 20.
Se han notificado pocos casos de administración accidental y sólo en algunos de ellos se notificaron sonmolencia anormal y ataques (convulsiones).
Si cree que usted o su hijo olvidó recibir una dosis de Varilrix
Contacte con su médico, quien decidirá si se requiere una dosis y cuándo administrarla.
4. Posibles efectos adversos
Al igual que con todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Se pueden producir los siguientes efectos adversos con esta vacuna:
- Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- dolor y enrojecimiento en el lugar de la inyección
- Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- erupción cutánea (manchas y/o ampollas)
- hinchazón en el lugar de la inyección*
- fiebre igual o superior a 38ºC (rectal)*
- Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- infección de las vías respiratorias altas
- dolor de garganta y molestias al tragar (faringitis)
- hinchazón de los ganglios linfáticos
- irritabilidad
- dolor de cabeza
- somnolencia
- tos
- picazón, secreción o congestión nasal, estornudos (rinitis)
- náuseas
- vómitos
- erupción similar a la varicela
- picor
- dolor en las articulaciones
- dolor en los músculos
- fiebre superior a 39,5 ºC (rectal)
- falta de energía (cansancio)
- malestar general
- Raros (pueden afectar hasta 1 de cada 1000 personas):
- inflamación del ojo (conjuntivitis)
- dolor de estómago
- diarrea
- erupción abultada con picazón (urticaria)
*La hinchazón en el lugar de la inyección y la fiebre pueden ocurrir muy frecuentemente en adolescentes y en adultos. La hinchazón también puede ocurrir muy frecuentemente tras la segunda dosis en niños menores de 13 años de edad.
Se han notificado los siguientes efectos adversos en algunas ocasiones, durante el uso rutinario de Varilrix:
- herpes zóster
- pequeñas manchas hemorrágicas o aparición de moratones con más facilidad de lo normal debido a la disminución de un tipo de células de la sangre llamadas plaquetas
- reacciones alérgicas. Erupciones que pueden causar picazón o ampollas, hinchazón de los ojos y de la cara, dificultad para respirar o tragar, bajada repentina de la presión sanguínea y pérdida de la consciencia. Es posible que estas reacciones se produzcan antes de abandonar la consulta del médico. Sin embargo, si usted o su hijo desarrolla cualquiera de estos síntomas, contacte urgentemente con un médico
- infección o inflamación del cerebro, médula espinal y nervios periféricos que produce dificultad temporal para caminar (inestabilidad) y/o pérdida temporal del control de los movimientos corporales, ictus (daño cerebral producido por una interrupción del flujo de sangre)
- ataques o convulsiones
- inflamación, estrechamiento o taponamiento de los vasos sanguíneos. Esto puede implicar sangrado inusual o aparición de moratones debajo de la piel (púrpura de Henoch-Schönlein) o fiebre con una duración superior a cinco días asociada con una erupción en el tronco seguida, en ocasiones, de un descamación de la piel en manos y dedos, enrojecimiento de los ojos, de los labios, de la garganta y de la lengua (enfermedad de Kawasaki)
- eritema multiforme (los síntomas son manchas rojas, a menudo con picazón, similares a la erupción del sarampión, que comienza en las extremidades y, a veces, en la cara y el resto del cuerpo).
Comunicación de efectos adversos
Si usted o su hijo experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Varilrix
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar en nevera (entre 2º C y 8º C).
Conservar en el embalaje original para protegerla de la luz.
Después de la reconstitución, la vacuna se debe administrar inmediatamente.
Si no es posible, la vacuna reconstituida se puede mantener hasta 90 minutos a temperatura ambiente (25º C) o hasta 8 horas en nevera (entre 2º C y 8º C). Si no se utiliza dentro de los plazos y las condiciones de almacenamiento en uso recomendados, la vacuna reconstituida debe ser desechada.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Varilrix
- El principio activo es: virus vivos atenuados de la varicela (cepa Oka, producidos en
células diploides humanas MRC-5). Cada dosis de 0,5 ml de la vacuna reconstituida contiene no menos de 103,3 UFP (unidades formadoras de placa) del virus de la varicela.
- Los demás componentes son:
Polvo: aminoácidos (que contienen fenilalanina), lactosa anhidra, sorbitol (E-420), manitol (E-421).
Disolvente: agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Varilrix se presenta como un polvo y disolvente para solución inyectable (polvo en un vial para 1 dosis y disolvente en una jeringa precargada (0,5 ml), con o sin agujas separadas en los siguientes tamaños de envase:
- con 1 aguja separada: tamaños de envase de 1 o 10.
- con 2 agujas separadas: tamaños de envase de 1 o 10.
- sin agujas: tamaños de envase de 1 o 10.
Varilrix se suministra como un polvo de color crema claro a amarillento o rosáceo y un disolvente incoloro transparente (agua para preparaciones inyectables) para reconstituir la vacuna.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
GlaxoSmithKline, S.A.
PTM C/ Severo Ochoa 2
28760 - Tres Cantos
Madrid
Teléfono: 900 202 700
Fax: 91 807 03 10
e-mail: [email protected]
Responsable de la fabricación
GlaxoSmithKline Biologicals
Rue de l´Institut 89
1330 Rixensart (Bélgica)
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeocon los siguientes nombres:
Estado miembro | Nombre |
Alemania, Austria, Bélgica, Chipre, Dinamarca, Estonia, Finlandia, Francia, Grecia, Hungría, Islandia, Italia, Luxemburgo, Malta, Noruega, Polonia, Portugal, República Checa, Rumanía, Suecia | VARILRIX |
España | VARILRIX polvo y disolvente para solución inyectable en jeringa precargada |
Letonia | Varilrix pulveris un škidinatajs injekciju škiduma pagatavošanai pilnšlirce |
Lituania | Varilrix milteliai ir tirpiklis injekciniam tirpalui užpildytame švirkšte |
Fecha de la última revisión de este prospecto:05/2025
Otras fuentes de información
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
-------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario:
Al igual que con todas las vacunas inyectables, debe existir una vigilancia médica adecuada y disponer de tratamiento médico en caso de que se produjese una reacción anafiláctica infrecuente tras la administración de la vacuna.
Se debe permitir que el alcohol y otros agentes antisépticos se evaporen de la piel antes de inyectar la vacuna, ya que pueden inactivar los virus atenuados en la vacuna.
Varilrix no debe administrarse por vía intravascular ni intradérmica.
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
Se deben inspeccionar visualmente el disolvente y la vacuna reconstituida. El color de la vacuna reconstituida puede oscilar entre el naranja claro y el rosa debido a pequeñas variaciones de su pH. Puede contenerpartículas translúcidas relacionadas con el producto. Esto es normal y no compromete la acción de la vacuna.
No administrar si la vacuna presenta otra coloración o contiene otras partículas.
La vacuna se debe reconstituir añadiendo todo el contenido de la jeringa precargada de disolvente al vial que contiene el polvo.
Para saber cómo insertar la aguja en la jeringa, léanse detenidamente las instrucciones proporcionadas con las imágenes 1 y 2. No obstante, la jeringa facilitada con Varilrix puede ser ligeramente diferente (sin rosca de tornillo) a la jeringa de la imagen. En tal caso, la aguja deberá insertarse sin enroscar.
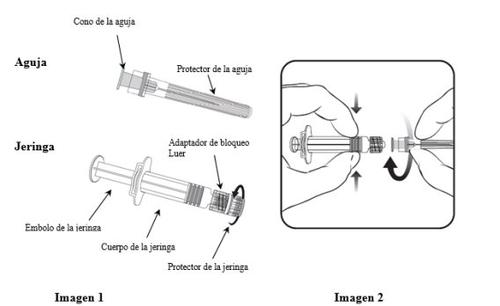
Sujetar siempre la jeringa por el cuerpo, no por el émbolo ni por el adaptador de bloqueo Luer (ABL), y mantener la aguja en el eje de la jeringa (cómo se muestra en la imagen 2). De lo contrario, el ABL podría deformarse y causar fugas.
Si durante el ensamblaje de la jeringa se desprende el ABL, usar una nueva dosis de la vacuna (nueva jeringa y vial).
- Desenroscar el protector de la jeringa girándolo en sentido contrario a las agujas del reloj (como se muestra en la imagen 1).
Tanto si el ABL gira como si no, por favor, siga los siguientes pasos:
- Insertar la aguja en la jeringa encajando con delicadeza el cono de la aguja en el ABL y girar un cuarto de vuelta en el sentido de las agujas del reloj hasta sentir que se bloquea (como se muestra en la imagen 2).
- Retirar el protector de la aguja (puede resultar difícil).
- Añadir el disolvente al polvo. Se debe agitar bien la mezcla hasta que el polvo esté completamente disuelto.
- Retirar todo el contenido del vial
- Se debe utilizar una aguja nueva para administrar la vacuna. Desenroscar la aguja de la jeringa e insertar la aguja para la inyeción repitiendo el paso 2 anterior.
Después de la reconstitución, se recomienda inyectar la vacuna lo antes posible. Sin embargo, se ha demostrado que la vacuna reconstituida se puede mantener hasta 90 minutos a temperatura ambiente (25º C) y hasta 8 horas en nevera (entre 2º C y 8º C). Si no se utiliza dentro de los plazos y las condiciones de almacenamiento en uso recomendados, la vacuna reconstituida debe ser desechada.
La eliminación de la vacuna no utilizada y de todos los materiales que hayan estado en contacto con ella, se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a VARILRIX POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: INYECTABLE, mínimo de 1350 UFP/0.5 ml dosisPrincipio activo: varicella, live attenuatedFabricante: Schering Plough S.A.Requiere recetaForma farmacéutica: INYECTABLE, 50 microgramosPrincipio activo: zoster, purified antigenFabricante: Glaxosmithkline BiologicalsRequiere recetaForma farmacéutica: INYECTABLE, 60 microgramos/dosis + 60 microgramos/dosisPrincipio activo: respiratory syncytial virus vaccinesFabricante: Pfizer Europe Ma EeigRequiere receta
Médicos online para VARILRIX POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de VARILRIX POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















