
TECARTUS 0,4 - 2 x 10e8 CELULAS DISPERSION PARA PERFUSION

Cómo usar TECARTUS 0,4 - 2 x 10e8 CELULAS DISPERSION PARA PERFUSION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Tecartus 0.4 – 2 × 108células dispersión para perfusión
células CD3+ autólogas transducidas anti-CD19 (células T CAR+ viables)
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Su médico le entregará una tarjeta de información para el paciente. Léala detenidamente y siga las instrucciones.
- Muestre siempre la tarjeta de información para el paciente al médico o enfermero que le trate o si acude al hospital.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Tecartus y para qué se utiliza
- Qué necesita saber antes de que le administren Tecartus
- Cómo se administra Tecartus
- Posibles efectos adversos
- Conservación de Tecartus
- Contenido del envase e información adicional
1. Qué es Tecartus y para qué se utiliza
Tecartus es un medicamento de terapia génica que se utiliza para el tratamiento del linfoma de células del manto en adultos. Se utiliza cuando otros medicamentos ya no resultan eficaces para su tratamiento (linfoma de células del manto refractario o en recaída). Este medicamento se prepara de manera específica para usted a partir de sus propios glóbulos blancos modificados y que se conocen como células CD3+ autólogas transducidas anti-CD19.
El linfoma de células del manto es un cáncer que afecta a una parte del sistema inmunitario (las defensas del organismo) . Este cáncer afecta a un tipo de glóbulos blancos denominados linfocitos B. En el linfoma de células del manto los linfocitos B crecen de forma descontrolada y se acumulan en el tejido linfático, la médula ósea o la sangre.
Cómo funciona Tecartus
Los glóbulos blancos se extraen de su sangre y se modifican genéticamente, de modo que puedan dirigirse a las células cancerosas en su organismo. Cuando le administren la perfusión de Tecartus en su sangre, los glóbulos blancos modificados destruirán las células cancerosas.
2. Qué necesita saber antes de que le administren Tecartus
No le administrarán Tecartus
- si es alérgico a alguno de los demás componentes de este medicamento (incluidos en la sección 6). Si cree que puede ser alérgico, consulte a su médico para que le aconseje.
- si no puede recibir el medicamento para reducir el número de glóbulos blancos en su sangre (quimioterapia de linfodepleción) (ver también sección 3, «Cómo se administra Tecartus»).
Advertencias y precauciones
Tecartus se prepara a partir de sus propios glóbulos blancos y solo se le debe administrar a usted (usoautólogo).
Análisis y comprobaciones
Antes de que le administren Tecartus su médico:
- Examinará sus pulmones, su corazón y sus riñones y comprobará su presión arterial.
- Buscará signos de infección o inflamación y decidirá si debe recibir tratamiento antes de que le administren Tecartus.
- Comprobará si su cáncer está empeorando.
- Buscará signos de enfermedad del injerto contra el huésped que se pueden presentar después de un trasplante. Esto sucede cuando las células trasplantadas atacan su organismo, causando síntomas como erupción, náuseas, vómitos, diarrea y heces con sangre.
- Comprobará el ácido úrico y la cantidad de células cancerosas que hay en su sangre. Esto demostrará si es probable que desarrolle una complicación denominada síndrome de lisistumoral. Es posible que se le administren medicamentos para ayudar a prevenir la complicación.
- Comprobará si tiene hepatitis B, hepatitis C o infección por el VIH.
- Comprobará si le vacunaron en las últimas 6 semanas o si está planificado que le administren una vacuna en los próximos meses.
- Comprobará si ha recibido previamente un tratamiento que se une a la proteína llamada CD19.
En ocasiones, puede que no sea posible administrar el tratamiento previsto con Tecartus. Si la administración de la perfusión de Tecartus se retrasa más de 2 semanas después de que haya recibido la quimioterapia de linfodepleción, puede que usted tenga que recibir más quimioterapia (ver también sección 3, «Cómo se administra Tecartus»).
Después de que le administren Tecartus
Si nota cualquiera de los siguientes síntomas, informe a su médico o enfermero inmediatamente o busque atención médica urgente de inmediato:
- Escalofríos, cansancio extremo, debilidad, mareos, dolor de cabeza, tos, dificultad para respirar, ritmo cardiaco acelerado o irregular, náuseas, vómitos o diarrea intensos; estos pueden ser síntomas de una complicación denominada síndrome de liberación de citoquinas. Tómese la temperatura dos veces al día durante 3 a 4 semanas después del tratamiento con Tecartus. Si su temperatura es alta, consulte a su médico de inmediato.
- Convulsiones, temblores o dificultad para hablar o alteración del habla, pérdida de consciencia o disminución del nivel de consciencia, confusión y desorientación, pérdida del equilibrio o de la coordinación.
- Fiebre (p. ej., temperatura de más de 38 °C), que puede ser síntoma de infección.
- Cansancio extremo, debilidad y dificultad para respirar, que pueden ser síntomas de niveles bajos de glóbulos rojos.
- Hemorragia o aparición de hematomas con facilidad, que pueden ser síntomas de niveles bajos de un tipo de células sanguíneas denominadas plaquetas.
Si algo de lo anterior es aplicable a usted (o no está seguro), consulte a su médico o enfermero.
Su médico comprobará sus recuentos sanguíneos con frecuencia ya que el número de células sanguíneas y de otros componentes de la sangre puede disminuir.
Se le pedirá que se inscriba en un registro durante al menos 15 años con el fin de entender mejor los efectos a largo plazo de Tecartus.
No done sangre, órganos, tejidos ni células para trasplantes.
Niños y adolescentes
No se debe administrar Tecartus a niños y adolescentes menores de 18 años.
Otros medicamentos y Tecartus
Informe a su médico o enfermero si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
Antes de que le administren Tecartus, informe a su médico o enfermero si está tomando cualquier medicamento que debilite el sistema inmunitario, como los corticoesteroides, ya que estos medicamentos pueden interferir en el efecto de Tecartus.
No le deben administrar determinadas vacunas denominadas vacunas con virus vivos, en particular:
- Durante las 6 semanas previas a que le administren el ciclo corto de quimioterapia de linfodepleción para preparar su cuerpo para las células de Tecartus.
- Durante el tratamiento con Tecartus.
- Después del tratamiento mientras se recupera el sistema inmunitario.
Consulte a su médico si necesita alguna vacuna.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de que le administren este medicamento. Esto se debe a que se desconocen los efectos de Tecartus en mujeres embarazadas o en periodo de lactancia, y puede dañar al feto o al lactante.
- Si está embarazada o cree que podría estar embarazada después del tratamiento con Tecartus, consulte a su médico de inmediato.
- Se le realizará una prueba del embarazo antes de que comience el tratamiento. Tecartus solo debe administrarse si los resultados muestran que no está embarazada.
Hable con su médico sobre el embarazo si recibió Tecartus.
Conducción y uso de máquinas
Tecartus puede causar problemas, como alteración del nivel de consciencia o nivel de consciencia disminuido, confusión y crisis convulsivas (convulsiones) en las 8 semanas después de la administración.
No conduzca, no utilice máquinas ni participe en actividades que requieran concentración pesada durante por lo menos 8 semanas después del tratamiento con Tecartus o hasta que su médico confirme que se ha recuperado por completo.
Tecartus contiene sodio, dimetilsulfóxido (DMSO) y gentamicina
Este medicamento contiene 300 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada perfusión. Esto equivale al 15 % de la ingesta diaria máxima de sodio recomendada para un adulto. También contiene DMSO y gentamicina, que pueden causar reacciones de hipersensibilidad graves.
3. Cómo se administra Tecartus
Tecartus siempre le será administrado por un profesional sanitario.
- Dado que Tecartus se prepara a partir de sus propios glóbulos blancos, se le extraerán sus células a fin de preparar su medicamento. Su médico le extraerá un poco de sangre con un catéter colocado en una vena (procedimiento denominado leucaféresis). Se separan algunos glóbulos blancos de la sangre y el resto de la sangre se devuelve a la vena. Esto puede tardar de 3 a 6 horas y puede ser necesario repetirlo.
- Sus glóbulos blancos se envían a un centro de fabricación para elaborar Tecartus. Por lo general, se tarda de 2 a 3 semanas en elaborar Tecartus, pero el tiempo puede variar.
Medicamentos administrados antes del tratamiento con Tecartus
Unos días antes de recibir Tecartus le administrarán la quimioterapia de linfodepleción, lo que permitirá que los glóbulos blancos modificados en Tecartus se puedan multiplicar en su organismo una vez le administren el medicamento.
Durante los 30 a 60 minutos antes de que le administren Tecartus, es posible que le administren otros medicamentos. Esto sirve para ayudar a prevenir reacciones a la perfusión y fiebre. Estos otros medicamentos pueden incluir:
- Paracetamol.
- Un antihistamínico como difenhidramina.
Cómo le administran Tecartus
Tecartus siempre le será administrado por un médico en un centro médico cualificado.
- Tecartus se administra en una dosis única.
- Su médico o enfermero le administrará una perfusión única de Tecartus a través de un catéter colocado en una vena (perfusión intravenosa) durante unos 30 minutos.
- Tecartus es la versión de sus glóbulos blancos modificados genéticamente. El profesional sanitario que manipule el tratamiento tomará, por lo tanto, las precauciones necesarias (usar guantes y gafas) para evitar una posible transmisión de enfermedades infecciosas y seguirá las guías locales para el tratamiento de residuos de material de origen humano para la limpieza y la eliminación de cualquier material que haya estado en contacto con dicho tratamiento.
Después de que le administren Tecartus
- Debe permanecer en un lugar próximo al hospital en donde le trataron al menos durante 4 semanas después del tratamiento con Tecartus. Su médico le recomendará que vuelva al hospital a diario durante al menos 10 días o que se quede hospitalizado durante los primeros 10 días después del tratamiento con Tecartus. Esto es para que su médico pueda comprobar si su tratamiento está funcionando y ayudarle si presenta algún efecto adverso.
En caso de que no pueda acudir a alguna cita, póngase en contacto con su médico o con su centro de tratamiento lo antes posible para reprogramar la cita.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. No intente tratar los efectos adversos usted mismo.
Tecartus puede provocar efectos adversos que pueden ser graves o potencialmente mortales. Obtengaatención médica urgentesi experimenta cualquiera de los efectos adversos siguientes tras la perfusión de Tecartus.
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas
- Fiebre, escalofríos, disminución de la tensión arterial que puede dar lugar a síntomas como mareos, aturdimiento, acumulación de líquido en los pulmones que puede ser grave y mortal (todos ellos son síntomas de una complicación denominada síndrome de liberación decitoquinas).
- Pérdida de la consciencia o disminución del nivel de consciencia, confusión o pérdida de la memoria debido a trastornos de la función cerebral, dificultad para hablar o alteración del habla, sacudidas involuntarias (temblores), convulsiones (crisis convulsivas),confusión repentina con agitación, desorientación, alucinaciones o irritabilidad (delirio).
- Fiebre, escalofríos, que pueden ser signos de infección.
Otros posibles efectos adversos
A continuación se enumeran otros efectos adversos. Informe a su médico inmediatamente si estos efectos adversos se vuelven intensos o graves.
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas
- Un número anormalmente bajo de glóbulos blancos, lo que puede aumentar el riesgo de infección.
- Un número bajo de células que ayudan a coagular la sangre (trombocitopenia), alteración de la capacidad de coagulación de la sangre: los síntomas pueden incluir hemorragia excesiva o prolongada o hematomas.
- Tensión arterial alta.
- Descenso del número de glóbulos rojos (las células que transportan oxígeno): los síntomas pueden incluir cansancio extremo con falta de energía.
- Cansancio extremo.
- Ritmo cardíaco acelerado o lento.
- Descenso del nivel de oxígeno que alcanza los tejidos corporales: los síntomas pueden incluir cambios en el color de la piel, confusión y respiración acelerada.
- Dificultad para respirar, tos.
- Náuseas, estreñimiento, diarrea, dolor abdominal, vómitos, dificultad para tragar.
- Dolor muscular, dolor articular, dolor de huesos, dolor en las extremidades del cuerpo.
- Falta de energía o fuerza, debilidad muscular, dificultad para moverse, espasmos musculares.
- Dolor de cabeza.
- Problemas de riñón que causan una acumulación de líquidos en su organismo, una acumulación de líquidos en los tejidos (edema)que puede provocar aumento de peso, dificultar para respirar y excreción urinaria disminuida.
- Niveles elevados de ácido úrico en los análisis de sangre.
- Niveles bajos de sodio, fosfato, potasio o calcio en los análisis de sangre.
- Diminución del apetito, dolor bucal.
- Dificultad para dormir, ansiedad.
- Hinchazón en las extremidades, acumulación de líquidos alrededor de los pulmones (derramepleural).
- Erupción cutánea.
- Niveles bajos de inmunoglobulinas en los análisis de sangre, lo que puede dar lugar a infecciones.
- Aumento de los niveles de enzimas hepáticas en los análisis de sangre.
- Coágulos de sangre: los síntomas pueden incluir dolor en el pecho o en la parte superior de la espalda, dificultad para respirar, expectoración de sangre o dolor con calambres, hinchazón solo en una pierna, piel oscura y caliente alrededor de la zona dolorida.
- Dolor en los nervios.
Frecuentes: pueden afectar hasta 1 de cada 10 personas
- Niveles bajos de albúmina en los análisis de sangre.
- Hemorragia excesiva.
- Ritmo cardíaco irregular (arritmia).
- Pérdida del control de los movimientos corporales.
- Boca seca, deshidratación.
- Falta de aliento (insuficiencia respiratoria).
- Dificultad para respirar que le impide expresarse con frases completas y tos debido a una acumulación de líquido en los pulmones.
- Aumento de la presión intracraneal.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Tecartus
Esta información está destinada únicamente a médicos.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilizar este medicamento después de la fecha de caducidad que aparece en la etiqueta del contenedor y la bolsa para perfusión después de CAD.
Se debe conservar congelado en la fase vaporosa del nitrógeno líquido ≤ - 150 °C hasta el momento de la descongelación para su uso.
No vuelva a congelar.
Este medicamento contiene células sanguíneas humanas modificadas genéticamente. Se deben seguir las guías locales para el tratamiento de residuos de material de origen humano en lo que respecta al medicamento no utilizado o los residuos. Este medicamento lo administrarán profesionales sanitarios cualificados, que serán los responsables de la eliminación correcta del producto. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Tecartus
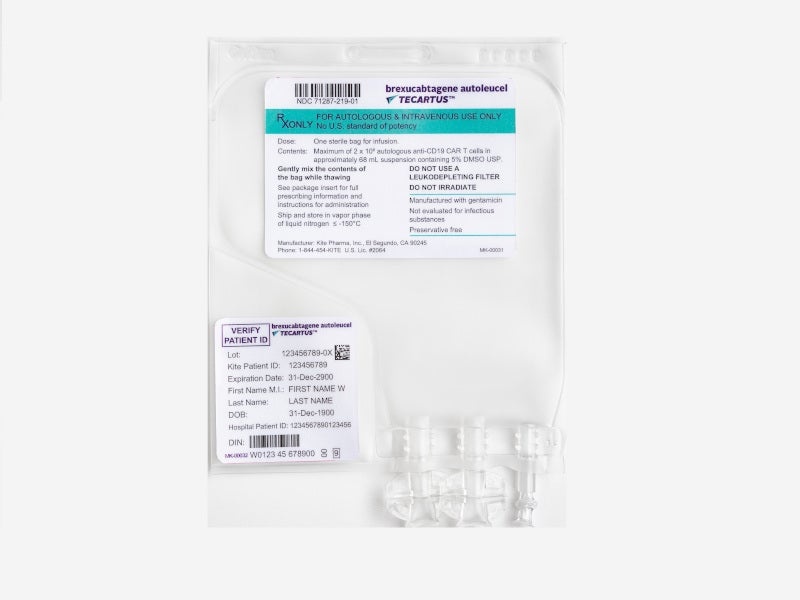
El principio activo es células CD3+ autólogas transducidas anti-CD19. Cada bolsa para perfusión individual específica de cada paciente contiene una dispersión de células T CAR anti-CD19 en 68 ml, aproximadamente, para una dosis objetivo de 2 x 106 células T CAR positivas anti-CD19 viables/kg. Los demás componentes (excipientes) son: Cryostor CS10, cloruro de sodio, albúmina humana. Ver sección 2 “Tecartus contiene sodio”.
Aspecto del producto y contenido del envase
Tecartus es una dispersión para perfusión de transparente a opaca, de color blanca a roja, que se suministra en una bolsa para perfusión envasada de forma individual en un contenedor metálico. Una bolsa para una perfusión contiene 68 ml de dispersión celular, aproximadamente.
Titular de la autorización de comercialización
Kite Pharma EU B.V.
Tufsteen 1
2132 NT Hoofddorp
Países Bajos
Responsable de la fabricación
Kite Pharma EU B.V.
Tufsteen 1
2132 NT Hoofddorp
Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Gilead Sciences Belgium SRL-BV Tél/Tel: + 32 (0) 24 01 35 50 | Lietuva Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 |
???????? Gilead Sciences Ireland UC ???.: + 353 (0) 1 686 1888 | Luxembourg/Luxemburg Gilead Sciences Belgium SRL-BV Tél/Tel: + 32 (0) 24 01 35 50 |
Ceská republika Gilead Sciences s.r.o. Tel: + 420 910 871 986 | Magyarország Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Danmark Gilead Sciences Sweden AB Tlf: + 46 (0) 8 5057 1849 | Malta Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Deutschland Gilead Sciences GmbH Tel: + 49 (0) 89 899890-0 | Nederland Gilead Sciences Netherlands B.V. Tel: + 31 (0) 20 718 36 98 |
Eesti Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 | Norge Gilead Sciences Sweden AB Tlf: + 46 (0) 8 5057 1849 |
Ελλ?δα Gilead Sciences Ελλ?ς Μ.ΕΠΕ. Τηλ: + 30 210 8930 100 | Österreich Gilead Sciences GesmbH Tel: + 43 1 260 830 |
España Gilead Sciences, S.L. Tel: + 34 91 378 98 30 | Polska Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 |
France Gilead Sciences Tél : + 33 (0) 1 46 09 41 00 | Portugal Gilead Sciences, Lda. Tel: + 351 21 7928790 |
Hrvatska Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 | România Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Ireland Gilead Sciences Ireland UC Tel: + 353 (0) 214 825 999 | Slovenija Gilead Sciences Ireland UC Tel: + 353 (0) 1 686 1888 |
Ísland Gilead Sciences Sweden AB Sími: + 46 (0) 8 5057 1849 | Slovenská republika Gilead Sciences Slovakia s.r.o. Tel: + 421 232 121 210 |
Italia Gilead Sciences S.r.l. Tel: + 39 02 439201 | Suomi/Finland Gilead Sciences Sweden AB Puh/Tel: + 46 (0) 8 5057 1849 |
Κ?προς Gilead Sciences Ελλ?ς Μ.ΕΠΕ. Τηλ: + 30 210 8930 100 | Sverige Gilead Sciences Sweden AB Tel: + 46 (0) 8 5057 1849 |
Latvija Gilead Sciences Poland Sp. z o.o. Tel: + 48 22 262 8702 | United Kingdom Gilead Sciences Ltd Tel: + 44 (0) 8000 113700 |
Fecha de la última revisión de este prospecto:
Este medicamento se ha autorizado con una «aprobación condicional».
Esta modalidad de aprobación significa que se espera obtener más información de este medicamento. La Agencia Europea de Medicamentos revisará la información nueva de este medicamento al menos una vez al año y este prospecto se actualizará cuando sea necesario.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
<------------------------------------------------------------------------------------------------------------------------>
Esta información está destinada únicamente a profesionales sanitarios:
Es importante leer todo el contenido relativo a este procedimiento antes de administrar Tecartus. Precauciones que se deben tomar antes de manipular o administrar el medicamento
- Tecartus contiene células modificadas genéticamente. Se deben seguir las guías locales aplicables para el tratamiento de material de origen humano en lo que respecta a dichos medicamentos.
- En el centro de administración, Tecartus se debe transportar en envases cerrados, a prueba de rotura y fugas.
- Tecartus se prepara a partir de sangre autóloga del paciente extraída por leucaféresis. El material de leucaféresis del paciente y Tecartus pueden conllevar un riesgo de transmisión de virus infecciosos a los profesionales sanitarios (PS) que manipulan el producto. Por lo tanto, los profesionales sanitarios que manipulen el material de leucaféresis o Tecartus deben tomar las precauciones necesarias (llevar guantes y gafas) para evitar una posible transmisión de enfermedades infecciosas.
Preparación de la perfusión
- Compruebe que la identificación (ID) del paciente coincide con los identificadores del paciente del contenedor metálico de Tecartus.
- No se debe sacar la bolsa para perfusión de Tecartus del contenedor metálico si la información de la etiqueta específica del paciente no corresponde al paciente que se va a tratar.
- Una vez confirmada la ID del paciente, saque la bolsa para perfusión del contenedor metálico.
- Compruebe que la información del paciente en la etiqueta del contenedor metálico coincide con la de la etiqueta de la bolsa.
- Inspeccione la bolsa para perfusión para comprobar la integridad del envase antes de su descongelación. Si la bolsa está dañada, siga las guías locales para el tratamiento de residuos de material de origen humano (o contacte con Kite de forma inmediata).
- Introduzca la bolsa para perfusión en una segunda bolsa.
- Descongele Tecartus a una temperatura aproximada de 37 °C, calentándolo al baño maría o mediante descongelado en seco, hasta que no haya hielo visible en la bolsa para perfusión. Mezcle suavemente el contenido de la bolsa para eliminar los agregados celulares. En el caso de que continúe habiendo agregados celulares visibles, siga mezclando suavemente el contenido de la bolsa. Los agregados celulares pequeños se deben eliminar con un suave mezclado manual. Tecartus no se debe lavar, centrifugar y/o volver a suspender en un medio nuevo antes de la perfusión. La descongelación tardará entre 3 y 5 minutos, aproximadamente.
- Una vez descongelado, Tecartus es estable a temperatura ambiente (entre 20 °C-25 °C) hasta 3 horas. Sin embargo, se debe comenzar la perfusión en los 30 minutos siguientes a la descongelación total.
NO use un filtro de leucodepleción.
Administración
- Este medicamento se debe administrar en un centro médico cualificado por uno o varios médicos con experiencia en el tratamiento de neoplasias malignas hematológicas y que haya recibido formación sobre la administración y el tratamiento de pacientes tratados con Tecartus.
- Asegúrese de que al menos 1 dosis de tocilizumab por paciente y un equipo para emergencias estén disponibles antes de la perfusión y durante el periodo de recuperación. Los hospitales y centros asociados deben tener acceso a una dosis adicional de tocilizumab en un plazo de 8 horas después de cada dosis previa.
- Compruebe que la identidad del paciente coincida con los identificadores de paciente de la bolsa para perfusión.
- Tecartus está destinado solo para uso autólogo.
- Tecartus se debe administrar como una perfusión intravenosa utilizando vías intravenosas sin látex y sin un filtro de leucodepleción en un periodo de 30 minutos, ya sea por gravedad o mediante una bomba peristáltica.
- Durante la perfusión agite suavemente la bolsa para prevenir la formación de agregados celulares. Se debe administrar todo el contenido de la bolsa para perfusión.
- Antes de la perfusión se debe utilizar una solución estéril de cloruro de sodio 9 mg/ml (0,9 %) (0,154 mmol de sodio por ml) para inyección para cebar las vías, así como para aclararlas tras la perfusión. Una vez que se haya perfundido el volumen total de Tecartus, se debe aclarar la bolsa para perfusión con entre 10 y 30 ml de una solución de cloruro de sodio 9 mg/ml (0,9 %) para inyección mediante cebado inverso con el fin de garantizar la perfusión del mayor número de células posible al paciente.
Eliminación de Tecartus
- Todos los medicamentos no utilizados o los residuos que han estado en contacto con Tecartus (residuos sólidos y líquidos) se deben tratar y eliminar según las guías locales para el tratamiento de residuos de material de origen humano. Se deben descontaminar con un desinfectante adecuado las superficies de trabajo y los materiales que hayan podido estar en contacto con Tecartus.
Exposición accidental
- Se debe evitar la exposición accidental a Tecartus. En caso de exposición accidental se seguirán las guías locales para el tratamiento de material de origen humano, que pueden incluir el lavado de la piel contaminada y quitarse la ropa contaminada.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a TECARTUS 0,4 - 2 x 10e8 CELULAS DISPERSION PARA PERFUSIONForma farmacéutica: INYECTABLE PERFUSION, 260 - 500 × 10e6 célulasPrincipio activo: Idecabtagen vicleucelFabricante: Bristol-Myers Squibb Pharma EeigRequiere recetaForma farmacéutica: INYECTABLE PERFUSION, 1,1-70x10e6/1,1-70x10e6 celulas/mlPrincipio activo: lisocabtagene maraleucelFabricante: Bristol-Myers Squibb Pharma EeigRequiere recetaForma farmacéutica: INYECTABLE PERFUSION, 3,2 x 10e6 - 1 x 10e8 celulasPrincipio activo: Ciltacabtagen autoleucelFabricante: Janssen-Cilag International N.VRequiere receta
Médicos online para TECARTUS 0,4 - 2 x 10e8 CELULAS DISPERSION PARA PERFUSION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de TECARTUS 0,4 - 2 x 10e8 CELULAS DISPERSION PARA PERFUSION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes






