
PRISMASOL 2 mmol/l POTASIO, SOLUCION PARA HEMODIALISIS Y HEMOFILTRACION


Cómo usar PRISMASOL 2 mmol/l POTASIO, SOLUCION PARA HEMODIALISIS Y HEMOFILTRACION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Prismasol 2 mmol/lPotasio solución para hemodiálisis y hemofiltración.
Cloruro de calcio, dihidrato / Cloruro de magnesio hexahidrato / Glucosa monohidrato / solución de ácido láctico 90%/ Cloruro de sodio/ Cloruro de potasio / Hidrogenocarbonato de sodio
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si sufre efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es Prismasol y para qué se utiliza.
- Qué necesita saber antes de empezar a usar Prismasol.
- Cómo usar Prismasol
- Posibles efectos adversos
- Conservación de Prismasol
- Contenido del envase e información adicional
1. Qué es Prismasol y para qué se utiliza
Primasol contiene los siguientes principios activos: cloruro de calcio, dihidrato; cloruro de magnesio, hexahidrato; glucosa monohidrato, solución de ácido láctico al 90%; cloruro de sodio; cloruro de potasio e hidrogenocarbonato de sodio.
Prismasol se utiliza en el tratamiento de la insuficiencia renal como una solución para hemofiltración o hemodiafiltración continua (como sustitución de la pérdida del líquido producido por el paso de la sangre a través del filtro) y hemodiálisis continua o hemodiafiltración (la sangre pasa por un lado de la membrana de diálisis mientras la solución de hemodiálisis pasa por el otro lado de la misma).
Prismasol también puede utilizarse en caso de intoxicación con sustancias dializables o filtrables.
Prismasol 2 mmol/l potasio está especialmente indicada en pacientes con tendencia a la hiperpotasemia (nivel alto de potasio en la sangre)
2. Qué necesita saber antes de empezar a administrar Prismasol
No usar Prismasol 2 mmol/l potasio en caso de:
- alergia a alguno de los principios activos o a alguno de los demás componentes (incluidos en la sección 6),
- bajo nivel de potasio en sangre (hipopotasemia),
- alta concentración de bicarbonato en sangre (alcalosis metabólica).
No se puede excluir la presencia de antígeno derivado de maíz en Prismasol.
No usar hemofiltración o tratamiento de diálisis en caso de:
- Insuficiencia renal con hipercatabolismo pronunciado (catabolismo anormalmente incrementado), si los síntomas urémicos (síntomas causados por una alta concentración de urea en sangre) no pueden corregirse con hemofiltración.
- Presión arterial insuficiente en el acceso vascular.
- Anticoagulación sistémica (coagulación reducida de su sangre) si hay un alto riesgo de hemorragia ( sangrado)
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Prismasol
La solución sólo puede utilizarse por o bajo la supervisión de un médico competente en tratamientos de insuficiencia renal usando técnicas de hemofiltración, hemodiafiltración y hemodiálisis continua.
Antes y durante el tratamiento se le controlará el estado de la sangre, por ejemplo , se hará un seguimiento del equilibrio ácido-base y de las concentraciones de electrolitos (sales en la sangre), así como de todos los líquidos que se le administren (perfusión intravenosa) y que produzca (diuresis), incluso de aquellos líquidos no directamente relacionados con el tratamiento.
Se debe controlar estrechamente la concentración de glucosa en sangre, especialmente si usted es diabético.
Otros medicamentos y Prismasol
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o si pudiera haber tomado otros medicamentos
La concentración en sangre de algunos de los otros medicamentos puede reducirse durante el tratamiento. Su médico decidirá si se debe cambiar su medicación.
En particular informe a su médico en los casos siguientes:
- Medicamentos digitálicos (para el tratamiento de algunas insuficiencias cardíacas) ya que el riesgo de arritmias cardíacas (latidos del corazón irregulares o rápidos) inducidas por estos medicamentos aumenta durante la hipopotasemia (baja concentración de potasio en la sangre).
- Vitamina D y medicamentos que contengan calcio, ya que pueden aumentar el riesgo de hipercalcemia (una elevada concentración de calcio en sangre).
- Cualquier suplemento de hidrogenocarbonato de sodio (u otra fuente tamponada), ya que puede aumentar el riesgo de alcalosis metabólica (exceso de bicarbonato en la sangre).
- Cuando el citrato se usa como anticoagulante (como protector en equipos de diálisis), puede reducir los niveles de calcio en plasma.
Embarazo y Lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Si usted está embarazada o en periodo de lactancia, su médico decidirá si se le debe administrar Prismasol.
Conducción y uso de máquinas
No se tienen datos de que Prismasol afecte a la capacidad para conducir o utilizar máquinas.
3. Cómo usar Prismasol
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su a su médico o farmacéutico.
El volumen de Prismasol a administrar dependerá de sus condiciones clínicas y del equilibrio de líquidos deseado. Por tanto, el volumen de la dosis dependerá del criterio de su médico.
Vía de administración: vía intravenosa y hemodiálisis.
Si cree que usa más Prismasol del que debiera:
Su equilibrio de líquidos, de ácido – base y electrolítico debe ser cuidadosamente controlado
En el caso improbable de que se produzca una sobredosis, su médico tomará las medidas correctivas necesarias para ajustar la dosis.
Una sobredosis puede causar:
- sobrecarga de líquidos en sangre,
- aumento del nivel de bicarbonato en sangre (alcalosis metabólica),
- y/o reducción de los niveles de sales en sangre (hipofosfatemia, hipopotasemia).
La sobredosis podría conducirle a consecuencias graves tales como insuficiencia cardiaca congestiva, desequilibrio electrolítico o de ácido- base.
Para instrucciones de uso, consulte la sección “Esta información está destinada únicamente a profesionales del sector sanitario”.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos aunque no todas las personas los sufran.
Se han notificado los siguientes efectos adversos:
No conocida: la frecuencia no puede estimarse a partir de los datos disponibles
- Cambios en los niveles de sales en sangre (desequilibrios electrolíticos como hipofosfatemia o hipopotasemia)
- Elevación de la concentración de bicarbonato en plasma (alcalosis metabólica) o reducción de la concentración de bicarbonato en plasma (acidosis metabólica)
- Volumen de agua en el organismo anormalmente elevado o reducido (hiper o hipovolemia)
- Concentración de glucosa anormalmente alta en la sangre (hiperglucemia)
- Náuseas
- Vómitos
- Calambres musculares
- Hipotensión (presión sanguínea baja)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto.
También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de de Prismasol
Mantener este medicamento fuera de la vista y del alcance de los niños.
No conservar a temperatura inferior a + 4º C.
No utilice este medicamento después de la fecha de caducidad indicada en la etiqueta y el embalaje después de CAD. La fecha de caducidad es el último día del mes que se indica.
Se ha demostrado la estabilidad química y física de la solución reconstituida durante 24 horas a una temperatura de +22 °C. De no utilizar la solución inmediatamente, el tiempo de conservación en uso y las condiciones antes del uso son responsabilidad del usuario y no deben superar las 24 horas incluyendo la duración del tratamiento.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
(FORMATOPVC CON VÁLVULA)
Qué contiene PRISMASOL
Los principios activos son:
Antes de la reconstitución:
1000 ml de Solución de electrolitos (Compartimento A pequeño) contiene:
Cloruro de calcio dihidrato 5,145 g
Cloruro de magnesio hexahidrato 2,033 g
Glucosa 22,000 g
Ácido (S)-Láctico 5,400 g
1000 ml. de solución tampón (Compartimento B grande) contiene:
Cloruro de sodio 6,450 g
Hidrogenocarbonato de sodio 3,090 g
Cloruro de potasio 0,157 g
Después de la reconstitución:
La solución del compartimento A (250 ml) y del compartimento B (4750 ml) se mezcla para originar una solución reconstituida (5000 ml) cuya composición es la siguiente:
mmol/l | mEq/l | |
Calcio Ca2+ | 1,75 | 3,50 |
Magnesio Mg2+ | 0,50 | 1,00 |
Sodio Na+ | 140,00 | 140,00 |
Cloruro Cl- | 111,50 | 111,50 |
Lactato | 3,00 | 3,00 |
Hidrogenocarbonato HCO3- | 32,00 | 32,00 |
Potasio K+ | 2,00 | 2,00 |
Glucosa | 6,10 | |
Osmolaridad teórica: | 297 mOsm/l |
Los demás componentes son:dióxido de carbono (E-290), agua para preparaciones inyectables.
pH de la solución reconstituida: 7.0 – 8.5
Aspecto del productoy contenido del envase
Prismasol se presenta en una bolsa bicompartimental, conteniendo el compartimento pequeño A la solución de electrolitos y el compartimento grande B la solución tampón. La solución final reconstituida se obtiene después de romper el vástago rompible y mezclar ambas soluciones. La solución reconstituida es transparente y ligeramente amarilla. Cada bolsa (A+B) contiene 5000 ml de solución para hemodiálisis y hemofiltración. La bolsa está recubierta por una sobrebolsa transparente.
Cada caja contiene dos bolsas y un prospecto.
Titular de la autorización de comercialización:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.
Via Stelvio 94
23035 Sondalo (SO)
Italia
Ó
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Alemania, Austria, Bélgica, Bulgaria, Chipre, República Checa, Dinamarca, Eslovaquia, Eslovenia, Estonia, España, Finlandia, Francia, Grecia, Holanda, Hungría, Islandia, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Noruega, Polonia, Portugal, Rumania, Suecia, Reino Unido (Irlanda del Norte): Prismasol 2
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Vantive Health, S.L.
Polígono industrial sector 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valencia
España
Fecha de la última revisión de este prospecto: 03/2018
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española de medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.es
--------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario
Prismasol 2 mmol/lPotasio solución para hemodiálisis y hemofiltración
Precauciones
Deben seguirse con exactitud las instrucciones de uso y manipulación de Prismasol.
Las soluciones de los dos compartimentos deben mezclarse antes de usarse.
El uso de soluciones de hemofiltración y hemodiálisis contaminadas puede causar sepsis, shock y condiciones que pueden causar la muerte.
Prismasol puede calentarse a 37 ºC para mejorar el bienestar del paciente. El calentamiento de la solución antes de su uso debe realizarse antes de su reconstitución solo con calor seco. Las soluciones no deben calentarse en agua ni en el microondas. La solución debe inspeccionarse visualmente antes de la administración para detectar la presencia de partículas y un posible cambio de color, cuando la solución y el envase lo permitan. No administrar si la solución no es transparente o si el precinto no está intacto.
Prismasol es una solución que contiene potasio. Antes y durante la hemofiltración y/o la hemodiálisis, debe hacerse un seguimiento de la concentración sanguínea de potasio. En función de la concentración de potasio en sangre antes del tratamiento, puede desarrollarse hipo o hiperpotasemia.
Si se produce hipopotasemia, puede ser necesaria la adición de potasio y/o la administración de un dializado con una mayor concentración de potasio.
Si se produce hiperpotasemia una vez iniciado el tratamiento, deberá valorarse la adición de fuentes de potasio que afecten a las concentraciones. Cuando la solución se utiliza como solución de sustitución, se debe disminuir la velocidad de perfusión y confirmar que se ha alcanzado la concentración de potasio deseada. Si no se resuelve la hiperpotasemia, detener la perfusión de inmediato.
Si la hiperpotasemia se desarrolla cuando se utiliza la solución como dializado, puede ser necesario administrar un dializado sin potasio para aumentar la eliminación del potasio.
La concentración de fosfatos inorgánicos debe ser medida con regularidad. En el caso de que los niveles de fosfato inorgánico en sangre, sean bajos, éste debe ser restablecido. Puede añadirse a la solución una concentración de fosfatos de hasta 1,2 mmol/l. Si se añade fosfato potásico, la concentración total de potasio no debería superar los 4 mEq/l (4 mmol/l).
Aunque no se han notificado casos de reacción de hipersensibilidad graves al maíz con Prismasol, las soluciones que contienen glucosa procedente de almidón de maíz hidrolizado no deberían utilizarse en pacientes con alergia conocida al maíz o a los productos derivados del maíz.
Si se desarrollan signos o síntomas de una sospecha de una reacción de hipersensibilidad, la administración debe interrumpirse de inmediato. Deben instaurarse las medidas terapéuticas compensatorias apropiadas que estén clínicamente indicadas.
Debido al contenido de glucosa y lactato de la solución, puede dar lugar a hiperglucemia especialmente en pacientes diabéticos. Los niveles de glucosa en sangre deben ser monitorizados de forma regular. En caso de desarrollar hiperglucemia, puede ser necesario administrar una solución de sustitución o dializado libre de dextrosa. Para mantener el control glucémico deseado, pueden ser necesarias otras medidas correctivas.
Prismasol contiene hidrogenocarbonato de sodio (bicarbonato) y lactato (precursor del bicarbonato) que puede influir en el equilibro de ácido-base. Si la alcalosis metabólica se desarrolla o empeora durante el tratamiento con la solución, puede que sea necesario reducir la velocidad de administración o detener la administración.
Antes y durante el tratamiento, debe hacerse un seguimiento estrecho del equilibrio electrolítico y de ácido-base durante todo el procedimiento.
En caso de desequilibrio de líquidos, la situación clínica debe ser controlada cuidadosamente y el equilibrio de líquidos debería corregirse según sea necesario.
Método de administración
Vía intravenosa y para hemodiálisis. Prismasol cuando se usa como solución de sustitución se administra dentro del circuito antes del hemofiltro (pre-dilución) o después del hemofiltro (post-dilución)
Posología
El volumen y la velocidad de uso de Prismasol dependerán de la concentración de electrolitos en sangre, del equilibrio ácido-base y del estado clínico general del paciente. La pauta de administración (dosis, velocidad de perfusión y volumen acumulativo) de Prismasol debería establecerla un médico.
Las velocidades de flujo utilizadas para la solución de sustitución en hemofiltración y hemodiafiltración son:
Adultos: 500 – 3000 ml/hora
Las velocidades de flujo utilizadas para la solución de diálisis (dializado) en hemodiálisis continua y hemodiafiltración continua son:
Adultos: 500 - 2500 ml/hora
Normalmente las velocidades de flujo utilizadas en adultos sonde aproximadamente 2000 a 2500 ml/h, lo que corresponde aun volumen de líquido diario de entre 48 y 60 litros aproximadamente .
Población pediátrica
Los intervalos de velocidades de flujo de la solución de sustitución en hemofiltración y hemodiafiltración y de la solución de diálisis (dializado) en hemodiálisis continua son:
Niños (de neonatos a adolescentes de hasta 18 años de edad): de 1000 a 2000 ml/h/1,73 m2.
Pueden ser necesarias velocidades de flujo de hasta 4000 ml/h/1,73 m2, especialmente en niños pequeños (≤10 kg). La velocidad de flujo absoluta (en ml/h) de la población pediátrica no debería superar por lo general la velocidad de flujo máxima de los adultos.
Instrucciones de manipulación
La solución de electrolitos (compartimento pequeño A) se añade a la solución tampón (compartimento grande B) después de romper el vástago rompible justo antes de usar para obtener la solución reconstituida.
Utilizar únicamente con equipos de sustitución renal extracorpórea adecuados.
Se deberá seguir una técnica aséptica durante todo el proceso de manipulación y administración al paciente.
Usar solo si la sobrebolsa está intacta, todos los sellos están intactos, el vástago rompible no está roto y la solución es transparente. Apriete la bolsa con firmeza para asegurarse de que no haya fugas. Si se observan fugas, desechar inmediatamente la solución ya que la esterilidad no puede ser garantizada.
El compartimiento grande (B), está equipado con un puerto de inyección para añadir otros fármacos que sean necesarios una vez reconstituida la solución. Es responsabilidad del médico juzgar la compatibilidad de un medicamento añadido a Prismasol comprobando el cambio eventual de color y/o precipitación eventual, complejos insolubles o cristales. Antes de añadir un medicamento, verificar si es soluble y estable en agua al pH de Prismasol (el pH de la solución reconstituida está comprendido entre 7,0 y 8,5). Los aditivos podrían no ser compatibles. Deben consultarse las Instrucciones de uso de la medicación añadida.
Eliminar cualquier líquido del puerto de inyección, poner la bolsa en posición invertida, añadir el medicamento a través del puerto de inyección y mezclar perfectamente. La solución debe administrarse inmediatamente.La introducción y el mezclado de los aditivos siempre debe realizarse antes de conectar la bolsa de la solución al circuito extracorpóreo.
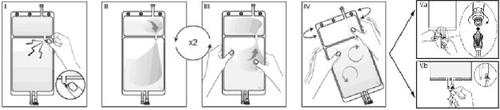
IRetirar la sobrebolsa de la bolsa inmediatamente antes de usar y desechar cualquier otro material de envasado. Abrir el precinto rompiendo el vástago rompible situado entre los dos compartimentos de la bolsa. El vástago se quedará dentro de la bolsa. (Véase figura I de abajo).
IIAsegurarse de que todo el líquido del compartimento pequeño A se pasa al compartimento grande B. (Véase figura II de abajo).
IIIAclarar dos vecesel compartimento pequeño A forzando a la solución mezclada a volver a este compartimento y luego otra vez al compartimento grande B (Véase figura III de abajo).
IVUna vez vaciado el compartimento pequeño A, agitar el compartimento grande B para que se mezcle completamente su contenido. La solución ya está preparada para usar y puede ser colgada en el equipo. (Véase figura IV de abajo).
VLa línea de diálisis o de sustitución puede ser conectada a cualquiera de los dos puertos de acceso.
V.aSi se utiliza el conector luer, quite el tapón mediante un movimiento de giro y extracción y conecte el conector luer macho de la línea de diálisis o sustitución en el receptor luer hembra de la bolsa mediante un movimiento de presión y giro. Asegúrese de que la conexión está bien hecha y apretada. La conexión se abrirá. Compruebe que el líquido circula libremente. (Véase figura Va de abajo).
Si la línea de diálisis o sustitución se desconecta del conector luer, el conector se cerrará y el flujo de la solución se detendrá. El puerto luer es un puerto sin aguja que se puede limpiar.
V.bSi se usa el acceso de inyección, retire primero la cápsula. El puerto de inyección es un puerto que se puede desinfectar con torunda. Introduzca el espigón a través de la pared de goma. Verificar que la solución circula libremente. (Véase figura Vb de abajo).
La solución debería usarse inmediatamente después de retirar la sobrebolsa. De no hacerse así, la solución reconstituida debería usarse en un plazo de 24 horas, incluyendo la duración del tratamiento tras la adición de la solución de electrolitos a la solución tampón.
La solución reconstituida es para usar una sola vez. Desechar inmediatamente cualquier resto de solución no utilizada.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
(FORMATO PVC CON VÁSTAGO ROMPIBLE)
Qué contiene PRISMASOL
Los principios activos son:
Antes de la reconstitución:
1000 ml de Solución de electrolitos (Compartimento A pequeño) contiene:
Cloruro de calcio dihidrato 5,145 g
Cloruro de magnesio hexahidrato 2,033 g
Glucosa 22,000 g
Ácido (S)-Láctico 5,400 g
1000 ml. de solución tampón (Compartimento B grande) contiene:
Cloruro de sodio 6,450 g
Hidrogenocarbonato de sodio 3,090 g
Cloruro de potasio 0,157 g
Después de la reconstitución:
La solución del compartimento A (250 ml) y del compartimento B (4750 ml) se mezcla para originar una solución reconstituida (5000 ml) cuya composición es la siguiente:
mmol/l | mEq/l | |
Calcio Ca2+ | 1,75 | 3,50 |
Magnesio Mg2+ | 0,50 | 1,00 |
Sodio Na+ | 140,00 | 140,00 |
Cloruro Cl- | 111,50 | 111,50 |
Lactato | 3,00 | 3,00 |
Hidrogenocarbonato HCO3- | 32,00 | 32,00 |
Potasio K+ | 2,00 | 2,00 |
Glucosa | 6,10 | |
Osmolaridad teórica: | 297 mOsm/l |
Los demás componentes son:dióxido de carbono (E-290), agua para preparaciones inyectables.
pH de la solución reconstituida: 7,0 – 8,5
Aspecto del productoy contenido del envase
Prismasol se presenta en una bolsa bicompartimental, conteniendo el compartimento pequeño A la solución de electrolitos y el compartimento grande B la solución tampón. La solución final reconstituida se obtiene después de romper el vástago rompible y mezclar ambas soluciones. La solución reconstituida es transparente y ligeramente amarilla. Cada bolsa (A+B) contiene 5000 ml de solución para hemodiálisis y hemofiltración. La bolsa está recubierta por una sobrebolsa transparente.
Cada caja contiene dos bolsas y un prospecto.
Titular de la autorización de comercialización:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.
Via Stelvio 94
23035 Sondalo (SO)
Italia
Ó
Vantive Manufacturing Limited
Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Alemania, Austria, Bélgica, Bulgaria, Chipre, República Checa, Dinamarca, Eslovaquia, Eslovenia, Estonia, España, Finlandia, Francia, Grecia, Holanda, Hungría, Islandia, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Noruega, Polonia, Portugal, Rumania, Suecia, Reino Unido (Irlanda del Norte): Prismasol 2
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Vantive Health, S.L.
Polígono industrial sector 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valencia
España
Fecha de la última revisión de este prospecto: 03/2018
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española de medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.es
--------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario
Prismasol 2 mmol/lPotasio solución para hemodiálisis y hemofiltración
Precauciones
Deben seguirse con exactitud las instrucciones de uso y manipulación de Prismasol.
Las soluciones de los dos compartimentos deben mezclarse antes de usarse.
El uso de soluciones de hemofiltración y hemodiálisis contaminadas puede causar sepsis, shock y condiciones que pueden causar la muerte.
Prismasol puede calentarse a 37 ºC para mejorar el bienestar del paciente. El calentamiento de la solución antes de su uso debe realizarse antes de su reconstitución solo con calor seco. Las soluciones no deben calentarse en agua ni en el microondas. La solución debe inspeccionarse visualmente antes de la administración para detectar la presencia de partículas y un posible cambio de color, cuando la solución y el envase lo permitan. No administrar si la solución no es transparente o si el precinto no está intacto.
Prismasol es una solución que contiene potasio. Antes y durante la hemofiltración y la hemodiálisis, debe hacerse un seguimiento de la concentración sanguínea de potasio. En función de la concentración de potasio en sangre antes del tratamiento, puede desarrollarse hipo o hiperpotasemia.
Si se produce hipopotasemia, puede ser necesaria la adición de potasio y/o la administración de un dializado con una mayor concentración de potasio.
Si se produce hiperpotasemia una vez iniciado el tratamiento, deberá valorarse la adición de fuentes de potasio que afecten a las concentraciones. Cuando la solución se utiliza como solución de sustitución, se debe disminuir la velocidad de perfusión y confirmar que se ha alcanzado la concentración de potasio deseada. Si no se resuelve la hiperpotasemia, detener la perfusión de inmediato.
Si la hiperpotasemia se desarrolla cuando se utiliza la solución como dializado, puede ser necesario administrar un dializado sin potasio para aumentar la eliminación del potasio.
La concentración de fosfatos inorgánicos debe ser medida con regularidad. En el caso de que los niveles de fosfato inorgánico en sangre, sean bajos, éste debe ser restablecido. Puede añadirse a la solución una concentración de fosfatos de hasta 1,2 mmol/l. Si se añade fosfato potásico, la concentración total de potasio no debería superar los 4 mEq/l (4 mmol/l).
Aunque no se han notificado casos de reacción de hipersensibilidad graves al maíz con Prismasol, las soluciones que contienen glucosa procedente de almidón de maíz hidrolizado no deberían utilizarse en pacientes con alergia conocida al maíz o a los productos derivados del maíz.
Si se desarrollan signos o síntomas de sospecha de una reacción de hipersensibilidad, la administración debe interrumpirse de inmediato. Deben instaurarse las medidas terapéuticas compensatorias apropiadas que estén clínicamente indicadas.
Debido al contenido de glucosa y lactato de la solución, puede dar lugar a hiperglucemia especialmente en pacientes diabéticos. Los niveles de glucosa en sangre deben ser monitorizados de forma regular. En caso de desarrollar hiperglucemia, puede ser necesario administrar una solución de sustitución o dializado libre de dextrosa. Para mantener el control glucémico deseado, pueden ser necesarias otras medidas correctivas.
Prismasol contiene hidrogenocarbonato de sodio (bicarbonato) y lactato (precursor del bicarbonato) que puede influir en el equilibro de ácido-base. Si la alcalosis metabólica se desarrolla o empeora durante el tratamiento con la solución, puede que sea necesario reducir la velocidad de administración o detener la administración.
Antes y durante el tratamiento, debe hacerse un seguimiento estrecho del equilibrio electrolítico y y ácido-base durante todo el procedimiento.
En caso de desequilibrio de líquidos, la situación clínica debe ser controlada cuidadosamente y el equilibrio de líquidos debería corregirse según sea necesario.
Método de administración
Vía intravenosa y para hemodiálisis. Prismasol cuando se usa como solución de sustitución se administra dentro del circuito antes del hemofiltro (pre-dilución) o después del hemofiltro (post-dilución)
Posología
El volumen y la velocidad de uso de Prismasol dependerán de la concentración de electrolitos en sangre, del equilibrio ácido-base y del estado clínico general del paciente. La pauta de administración (dosis, velocidad de perfusión y volumen acumulativo) de Prismasol debería establecerla un médico.
Las velocidades de flujo utilizadas para la solución de sustitución en hemofiltración y hemodiafiltración son:
Adultos: 500 - 3000 ml/h
Las velocidades de flujo utilizadas para la solución de diálisis (dializado) en hemodiálisis continua y hemodiafiltración continua son:
Adultos : 500 - 2500 ml/h
Normalmente las tasas de flujo utilizadas en adultos son de aproximadamente 2000 a 2500 ml/h, lo que corresponde a un volumen de líquido diario de entre 48 y 60 litros aproximadamente.
Población pediátrica
Los intervalos de tasas de flujo de la solución de sustitución en hemofiltración y hemodiafiltración y de la solución de diálisis (dializado) en hemodiálisis continua son:
Niños (de neonatos a adolescentes de hasta 18 años de edad): de 1000 a 2000 ml/h/1,73 m2.
Pueden ser necesarias velocidades de flujo de hasta 4000 ml/h/1,73 m2, especialmente en niños pequeños (≤10 kg). La velocidad de flujo absoluta (en ml/h) de la población pediátrica no debería superar por lo general la velocidad de flujo máxima de los adultos.
Instrucciones de manipulación
La solución de electrolitos (compartimento pequeño A) se añade a la solución tampón (compartimento grande B) después de romper el vástago rompible justo antes de usar para obtener la solución reconstituida.
Utilizar únicamente con equipos de sustitución renal extracorpórea adecuados.
Se deberá seguir una técnica aséptica durante todo el proceso de manipulación y administración al paciente.
Usar solo si la sobrebolsa está intacta, todos los sellos están intactos, el vástago rompible no está roto y la solución es transparente. Apriete la bolsa con firmeza para asegurarse de que no haya fugas.Si se observan fugas, desechar inmediatamente la solución ya que la esterilidad no puede ser garantizada.
El compartimiento grande (B), está equipado con un puerto de inyección para añadir otros fármacos que sean necesarios una vez reconstituida la solución. Es responsabilidad del médico juzgar la compatibilidad de un medicamento añadido a Prismasol, comprobando el cambio eventual de color y/o precipitación eventual, complejos insolubles o cristales. Antes de añadir un medicamento, verificar si es soluble y estable en agua al pH de Prismasol (el pH de la solución reconstituida está comprendido entre 7,0 y 8,5). Los aditivos podrían no ser compatibles. Deben consultarse las Instrucciones de uso de la medicación añadida.
Eliminar cualquier líquido del puerto de inyección, poner la bolsa en posición invertida, añadir el medicamento a través del puerto de inyección y mezclar perfectamente. La solución debe administrarse inmediatamente. La introducción y el mezclado de los aditivos siempre debe realizarse antes de conectar la bolsa de la solución al circuito extracorpóreo.
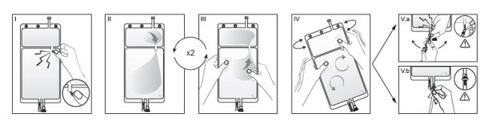
IRetirar la sobrebolsa de la bolsa inmediatamente antes de usar y desechar cualquier otro material de envasado. Abrir el precinto rompiendo el vástago rompible situado entre los dos compartimentos de la bolsa. El vástago se quedará dentro de la bolsa. (Véase figura I de abajo).
IIAsegurarse de que todo el líquido del compartimento pequeño A se pasa al compartimento grande B. (Véase figura II de abajo).
IIIAclarar dos vecesel compartimento pequeño A forzando a la solución mezclada a volver a este compartimento y luego otra vez al compartimento grande B (Véase figura III de abajo).
IVUna vez vaciado el compartimento pequeño A, agitar el compartimento grande B para que se mezcle completamente su contenido. La solución ya está preparada para usar y puede ser colgada en el equipo. (Véase figura IV de abajo).
VLa línea de diálisis o sustitución puede ser conectada a cualquiera de los dos puertos de acceso.
V.aSi se usa el acceso luer, retire el tapón y conecte el conector luer lock macho en la línea de diálisis o sustitución al receptor luer hembra de la bolsa: hágalo fuertemente. Usando el pulgar y el resto de los dedos, rompa el vástago azul rompible por su base y muévalo hacia delante y hacia atrás. No use herramientas. Verificar que el vástago está completamente separado y que la solución circula libremente. El vástago permanecerá en el acceso luer durante el tratamiento. (Véase figura Va de abajo).
V.bSi se usa el acceso de inyección, retire primero la cápsula. El puerto de inyección es un puerto que se puede desinfectar con torunda. Introduzca el espigón a través de la pared de goma. Verificar que la solución circula libremente. (Véase figura Vb de abajo).
La solución debería usarse inmediatamente después de retirar la sobrebolsa. De no hacerse así, la solución reconstituida debería usarse en un plazo de 24 horas, incluyendo la duración del tratamiento tras la adición de la solución de electrolitos a la solución tampón.
La solución reconstituida es para usar una sola vez. Desechar inmediatamente cualquier resto de solución no utilizada.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
(FORMATO POLIOLEFINA CON VÁLVULA)
Qué contiene PRISMASOL
Los principios activos son:
Antes de la reconstitución:
1000 ml de Solución de electrolitos (Compartimento A pequeño) contiene:
Cloruro de calcio dihidrato 5,145 g
Cloruro de magnesio hexahidrato 2,033 g
Glucosa 22,000 g
Ácido (S)-Láctico 5,400 g
1000 ml. de solución tampón (Compartimento B grande) contiene:
Cloruro de sodio 6,450 g
Hidrogenocarbonato de sodio 3,090 g
Cloruro de potasio 0,157 g
Después de la reconstitución:
La solución del compartimento A (250 ml) y del compartimento B (4750 ml) se mezclan para originar una solución reconstituida (5000 ml) cuya composición es la siguiente:
mmol/l | mEq/l | |
Calcio Ca2+ | 1,75 | 3,50 |
Magnesio Mg2+ | 0,50 | 1,00 |
Sodio Na+ | 140,00 | 140,00 |
Cloruro Cl- | 111,50 | 111,50 |
Lactato | 3,00 | 3,00 |
Hidrogenocarbonato HCO3- | 32,00 | 32,00 |
Potasio K+ | 2,00 | 2,00 |
Glucosa | 6,10 | |
Osmolaridad teórica: | 297 mOsm/l |
Los demás componentes son:dióxido de carbono (E-290), agua para preparaciones inyectables.
pH de la solución reconstituida: 7,0 – 8,5
Aspecto del productoy contenido del envase
Prismasol se presenta en una bolsa bicompartimental, conteniendo el compartimento pequeño A la solución de electrolitos y el compartimento grande B la solución tampón. La solución final reconstituida se obtiene después de romper la pared sellada y mezclar ambas soluciones. La solución reconstituida es transparente y ligeramente amarilla. Cada bolsa (A+B) contiene 5000 ml de solución para hemodiálisis y hemofiltración. La bolsa está recubierta por una sobrebolsa transparente.
Cada caja contiene dos bolsas y un prospecto.
Titular de la autorización de comercialización:
Vantive Belgium SRL
Boulevard d´Angleterre 2
1420 Braine-l´Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.
Via Stelvio 94
23035 Sondalo (SO)
Italia
Ó
Vantive Manufacturing Limited Moneen Road,
Castlebar
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Alemania, Austria, Bélgica, Bulgaria, Chipre, República Checa, Dinamarca, Eslovaquia, Eslovenia, Estonia, España, Finlandia, Francia, Grecia, Holanda, Hungría, Islandia, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Noruega, Polonia, Portugal, Rumania, Suecia, Reino Unido (Irlanda del Norte): Prismasol 2
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Vantive Health, S.L.
Polígono industrial sector 14
C/ Pouet de Camilo nº2
46394 Ribarroja del Turia
Valencia
España
Fecha de la última revisión de este prospecto: 03/2018
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española de medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.es
-----------------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario
Prismasol 2 mmol/lPotasio solución para hemodiálisis y hemofiltración
Precauciones
Deben seguirse con exactitud las instrucciones de uso y manipulación de Prismasol.
Las soluciones de los dos compartimentos deben mezclarse antes de usarse.
El uso de soluciones de hemofiltración y hemodiálisis contaminadas puede causar sepsis, shock y condiciones que pueden causar la muerte.
Prismasol puede calentarse a 37 ºC para mejorar el bienestar del paciente. El calentamiento de la solución antes de su uso debe realizarse antes de su reconstitución solo con calor seco. Las soluciones no deben calentarse en agua ni en el microondas. La solución debe inspeccionarse visualmente antes de la administración para detectar la presencia de partículas y un posible cambio de color, cuando la solución y el envase lo permitan. No administrar si la solución no es transparente o si el precinto no está intacto.
Prismasol es una solución que contiene potasio. Antes y durante la hemofiltración y/o la hemodiálisis, debe hacerse un seguimiento de la concentración sanguínea de potasio. En función de la concentración de potasio en sangre antes del tratamiento, puede desarrollarse hipo o hiperpotasemia.
Si se produce hipopotasemia, puede ser necesaria la adición de potasio y/o la administración de un dializado con una mayor concentración de potasio.
Si se produce hiperpotasemia una vez iniciado el tratamiento, deberá valorarse la adición de fuentes de potasio que afecten a las concentraciones de potasio. Cuando la solución se utiliza como solución de sustitución, se debe disminuir la velocidad de perfusión y confirmar que se ha alcanzado la concentración de potasio deseada. Si no se resuelve la hiperpotasemia, detener la perfusión de inmediato.
Si la hiperpotasemia se desarrolla cuando se utiliza la solución como dializado, puede ser necesario administrar un dializado sin potasio para aumentar la eliminación del potasio.
La concentración de fosfatos inorgánicos debe ser medida con regularidad. En el caso de que los niveles de fosfato inorgánico en sangre, sean bajos, éste debe ser restablecido. Puede añadirse a la solución una concentración de fosfatos de hasta 1,2 mmol/l. Si se añade fosfato potásico, la concentración total de potasio no debería superar los 4 mEq/l (4 mmol/l).
Aunque no se han notificado casos de reacción de hipersensibilidad grave al maíz con Prismasol, las soluciones que contienen glucosa procedente de almidón de maíz hidrolizado no deberían utilizarse en pacientes con alergia conocida al maíz o a los productos derivados del maíz.
Si se desarrollan signos o síntomas de sospecha de una reacción de hipersensibilidad, la administración debe interrumpirse de inmediato. Deben instaurarse las medidas terapéuticas compensatorias apropiadas que estén clínicamente indicadas.
Debido al contenido de glucosa y lactato de la solución, puede dar lugar a hiperglucemia especialmente en pacientes diabéticos. Los niveles de glucosa en sangre deben ser monitorizados de forma regular. En caso de desarrollar hiperglucemia, puede ser necesario administrar una solución de sustitución o dializado libre de dextrosa. Para mantener el control glucémico deseado, pueden ser necesarias otras medidas correctivas.
Prismasol contiene hidrogenocarbonato de sodio (bicarbonato) y lactato (precursor del bicarbonato) que puede influir en el equilibro de ácido-base. Si la alcalosis metabólica se desarrolla o empeora durante el tratamiento con la solución, puede que sea necesario reducir la velocidad de administración o detener la administración.
Antes y durante el tratamiento, debe hacerse un seguimiento estrecho del equilibrio electrolítico y de ácido-base durante todo el procedimiento.
En caso de desequilibrio de líquidos, la situación clínica debe ser controlada cuidadosamente y el equilibrio de líquidos debería corregirse según sea necesario.
Método de administración
Vía intravenosa y para hemodiálisis. Prismasol cuando se usa como solución de sustitución se administra dentro del circuito antes del hemofiltro (pre-dilución) ó después del hemofiltro (post-dilución)
Posología
El volumen y la velocidad de uso de Prismasol dependerán de la concentración de electrolitos en sangre, del equilibrio ácido-base y del estado clínico general del paciente. La pauta de administración (dosis, velocidad de perfusión y volumen acumulativo) de Prismasol debería establecerla un médico.
Las velocidades de flujo utilizadas para la solución de sustitución en hemofiltración y hemodiafiltración son:
Adultos: 500 - 3000 ml/h
Las velocidades de flujo utilizadas para la solución de diálisis (dializado) en hemodiálisis continua y hemodiafiltración continua son:
Adultos: 500 - 2500 ml/h
Normalmente las tasas de flujo utilizadas en adultos son de aproximadamente 2000 ml/h a 2500 ml/h, lo que corresponde a un volumen de líquido diario de entre 48 y 60 litros aproximadamente.
Población pediátrica
Los intervalos de tasas de flujo de la solución de sustitución en hemofiltración y hemodiafiltración y de la solución de diálisis (dializado) en hemodiálisis continua son:
Niños (de neonatos a adolescentes de hasta 18 años de edad): de 1000 a 2000 ml/h/1,73 m2.
Pueden ser necesarias velocidades de flujo de hasta 4000 ml/h/1,73 m2, especialmente en niños pequeños (≤10 kg). La velocidad de flujo absoluta (en ml/h) de la población pediátrica no debería superar por lo general la velocidad de flujo máxima de los adultos.
Instrucciones de manipulación
La solución de electrolitos (compartimento pequeño A) se añade a la solución tampón (compartimento grande B) después de romper la pared sellada justo antes de usar para obtener la solución reconstituida.
Utilizar únicamente con equipos de sustitución renal extracorpórea adecuados.
Se deberá seguir una técnica aséptica durante todo el proceso de manipulación y administración al paciente.
Usar solo si la sobrebolsa está intacta, todos los sellos están intactos, la pared sellada no está rota y la solución es transparente. Apriete la bolsa con firmeza para asegurarse de que no haya fugas. Si se observan fugas, desechar inmediatamente la solución ya que la esterilidad no puede ser garantizada.
El compartimiento grande (B), está equipado con un puerto de inyección para añadir otros fármacos que sean necesarios una vez reconstituida la solución. Es responsabilidad del médico juzgar la compatibilidad de un medicamento añadido a Prismasol comprobando el cambio eventual de color y/o precipitación eventual, complejos insolubles o cristales. Antes de añadir un medicamento, verificar si es soluble y estable en agua al pH de Prismasol (el pH de la solución reconstituida está comprendido entre 7,0 y 8,5). Los aditivos podrían no ser compatibles. Deben consultarse las Instrucciones de uso de la medicación añadida.
Eliminar cualquier líquido del puerto de inyección, poner la bolsa en posición invertida, añadir el medicamento a través del puerto de inyección y mezclar perfectamente. La solución debe administrarse inmediatamente. La introducción y el mezclado de los aditivos siempre debe realizarse antes de conectar la bolsa de la solución al circuito extracorpóreo.
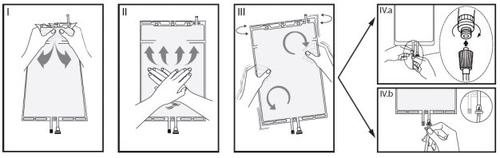
IRetirar la sobrebolsa de la bolsa inmediatamente antes de usar y mezclar las soluciones de los dos diferentes compartimentos. Sujete el compartimento pequeño con ambas manos y apriete hasta que abra la pared sellada despegable entre los dos compartimentos. (Véase figura I de abajo).
IIPresione el compartimento grande con ambas manos hasta que la pared sellada entre los dos compartimentos esté completamente abierta. (Véase figura II de abajo).
IIIAsegúrese de que las soluciones estén completamente mezcladas agitando la bolsa suavemente. La solución está ahora lista para usar y la bolsa puede ser colgada en el equipo. (Véase figura III de abajo).
IVLa línea de diálisis o de sustitución puede ser conectada a cualquiera de los dos puertos de acceso.
IV.aSi se utiliza el conector luer, quite el tapón mediante un movimiento de giro y extracción y conecte el conector luer macho de la línea de diálisis o sustitución en el receptor luer hembra de la bolsa mediante un movimiento de presión y giro. Asegúrese de que la conexión está bien hecha y apretada. La conexión se abrirá. Compruebe que el líquido circula libremente. (Véase figura IVa de abajo).
Si la línea de diálisis o sustitución se desconecta del conector luer, el conector se cerrará y el flujo de la solución se detendrá. El puerto luer es un puerto sin aguja que se puede limpiar.
IV.bSi se usa el acceso de inyección, retire primero la cápsula. El puerto de inyección es un puerto que se puede desinfectar con torunda. Introduzca el espigón a través de la pared de goma. Verificar que la solución circula libremente. (Véase figura IVb de abajo).
La solución debería usarse inmediatamente después de retirar la sobrebolsa. De no hacerse así, la solución reconstituida debería usarse en un plazo de 24 horas, incluyendo la duración del tratamiento tras la adición de la solución de electrolitos a la solución tampón.
La solución reconstituida es para usar una sola vez. Desechar inmediatamente cualquier resto de solución no utilizada.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a PRISMASOL 2 mmol/l POTASIO, SOLUCION PARA HEMODIALISIS Y HEMOFILTRACIONForma farmacéutica: HEMOFILTRACION, 2 mmol potasio/lPrincipio activo: HemofiltratesFabricante: Nikkiso BelgiumRequiere recetaForma farmacéutica: HEMOFILTRACION, 4 mmol potasio/lPrincipio activo: HemofiltratesFabricante: Nikkiso BelgiumRequiere recetaForma farmacéutica: HEMOFILTRACION, -Principio activo: HemofiltratesFabricante: Nikkiso BelgiumRequiere receta
Médicos online para PRISMASOL 2 mmol/l POTASIO, SOLUCION PARA HEMODIALISIS Y HEMOFILTRACION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de PRISMASOL 2 mmol/l POTASIO, SOLUCION PARA HEMODIALISIS Y HEMOFILTRACION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















