
NIVESTIM 12 MU/0,2 ml SOLUCION INYECTABLE O PARA PERFUSION

Cómo usar NIVESTIM 12 MU/0,2 ml SOLUCION INYECTABLE O PARA PERFUSION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Nivestim 12MU/0,2ml solución inyectable y para perfusión
Nivestim 30MU/0,5ml solución inyectable y para perfusión
Nivestim 48MU/0,5ml solución inyectable y para perfusión
filgrastim
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento,porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volverlo a leerlo.
- Si tiene alguna duda, consulte a su médico, enfermero o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Nivestim y para qué se utiliza
- Qué necesita saber antes de empezar a usar Nivestim
- Cómo usar Nivestim
- Posibles efectos adversos
- Conservación de Nivestim
- Contenido del envase e información adicional
1. Qué es Nivestim y para qué se utiliza
Nivestim es un factor de crecimiento de glóbulos blancos (factor estimulante de las colonias de granulocitos) y pertenece a un grupo de medicamentos llamados citocinas. Los factores de crecimiento son proteínas que se producen de manera natural en el cuerpo, pero también pueden producirse usando ingeniería genética para su uso como medicamento. Nivestim funciona haciendo que la médula ósea produzca más glóbulos blancos.
Una reducción en el número de glóbulos blancos (neutropenia) se puede producir por varias razones y hace que su cuerpo sea menos eficaz a la hora de combatir las infecciones. Nivestim estimula la médula ósea para que produzca nuevos glóbulos blancos rápidamente.
Nivestim se puede utilizar:
- para aumentar el número de glóbulos blancos tras el tratamiento con quimioterapia para ayudar a prevenir infecciones;
- para aumentar el número de glóbulos blancos tras un trasplante de médula ósea para ayudar a prevenir infecciones;
- antes de la quimioterapia a dosis altas para hacer que la médula ósea produzca más células madre, que pueden ser recogidas y administradas de nuevo a usted después del tratamiento. Estas células se pueden recoger de usted o de un donante. Las células madre volverán entonces a la médula ósea y producirán células sanguíneas;
- para aumentar el número de glóbulos blancos si sufre de neutropenia crónica grave para ayudar a prevenir infecciones;
- para ayudar a reducir el riesgo de infecciones en pacientes con infección por VIH avanzada.
2. Qué necesita saber antes de empezar a usar Nivestim
No use Nivestim
- si es alérgico al filgrastim o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Nivestim.
Informe a su médico antes de empezar el tratamiento si sufre:
- anemia de células falciformes, ya que Nivestim puede causar crisis de anemia falciforme;
- osteoporosis (enfermedad ósea).
Informe a su medico inmediatamente durante el tratamiento con Nivestim si:
- tiene signos repentinos de alergia, tales como erupción, picor o urticaria en la piel, hinchazón de la cara, labios, lengua u otras partes del cuerpo, falta de aliento, sibilancias o problemas al respirar, ya que podrían ser signos de una reacción alérgica grave (hipersensibilidad);
- experimenta hinchazón en la cara o los tobillos, sangre en la orina u orina de color marrón, o si nota que orina con menor frecuencia que de lo habitual (glomerulonefritis);
- experimenta dolor en la parte superior izquierda del vientre (abdominal), dolor debajo de la caja torácica izquierda o en el extremo izquierdo del hombro (estos pueden ser síntomas de un bazo agrandado [esplenomegalia] o una posible ruptura del bazo);
- nota sangrados o cardenales inusuales (estos pueden ser síntomas de una disminución de las plaquetas en sangre [trombocitopenia], con una capacidad reducida de la sangre para coagularse).
- Rara vez se ha notificado inflamación de la aorta (el vaso sanguíneo grande que transporta sangre desde el corazón hasta el resto del cuerpo) en pacientes con cáncer y en donantes sanos. Los síntomas pueden incluir fiebre, dolor abdominal, malestar general, dolor de espalda y marcadores inflamatorios aumentados. Informe a su médico si presenta estos síntomas.
Pérdida de respuesta al filgrastim
Si experimenta una pérdida de respuesta o si no se consigue mantener la respuesta al tratamiento con filgrastim, su médico investigará las causas incluyendo si ha desarrollado anticuerpos que puedan neutralizar la actividad de filgrastim.
Puede que su médico quiera supervisarle estrechamente, ver sección 4 del prospecto.
Si usted es un paciente con neutropenia crónica grave, puede estar en riesgo de desarrollar cáncer de la sangre (leucemia, síndrome mielodisplásico [SMD]). Hable con su médico acerca de los riesgos de desarrollar cáncer de la sangre y de las pruebas que se deben realizar. Si desarrolla o es probable que desarrolle cánceres de la sangre, no debe utilizar Nivestim a menos que lo indique su médico.
Si usted es un donante de células madre, debe tener entre 16 y 60 años de edad.
Tenga especial cuidado con otros productos que estimulan los glóbulos blancos
Nivestim pertenece a un grupo de medicamentos que estimula la producción de glóbulos blancos. Su médico debe registrar siempre el producto exacto que esté utilizando.
Uso de Nivestim con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo y lactancia
Nivestim no ha sido estudiado en mujeres embarazadas o en periodo de lactancia.
No se recomienda el uso de Nivestim durante el embarazo.
Es importante que informe a su médico si usted:
- está embarazada o en periodo de lactancia;
- cree que pueda estar embarazada; o
- planea quedarse embarazada.
Si se queda embarazada durante el tratamiento con Nivestim, informe a su médico.
A menos que su médico le indique lo contrario, debe dejar de dar el pecho si utiliza Nivestim.
Conducción y uso de máquinas
La influencia de Nivestim sobre su capacidad para conducir y usar máquinas es pequeña. Este medicamento puede producir mareos. Es aconsejable esperar y ver cómo se siente tras la administración de Nivestim antes de conducir o manejar maquinaria.
Nivestim contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de 0,6 mg/ml o 0,96 mg/ml; esto es, esencialmente “exento de sodio”.
Nivestim contiene sorbitol
Este medicamento contiene 50 mg de sorbitol en cada ml.
El sorbitol es una fuente de fructosa. Si usted (o su hijo) padecen intolerancia hereditaria a la fructosa (IHF), una enfermedad genética rara, no deben recibir este medicamento. Los pacientes con IHF no pueden descomponer la fructosa, lo que puede provocar efectos adversos graves.
Consulte con su médico antes de recibir este medicamento si usted (o su hijo) padecen IHF o si su hijo no puede tomar alimentos o bebidas dulces porque les produce mareos, vómitos o efectos desagradables como hinchazón, calambres en el estómago o diarrea.
3. Cómo usar Nivestim
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico, enfermero o farmacéutico.
¿Cómo se administra Nivestim y cuánto debo tomar?
Nivestim se administra por lo general una vez al día como una inyección en el tejido justo debajo de la piel (conocida como inyección subcutánea). También se puede administrar una vez al día como una inyección lenta en la vena (conocida como perfusión intravenosa). La dosis habitual varía en función de su enfermedad y peso. Su médico le indicará la cantidad de Nivestim que debe tomar.
Pacientes con trasplante de médula ósea después de la quimioterapia:
Normalmente recibirá su primera dosis de Nivestim al menos 24 horas después de la quimioterapia y al menos 24 horas después de recibir su trasplante de médula ósea.
A usted o a las personas que le atienden se les puede enseñar a administrar inyecciones subcutáneas para que pueda continuar el tratamiento en su casa. Sin embargo, no debe intentarlo a menos que su profesional sanitario le haya entrenado de forma adecuada.
¿Cuánto tiempo tengo que tomar Nivestim?
Tendrá que tomar Nivestim hasta que su recuento de glóbulos blancos sea normal. Se le realizarán análisis de sangre periódicos para supervisar el número de glóbulos blancos en su cuerpo. Su médico le indicará cuanto tiempo necesita tomar Nivestim.
Uso en niños
Nivestim se utiliza para tratar a niños que están recibiendo quimioterapia o que sufren de un recuento de glóbulos blancos bajo (neutropenia) grave. La dosis en niños que están recibiendo quimioterapia es la misma que para adultos.
Si usa más Nivestim del que debe
No aumente la dosis que le ha recetado su médico. Si cree que ha inyectado mayor dosis de la que debiera, contacte con su médico tan pronto como sea posible.
Si olvidó usar Nivestim
Si ha olvidado una inyección, o si se inyectó menos dosis, contacte con su médico tan pronto como sea posible. No tome una dosis doble para compensar las dosis olvidadas.
Si tiene cualquier duda sobre el uso de este medicamento, pregunte a su médico, enfermero o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Informe a su medico inmediatamentedurante el tratamiento:
- si experimenta una reacción alérgica, incluida debilidad, caída de la presión arterial, dificultad para respirar, hinchazón de la cara (anafilaxis), erupción cutánea, erupción cutánea con picor (urticaria), hinchazón de la cara, labios, boca, lengua o garganta (angioedema) y falta de aliento (disnea);
- si experimenta tos, fiebre y dificultad para respirar (disnea), ya que puede ser un signo del síndrome de distrés respiratorio agudo (SDRA);
- si experimenta daño renal (glomerulonefritis). Se ha observado daño renal en pacientes que recibían filgrastim. Contacte con su médico inmediatamente si observa hinchazón en la cara o tobillos, sangre en la orina u orina de color marrón, o nota que orina con menor frecuencia de lo habitual;
- si experimenta alguno de los siguientes efectos adversos o una combinación de ellos:
- hinchazón, que puede estar relacionada con orinar con una menor frecuencia, dificultad para respirar, hinchazón y sensación de plenitud en el abdomen, y una sensación general de cansancio. Estos síntomas generalmente se desarrollan muy rápidamente.
Estos pueden ser síntomas de una enfermedad llamada “síndrome de fuga capilar”, que provoca que la sangre se escape de los vasos sanguíneos pequeños hacía otros lugares de su cuerpo y requiere atención médica urgente.
- Si experimenta una combinación de los siguientes síntomas:
- fiebre, o escalofríos, o sensación de mucho frío, frecuencia cardíaca alta, confusión o desorientación, dificultad para respirar, dolor extremo o malestar y piel húmeda o sudorosa.
Estos podrían ser síntomas de una afección llamada “sepsis” (también llamada “intoxicación sanguínea”), una infección grave con respuesta inflamatoria de todo el cuerpo que puede ser potencialmente mortal y requiere atención médica urgente.
- si experimenta dolor en la parte superior izquierda del vientre (abdominal), dolor en el lado inferior izquierdo de la caja torácica o dolor en el extremo del hombro, ya que se podría tratar de algún problema con su bazo (agrandamiento del bazo [esplenomegalia] o rotura del bazo);
- si está siendo tratado por neutropenia crónica grave y tiene sangre en la orina (hematuria). Su médico le realizará análisis de orina periódicos si experimenta este efecto adverso o si se encuentran proteínas en su orina (proteinuria).
Un efecto adverso frecuente del uso de filgrastim es dolor en los músculos o huesos (dolor musculoesquelético), que se puede evitar tomando medicamentos habituales para aliviar el dolor (analgésicos). En los pacientes sometidos a un trasplante de células madre o de médula ósea, puede aparecer enfermedad del injerto contra huésped (EICH). Esta es una reacción de las células del donante contra el paciente que recibe el trasplante; los signos y síntomas incluyen erupciones en las palmas de las manos o las plantas de los pies, y úlceras y llagas en la boca, intestino, hígado, piel, ojos, pulmones, vagina y articulaciones.
En donantes sanos de células madre se puede observar un incremento de los glóbulos blancos (leucocitosis) y una disminución de las plaquetas. Esto reduce la capacidad de coagulación de su sangre (trombocitopenia). Estos efectos serán vigilados por su médico.
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Disminución de las plaquetas, lo que reduce la capacidad de la sangre de coagularse (trombocitopenia)
- Recuento bajo de glóbulos rojos (anemia)
- Dolor de cabeza
- Diarrea
- Vómitos
- Náuseas
- Pérdida o debilitamiento del cabello inusual (alopecia)
- Cansancio (fatiga)
- Irritación e hinchazón del revestimiento del tubo digestivo, que va de la boca al ano (inflamación de la mucosa)
- Fiebre (pirexia)
Efectos adversos frecuentes(pueden afectar hasta 1 de cada 10 personas):
- Inflamación de los pulmones (bronquitis)
- Infección del tracto respiratorio superior
- Infección del tracto urinario
- Apetito disminuido
- Problemas para dormir (insomnio)
- Mareos
- Disminución de la sensibilidad, en especial en la piel (hipoestesia)
- Hormigueo o entumecimiento de las manos o los pies (parestesia)
- Tensión arterial baja (hipotensión)
- Tensión arterial alta (hipertensión)
- Tos
- Tos con sangre (hemoptisis)
- Dolor en la boca y garganta (dolor orofaríngeo)
- Hemorragia nasal (epistaxis)
- Estreñimiento
- Dolor oral
- Aumento del tamaño del hígado (hepatomegalia)
- Erupción
- Enrojecimiento de la piel (eritema)
- Calambre muscular
- Dolor al orinar (disuria)
- Dolor en el pecho
- Dolor
- Debilidad generalizada (astenia)
- Sensación de malestar (malestar general)
- Hinchazón en manos y pies (edema periférico)
- Aumento de ciertas enzimas en la sangre
- Cambios en el análisis bioquímico de la sangre
- Reacción a la transfusión
Efectos adversos poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- Aumento de los glóbulos blancos de la sangre (leucocitosis)
- Reacción alérgica (hipersensibilidad)
- Rechazo del trasplante de médula ósea (enfermedad del injerto contra el huésped)
- Niveles altos de ácido úrico en la sangre, que pueden causar gota (hiperuricemia) (ácido úrico elevado en sangre)
- Daño hepático causado por el bloqueo de las pequeñas venas del hígado (enfermedad venooclusiva)
- Los pulmones no funcionan como deberían causando falta de aliento (insuficiencia respiratoria)
- Hinchazón o fluido en los pulmones (edema pulmonar)
- Inflamación de los pulmones (enfermedad pulmonar intersticial)
- Radiografías anormales de los pulmones (infiltración pulmonar)
- Sangrado de los pulmones (hemorragia pulmonar)
- Falta de absorción de oxígeno en los pulmones (hipoxia)
- Erupción cutánea irregular (erupción maculopapular)
- Enfermedad que hace que los huesos pierdan densidad haciéndolos más débiles, más frágiles y propensos a romperse (osteoporosis)
- Reacción en la zona de inyección
Efectos adversos raros(pueden afectar hasta 1 de cada 1.000 personas):
- Dolor intenso en los huesos, pecho, intestinos o articulaciones (anemia de células falciformes con crisis)
- Reacciones alérgicas repentinas y que pueden poner en peligro la vida (reacción anafiláctica)
- Hinchazón y dolor en las articulaciones, similar a la gota (pseudogota)
- Un cambio en la forma en que su cuerpo regula los fluidos corporales que puede resultar en hinchazón (alteraciones del volumen de fluidos)
- Inflamación de los vasos sanguíneos de la piel (vasculitis cutánea)
- Úlceras dolorosas, inflamadas y de color rojo oscuro en las extremidades y, a veces, en la cara y el cuello que cursan con fiebre (síndrome de Sweet)
- Empeoramiento de la artritis reumatoide
- Cambios inusuales en la orina
- Disminución de la densidad ósea
- Inflamación de la aorta (el vaso sanguíneo grande que transporta sangre desde el corazón hasta el resto del cuerpo), ver sección 2.
- Formación de células sanguíneas fuera de la médula ósea (hematopoyesis extramedular).
Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos posibles adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Nivestim
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta de la jeringa precargada después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar refrigerado (entre 2°C y 8°C). No congelar. Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
La jeringa puede sacarse de la nevera y dejarse a temperatura ambiente durante un periodo único máximo de hasta 15 días (pero a una temperatura no superior a 25 ºC).
No emplee este medicamento si ve que el contenido de la jeringa está turbio o si tiene partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Nivestim
- El principio activo es filgrastim. Cada ml contiene 60 millones de unidades [MU] (600 µg) o 96 millones de unidades ([MU] (960 µg) de filgrastim.
- Nivestim 12 MU/0,2 ml solución inyectable/ perfusión: cada jeringa precargada contiene 12 millones de unidades (MU), 120 µg de filgrastim en 0,2 ml (correspondientes a 0,6 mg/ml
- Nivestim 30 MU/0,5 ml solución inyectable / perfusión: cada jeringa precargada contiene 30 millones de unidades (MU), 300 µg de filgrastim en 0,5 ml (correspondientes a 0,6 mg/ml).
- Nivestim 48 MU/0,5 ml solución inyectable / perfusión: cada jeringa precargada contiene 48 millones de unidades (MU), 480 µg de filgrastim en 0,5 ml (correspondientes a 0,96 mg/ml
- Los demás componentes son ácido acético (glacial), hidróxido de sodio, sorbitol E420, polisorbato 80 y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Nivestim es una solución para inyección/perfusión transparente e incolora que se suministra en una jeringa precargada con una aguja de inyección (acero inoxidable) con una protección para la aguja. El capuchón de la aguja contiene epoxipreno, un derivado del látex de caucho natural que puede entrar en contacto con la aguja.
Nivestim se encuentra disponible en envases de 1, 5, 8 o 10 jeringas en cada envase. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Bélgica
Responsable de la fabricación
Hospira Zagreb d.o.o.
Prudnicka cesta 60
10291 Prigorje Brdovecko
Croacia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Luxembourg/Luxemburg Pfizer NV/SA Tél/Tel: +32 (0)2 554 62 11 | Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel: +370 52 51 4000 |
| Magyarország Pfizer Kft. Tel.: +36 1 488 37 00 |
Ceská republika Pfizer, spol. s r.o. Tel: +420-283-004-111 | Malta Drugsales Ltd Tel: +356 21 419 070/1/2 |
Danmark Pfizer ApS Tlf.: +45 44 20 11 00 | Nederland Pfizer bv Tel: +31 (0)800 63 34 636 |
Deutschland PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Norge Pfizer AS Tlf: +47 67 52 61 00 |
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 | Österreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
Ελλáδα Pfizer ΕΛΛ?Σ A.E. Τηλ: +30 210 6785 800 | Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
España Pfizer, S.L. Tel: +34 91 490 99 00 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 55 00 |
France Pfizer Tél: +33 (0)1 58 07 34 40 | România Pfizer România S.R.L. Tel: +40 (0)21 207 28 00 |
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 | Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: +386 (0)1 52 11 400 |
Ireland Pfizer Healthcare Ireland Unlimited Company Tel: +1800 633 363 (toll free) Tel: +44 (0) 1304 616161 | Slovenská republika Pfizer Luxembourg SARL, organizacná zložka Tel: +421–2–3355 5500 |
Ísland Icepharma hf. Sími: +354 540 8000 | Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 | Sverige Pfizer AB Tel: +46 (0)8 550 520 00 |
Κúπρος Pfizer ΕΛΛΑΣ Α.Ε. (Cyprus Branch) Τηλ: +357 22 817690 | Latvija Pfizer Luxembourg SARL filiale Latvija Tel: + 371 670 35 775 |
Fecha de laúltima revisión de este prospecto:{MM/AAAA}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento: https://www.ema.europa.eu.
-------------------------------------------------------------------------------------------------------
Instrucciones de autoadministración por el paciente
Esta sección contiene información sobre cómo administrarse usted mismo una inyección de Nivestim. Es importante que no intente administrarse la inyección sin que antes su médico o profesional de enfermería le haya explicado cómo hacerlo. Es también importante que deseche las jeringas en un recipiente para objetos punzocortantes (a prueba de pinchazos). Si no está seguro de querer administrarse la inyección usted mismo o tiene alguna pregunta, consulte a su médico o profesional de enfermería.
¿Cómo debo inyectarme Nivestim?
Nivestim se administra generalmente una vez al día mediante una inyección, normalmente en el tejido situado por debajo de la piel. Esto se conoce como inyección subcutánea.
Si aprende como administrarse usted mismo la inyección ya no tendrá que esperar en su casa a que venga una enfermera o ir al hospital o la clínica cada día para que le administren su inyección.
Necesitará administrarse su inyección aproximadamente en el mismo momento cada día. Los lugares más adecuados para la administración de la inyección son los siguientes:
- La parte delantera de los muslos
- El abdomen, excepto el área alrededor del ombligo
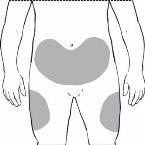
Es mejor cambiar cada día el lugar de la inyección para evitar el riesgo de sensación dolorosa en cualquier lugar.
Equipo requerido para la administración:
Para la administración de la inyección subcutánea se necesitan los siguientes elementos:
- Una jeringa precargada nueva de Nivestim
- Un recipiente para objetos punzocortantes (a prueba de pinchazos) para desechar de forma segura las jeringas usadas
- Compresas antisépticas (si se las recomienda su médico o enfermera)
¿Cómo administrar la inyección subcutánea de Nivestim?
- Procure administrarse la inyección aproximadamente a la misma hora cada día.
- Saque el envase con la jeringa precargada de Nivestim de la nevera.
- Saque el blíster con la jeringa precargada del envase. Cuando el envase contenga blísteres con más de una jeringa precargada, corte el blíster con una jeringa precargada a lo largo de la parte perforada, devuelva el resto de los blísteres con jeringas precargadas al envase y retorne el envase a la nevera.
- Abra el blíster con la jeringa precargada quitando la tapa del blíster. Saque la jeringa precargada del blíster cogiéndola por el cuerpo de la jeringa.
- Noagarre el capuchón gris de la aguja ni el émbolo.
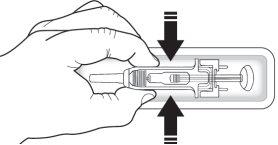
Verifique la jeringa para asegurarse de que el protector de seguridad de la aguja cubre el cuerpo de la jeringa precargada. Noempuje el protector de seguridad para la aguja sobre el capuchón de la aguja antes de la inyección. Esto puede activar o bloquear el protector de seguridad de la aguja. Si el protector de seguridad de la aguja cubre la aguja, significa que se ha activado.
Verifique que la solución es transparente, incolora y prácticamente sin partículas visibles. Noinspeccione el producto a través del plástico del dispositivo de seguridad.
Verifique la fecha en la etiqueta para asegurarse de que el medicamento no haya pasado la fecha de caducidad.
Asegúrese de tener cerca un recipiente para objetos punzocortantes (a prueba de pinchazos).
Deje que la jeringa precargada alcance la temperatura ambiente (aproximadamente 25 °C). Esto tardará 15‑30 minutos.
- Noretire el capuchón de la aguja de la jeringa mientras deja que la jeringa precargada alcance la temperatura ambiente.
- Noagite la jeringa.
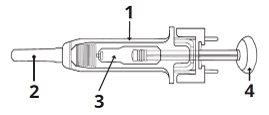
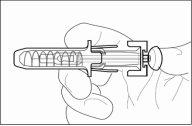
1 | Protector de seguridad para la aguja |
2 | Capuchón de la aguja |
3 | Medicamento |
4 | Émbolo |
- No utilice la jeringa de Nivestim si:
- El envase de cartón está abierto o dañado.
- Falta el protector de seguridad para la aguja, se ha desprendido o se ha activado.
- El medicamento está turbio o ha cambiado de color o el líquido tiene partículas flotando en él.
- Alguna parte de la jeringa precargada aparece agrietada o rota o se ha salido líquido de la jeringa.
- La jeringa precargada se ha caído. La jeringa precargada puede estar rota incluso si no puede ver la rotura.
- Falta el capuchón de la aguja o no está bien colocado.
- La fecha de caducidad impresa en la etiqueta ha pasado.
En todos los casos anteriores, deseche la jeringa precargada y utilice una jeringa precargada nueva.
- Busque un sitio confortable para administrarse la inyección y verifique la dosis que le han prescrito.
- Lave sus manos minuciosamente con agua y jabón
- Tome la jeringa precargada por el cuerpo del protector de seguridad para la aguja con el capuchón de la aguja apuntando hacia arriba.
- Nosujete por la cabeza del émbolo, el émbolo o el capuchón de la aguja.
- Notire hacia atrás del émbolo en ningún momento.
- Noretire el capuchón de la aguja de la jeringa precargada hasta que esté listo para inyectar su medicamento.
- Retire el capuchón de la aguja de la jeringa sosteniendo el cuerpo de la jeringa y tire del capuchón de la aguja hacia afuera y lejos de su cuerpo con cuidado sin girarlo. Deseche el capuchón de la aguja. No vuelva a tapar la aguja. No empuje el émbolo, toque la aguja ni agite la jeringa.
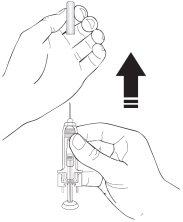
- La jeringa está ahora lista para usar. Puede observar una pequeña burbuja de aire en la jeringa. No necesita expulsar la burbuja de aire antes de inyectar la solución. La inyección de la solución con una burbuja de aire es inocua.
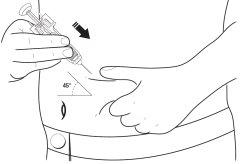
- Decida dónde se va a administrar la inyección- Busque un lugar en la parte delantera de su abdomen o en la parte delantera de sus muslos. Elija un lugar diferente de inyección cada vez. No escoja un área que esté sensible, enrojecida, dañada o que tenga una cicatriz. Limpie esta zona de la piel con una gasa antiséptica.
- Pellizque un área amplia de la piel, teniendo cuidado de no tocar el área que había limpiado.
12 Con la otra mano, sostenga la jeringa precargada como si fuera un lápiz. Utilice un movimiento rápido de “dardo” para insertar la aguja en un ángulo aproximado de 45º en la piel como se muestra.
- Tire ligeramente del émbolo para confirmar que no ha pinchado un vaso sanguíneo. Si ve sangre en la jeringa, retire la aguja e insértela en otro lugar. Manteniendo la piel pellizcada, presione el émbolo lenta y uniformemente hasta que se haya vaciado el contenido de la jeringa.
- Después de inyectar la solución quite la aguja de la piel
- Asegúrese de que el protector de jeringa cubre la aguja de acuerdo con las instrucciones del protector de jeringa activo o del protector de jeringa pasivo según se indica más abajo.
- No intente volver a colocar el capuchón de la aguja. Poner la jeringa en un recipiente para objetos punzocortantes (a prueba de pinchazos).
- Mantenga las jeringas usadas fuera del alcance y de la vista de los niños
- Nuncaponga las jeringas usadas en el contenedor de basura doméstica normal.
Recuerde
La mayoría de las personas pueden aprender a administrarse la inyección subcutánea por sí mismas, pero si le resulta muy difícil, no dude en pedir ayuda y consejo a su médico o enfermera.
Uso del Protector Ultraseguro Activo de agujas paraNivestim 12MU/0,2ml solución inyectable y para perfusión
Las jeringas precargadas tienen un Protector Ultraseguro Activo de Agujas para protegerle de los pinchazos. Cuando maneje una jeringa precargada, mantenga las manos detrás de la aguja.
- Realice la inyección empleando la técnica descrita anteriormente
- Cuando haya completado la inyección, deslice la aguja dentro del protector de seguridad hasta que la aguja esté completamente cubierta (hará un “clic”).
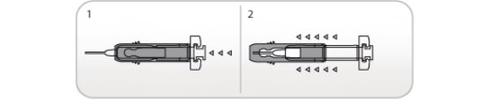
Uso del Protector Pasivo Ultraseguro de Aguja paraNivestim 30MU/0,5ml solución inyectable / perfusión y Nivestim 48MU/0,5ml solución inyectable / perfusión
Las jeringas precargadas tienen un Protector Pasivo Ultraseguro de Aguja para protegerle de los pinchazos. Cuando maneje una jeringa precargada, mantenga las manos detrás de la aguja.
- Realice la inyección empleando la técnica descrita anteriormente
- Presione el émbolo mientras sujeta la jeringa con los dedos hasta que se haya administrado la dosis completa. El protector de jeringa pasivo NO se activará hasta que se haya administrado TODA la dosis
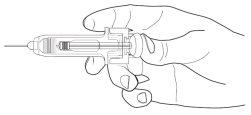
- Saque la aguja de su piel, el émbolo se moverá y permitirá que la jeringa se mueva hacia arriba hasta que la aguja esté guardada y bloqueada en su sitio.
--------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
Nivestim no contiene conservantes: en vista del posible riesgo de contaminación microbiológica, las jeringas de Nivestim son para un solo uso.
La exposición accidental a temperaturas de congelación durante un máximo de 24 horas no afecta a la estabilidad de Nivestim. Las jeringas precargadas congeladas pueden ser descongeladas y después refrigeradas para un uso futuro. Si la exposición ha sido superior a 24 horas o si las jeringas han sido congeladas más de una vez, entonces NO se debe usar Nivestim.
Nivestim no debe diluirse con soluciones de cloruro sódico. Este medicamento no se debe mezclar con otros medicamentos que no sean los que se mencionan a continuación. Filgrastim diluido puede ser adsorbido a materiales de plástico o vidrio, excepto si está diluido como se menciona seguidamente.
Nivestim se puede diluir, si es necesario, en una solución de glucosa al 5%. No se recomienda en ningún caso diluir a concentraciones finales inferiores a 0,2 MU (2 µg) por mililitro. La solución debe inspeccionarse visualmente antes del uso. Tan sólo se deben utilizar soluciones transparentes sin partículas. En los pacientes tratados con filgrastim diluido a concentraciones inferiores a 1,5 MU/ml (15 µg) por mililitro, debe añadirse albúmina sérica humana (ASH) hasta una concentración final de 2 mg/ml.
Ejemplo: si el volumen de inyección final es de 20 ml y la dosis total de filgrastim inferior a 30 MU (300 µg), deben agregarse 0,2 ml de una solución de albúmina sérica humana de 200 mg/ml (al 20%). Cuando se diluye en una solución de glucosa al 5%, Nivestim es compatible con el vidrio y con diversos plásticos, incluidos el cloruro de polivinilo, la poliolefina (un copolímero de polipropileno y polietileno) y el polipropileno.
Tras la dilución: se ha demostrado que, durante el uso, la solución diluida para perfusión permanece físico-químicamente estable durante 24 horas a 2 - 8°C. Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza de forma inmediata, los tiempos de almacenamiento durante el uso y las condiciones previas al mismo son responsabilidad del usuario y normalmente no deberían sobrepasar las 24 horas a 2-8°C, a menos que la dilución se haya realizado en condiciones de asepsia validadas y controladas.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a NIVESTIM 12 MU/0,2 ml SOLUCION INYECTABLE O PARA PERFUSIONForma farmacéutica: INYECTABLE, 12 MU/0,2 mlPrincipio activo: FilgrastimFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 0,3 mg / jeringa precargadaPrincipio activo: FilgrastimFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 0,3 mg / jeringa precargadaPrincipio activo: FilgrastimFabricante: Accord Healthcare S.L.U.Requiere receta
Médicos online para NIVESTIM 12 MU/0,2 ml SOLUCION INYECTABLE O PARA PERFUSION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de NIVESTIM 12 MU/0,2 ml SOLUCION INYECTABLE O PARA PERFUSION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes







