
MULTIBIC 4 MMOL/L DE POTASIO SOLUCIÓN PARA HEMODIÁLISIS Y HEMOFILTRACIÓN

Cómo usar MULTIBIC 4 MMOL/L DE POTASIO SOLUCIÓN PARA HEMODIÁLISIS Y HEMOFILTRACIÓN
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
multiBic 4 mmol/l de potasio solución para hemodiálisis y hemofiltración
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es multiBic 4 mmol/l de potasio y para qué se utiliza
- Qué necesita saber antes de empezar a usar multiBic 4 mmol/l de potasio
- Cómo usar multiBic 4 mmol/l de potasio
- Posibles efectos adversos
- Conservación de multiBic 4 mmol/l de potasio
Contenido del envase e información adicional
1. Qué es multiBic 4 mmol/l de potasio y para qué se utiliza
multiBic 4 mmol/l de potasio es una solución de terapia renal sustitutiva continua para la eliminación de productos de desecho del organismo en personas con enfermedad renal. Se utiliza en pacientes con lesión renal y también para el tratamiento de intoxicaciones. El tipo de solución que se administra depende de la cantidad de potasio (una sal) en la sangre. Su médico controlará sus niveles de potasio regularmente.
2. Qué necesita saber antes de empezar a usar multiBic 4 mmol/l de potasio
No use multiBic 4 mmol/l de potasio si
- es alérgico a los principios activos o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- tiene hiperpotasemia (sus niveles de potasio son muy altos)
- padece alcalosis metabólica (cuando tiene demasiado bicarbonato en la sangre).
- no puede alcanzar un flujo sanguíneo suficiente a través del hemofiltro (filtro utilizado en la filtración de la sangre).
- tiene un alto riesgo de sangrado relacionado con los medicamentos necesarios para prevenir la coagulación en el hemofiltro.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar multiBic 4 mmol/l de potasio
- No usar antes de mezclar las dos soluciones en una bolsa de doble cámara (dos compartimentos)
- No debe utilizarse si la temperatura de la solución es inferior a la temperatura ambiente
- Se tiene que inspeccionar cada 30 minutos las líneas de tubos usadas para administrar la solución lista para su uso.
Si se observa un precipitado (materia sólida) dentro de estas líneas de tubos, las bolsas y las líneas de tubos se tienen que reemplazar inmediatamente y el paciente se tiene que monitorizar cuidadosamente.
- Su médico controlará su estado de hidratación (cantidad de agua en su organismo), los niveles de potasio, sodio, otras sales, ciertos productos de desecho y los niveles de azúcar en sangre). Su médico podría también aconsejarle sobre su dieta.
Niños
No se ha establecido el uso de multiBic 4 mmol/l de potasio en niños.
Uso de multiBic 4 mmol/l de potasio con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Es posible que se produzcan las siguientes interacciones:
- Efectos tóxicos de los digitálicos (medicamentos para tratar enfermedades del corazón)
- Sustituciones electrolíticas, nutrición parenteral (alimentación intravenosa) y otros tratamientos con perfusiones. Al usar esta terapia se debe tener en cuenta su efecto sobre la concentración de suero sanguíneo y el estado de líquidos.
- Esta terapia puede reducir la concentración en sangre de medicamentos. Puede ser necesario un ajuste de la dosis.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
No hay datos o éstos son limitados relativos al uso de multiBic 4 mmol/l de potasio en mujeres embarazadas y en periodo de lactancia.
Este medicamento únicamente debe usarse durante el embarazo si su médico considera necesario el tratamiento.
No se recomienda la lactancia durante el tratamiento con multiBic 4 mmol/l de potasio.
3. Cómo usar multiBic 4 mmol/l de potasio
multiBic 4 mmol/l de potasio se le administrará en un hospital o en una clínica. Su médico sabe cómo usar este medicamento.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos de multiBic 4 mmol/l de potasio incluyen:
- náuseas
- vómitos
- calambres musculares
- cambios en la tensión sanguínea
Algunos efectos adversos pueden estar causados por tener demasiado líquido o demasiado poco líquido. Estos son:
- dificultad para respirar
- hinchazón de los tobillos y piernas
- deshidratación (por ejemplo, mareos, calambres musculares, sensación de sed)
- trastornos sanguíneos (por ejemplo, concentraciones anormales de sal en la sangre)
No se conoce la frecuencia exacta de estos eventos (no puede estimarse a partir de los datos disponibles).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de multiBic 4 mmol/l de potasio
Mantener este medicamento fuera de la vista y del alcance de los niños.
No conservar por debajo de 4 °C.
Condiciones de conservación tras la mezcla de los dos compartimentos:
La solución lista para su uso no debe conservarse a una temperatura superior a 30 ºC y debe utilizarse en 48 horas.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
6. Contenido del envase e información adicional
Composición de multiBic 4 mmol/l de potasio
- Los principios activos son cloruro de potasio, cloruro de sodio, bicarbonato de sodio, cloruro de calcio, cloruro de magnesio hexahidrato y glucosa monohidrato.
- Los demás componentes son agua para preparaciones inyectables, ácido clorhídrico al 25%, dióxido de carbono. y dihidrógeno fosfato sódico dihidrato.
Aspecto del producto y contenido del envase
multiBic 4 mmol/l de potasio está disponible en una bolsa de doble cámara (dos compartimentos que contienen diferentes soluciones). La mezcla de las soluciones de los dos compartimentos da lugar a la solución lista para su uso.
Cada bolsa contiene 5.000 ml de solución en total. La solución lista para su uso es transparente y sin color.
Cada bolsa está equipada con un conector HF, un conector Luer lock, un puerto de inyección y está cubierta por una lámina protectora.
Tamaño de envase:
2 bolsas de 5.000 ml
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Fresenius Medical Care Deutschland GmbH, Else-Kröner-Straße 1, 61352 Bad Homburg v.d.H., Alemania
Responsable de la fabricación
Fresenius Medical Care Deutschland GmbH, Frankfurter Straße 6-8, 66606 St. Wendel, Alemania
Representante local
Fresenius Medical Care España S.A.
C/ Ronda de Poniente, 8, planta baja, Parque Empresarial Euronova,
28760 Tres Cantos (Madrid)
España
Fecha de la última revisión de este prospecto: Marzo 2025
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Información destinada únicamente a profesionales del sector sanitario, ver al final de este prospecto.
------------------------------------------------------------------------------------------------------------
La siguiente información está destinada únicamente a profesionales del sector sanitario:
1.000 ml de la solución lista para su uso contiene:
Cloruro de potasio | 0,2982 g |
Cloruro de sodio | 6,136 g |
Bicarbonato sódico | 2,940 g |
Cloruro de calcio dihidrato | 0,2205 g |
Cloruro de magnesio hexahidrato | 0,1017 g |
Glucosa monohidrato | 1,100 g |
(Glucosa) | (1,000 g) |
K+ | 4,0 mmol/l |
Na+ | 140 mmol/l |
Ca2+ | 1,5 mmol/l |
Mg2+ | 0,50 mmol/l |
Cl- | 113 mmol/l |
HCO3- | 35 mmol/l |
Glucosa | 5,55 mmol/l |
pH ≈ 7,4
Osmolaridad teórica: 300 mOsm/l
No usar si la solución no es transparente e incolora y si la bolsa o los conectores están dañados.
Para un solo uso. Cualquier resto de solución sin utilizar debe desecharse.
Utilizar únicamente mediante una bomba integrada en el dispositivo de depuración extracorpórea de la sangre..
Instrucciones de uso
La solución de hemodiálisis y hemofiltración se debe de administrar en tres etapas:
- Eliminación de la sobrebolsa e inspección detallada de la bolsa
Se tiene que quitar la sobrebolsa solo inmediatamente antes de la administración.
Los envases de plástico se pueden dañar de forma ocasional durante el trasporte desde el lugar de fabricación a la clínica o dentro de la misma clínica. En la solución esto puede conducir a una contaminación y crecimiento microbiológico o de hongos. Por ello es necesario realizar una cuidadosa inspección visual de la bolsa y de las soluciones antes de usar. Se debe prestar especial atención incluso a leves desperfectos del tapón, de las soldaduras y bordes de la bolsa.
- Mezcla de los dos compartimentos
Las dos soluciones deben mezclarse inmediatamente antes del uso para obtener la solución lista para su uso.
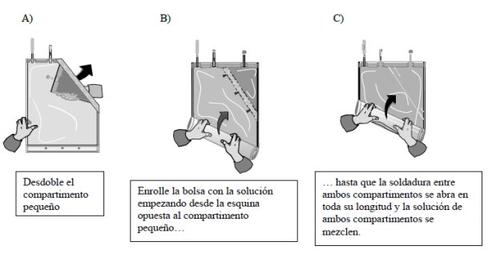
Después de que ambos compartimentos se hayan mezclado, debe verificarse que la soldadura esté totalmente abierta, que la solución sea transparente e incolora y que el envase no pierda líquido.
- Administración de la solución lista para su uso
La solución lista para su uso se debe utilizar inmediatamente, dentro de las 48 horas siguientes a la mezcla.
Cualquier adición a la solución lista para su uso solo se debe realizar después de que la solución lista para su uso se haya mezclado completamente. Después de realizar una adición, la solución de lista para su uso se debe mezclar otra vez a fondo antes del uso.
La adición de una solución de cloruro sódico (hasta el 30%) o alternativamente agua para preparaciones inyectables son compatibles con este medicamento y se puede utilizar para ajustar la concentración de sodio si es necesario para limitar la velocidad de los cambios de concentración de sodio en caso de hipernatremia o hiponatremia grave. Para más detalles, ver la ficha técnica.
Si no se prescribe lo contrario, la solución lista para su uso, se debe calentar inmediatamente antes de la perfusión a 36,5º C – 38,0º C. La temperatura exacta se debe seleccionar dependiendo de los requerimientos clínicos y del equipo técnico utilizado.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a MULTIBIC 4 MMOL/L DE POTASIO SOLUCIÓN PARA HEMODIÁLISIS Y HEMOFILTRACIÓNForma farmacéutica: HEMOFILTRACION, 2 mmol potasio/lPrincipio activo: HemofiltratesFabricante: Nikkiso BelgiumRequiere recetaForma farmacéutica: HEMOFILTRACION, 4 mmol potasio/lPrincipio activo: HemofiltratesFabricante: Nikkiso BelgiumRequiere recetaForma farmacéutica: HEMOFILTRACION, -Principio activo: HemofiltratesFabricante: Nikkiso BelgiumRequiere receta
Médicos online para MULTIBIC 4 MMOL/L DE POTASIO SOLUCIÓN PARA HEMODIÁLISIS Y HEMOFILTRACIÓN
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de MULTIBIC 4 MMOL/L DE POTASIO SOLUCIÓN PARA HEMODIÁLISIS Y HEMOFILTRACIÓN, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















