KOVALTRY 250 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar KOVALTRY 250 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Kovaltry 250 UI polvo y disolvente para solución inyectable
Kovaltry 500 UI polvo y disolvente para solución inyectable
Kovaltry 1000 UI polvo y disolvente para solución inyectable
Kovaltry 2000 UI polvo y disolvente para solución inyectable
Kovaltry 3000 UI polvo y disolvente para solución inyectable
octocog alfa (factor VIII de la coagulación de origen humano recombinante)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Kovaltry y para qué se utiliza
- Qué necesita saber antes de empezar a usar Kovaltry
- Cómo usar Kovaltry
- Posibles efectos adversos
- Conservación de Kovaltry
- Contenido del envase e información adicional
1. Qué es Kovaltry y para qué se utiliza
Kovaltry contiene el principio activo factor VIII de la coagulación humano recombinante, también conocido como octocog alfa. Kovaltry se prepara con tecnología recombinante sin adición de ningún componente de origen humano o animal en el proceso de fabricación. El factor VIII es una proteína que se encuentra de forma natural en la sangre y ayuda a que coagule.
Kovaltry se utiliza para tratar y prevenir hemorragiaen adultos, adolescentes y niños de cualquier edad con hemofilia A (déficit hereditariode factor VIII).
2. Qué necesita saber antes de empezar a usar Kovaltry
No use Kovaltrysi es
- alérgico a octocog alfa o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- alérgico a las proteínas de ratón o hámster.
Advertencias y precauciones
Consulte a su médico o farmacéutico sitiene:
- opresión en el pecho, mareo (incluso cuando se levanta de estar sentado o tumbado), erupción cutánea con picor, sibilancias (silbidos al respirar), sensación de mareo o desmayo. Esto pueden ser signos de una reacción alérgica repentina grave rara a Kovaltry. Interrumpainmediatamente la administración del medicamentoy pida asistencia médica si esto ocurre.
- hemorragia que no se llega a controlar con su dosis habitual de Kovaltry. La formación de inhibidores (anticuerpos) es una complicación conocida que puede producirse durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, especialmente en grandes cantidades, impiden que el tratamiento funcione correctamente, por lo que se supervisará cuidadosamente a los pacientes en tratamiento con Kovaltry por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se está controlando con Kovaltry, consulte a su médico inmediatamente.
- o desarrolló anteriormente inhibidores del factor VIII a otro producto diferente. Si cambia a otro medicamento de factor VIII, puede tener riesgo de volver a desarrollar inhibidores.
- una enfermedad cardíaca confirmada o tiene riesgo de padecer una enfermedad cardíaca.
- que usar un dispositivo de acceso venoso central para la administración de Kovaltry. Puede tener riesgo de sufrir complicaciones relacionadas con el dispositivo, donde el catéter ha sido insertado, como por ejemplo:
- infecciones locales
- bacterias en la sangre
- un coágulo de sangre en el vaso sanguíneo
Niños y adolescentes
Las advertencias y precauciones enumeradas son de aplicación a pacientes de todas las edades, adultos y niños.
Uso de Kovaltry con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
No es probable que Kovaltry afecte a la fertilidad de los pacientes de sexo masculino ni femenino, ya que el principio activo aparece de forma natural en el organismo.
Conducción y uso de máquinas
Si experimenta mareo u otros síntomas que afecte su capacidad para concentrarse y reaccionar, se recomienda que no conduzca ni utilice máquinas hasta que remita el efecto.
Kovaltry contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, esto es esencialmente “exento de sodio”.
3. Cómo usar Kovaltry
El tratamiento con Kovaltry se iniciará por un médico con experiencia en el cuidado de pacientes con hemofília A. Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
El número de unidades de factor VIII se expresan en Unidades Internacionales (UI)
Tratamiento del sangrado
Para tratar el sangrado, su médico calculará y ajustará la dosis y la frecuencia de administración, dependiendo de factores tales como:
- su peso
- la gravedad de su hemofilia A
- la localización y gravedad del sangrado
- si tiene inhibidores del factor VIII y el nivel de ellos
- el nivel requerido de factor VIII.
Prevención del sangrado
Si está utilizando Kovaltry para prevenir el sangrado, su médico calculará la dosis que le conviene. Esta dosis será normalmente de 20 a 40 UI de octocog alfa por kg de peso corporal, inyectada dos o tres veces por semana. No obstante, en algunos casos, especialmente en pacientes más jóvenes, pueden requerirse intervalos de tratamientos más cortos o dosis superiores.
Pruebas de laboratorio
Las pruebas de laboratorio a intervalos apropiados ayudan a asegurar que siempre se tenga los niveles adecuados de factor VIII. En el caso concreto de las intervenciones quirúrgicas importantes, su coagulación sanguínea debe ser estrictamente monitorizada.
Uso en niños y adolescentes
Kovaltry se puede usar en niños de todas las edades. En niños menores de 12 años pueden ser necesarias dosis más altas o inyecciones más frecuentes que las prescritas para adultos.
Pacientes con inhibidores
Si su médico le dice que ha desarrollado inhibidores del factor VIII, podrá necesitar una dosis superior de Kovaltry para controlar el sangrado. Si esta dosis superior no lo controla, su médico podrá considerar la utilización de otro medicamento.
Si desea más información, hable con su médico.
No aumente la dosis de Kovaltry que le han prescrito para controlar su sangrado sin consultar con su médico.
Duración del tratamiento
Generalmente, el tratamiento para la hemofília con Kovaltry será necesario de por vida.
Cómo se administra Kovaltry
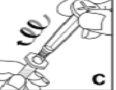
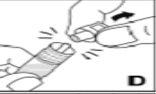
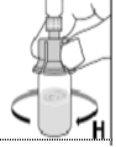
Kovaltry se inyecta en una vena durante 2-5 minutos dependiendo del volumen total y de su nivel de comfort y se debe usar en el plazo de 3 horas después de su reconstitución.
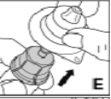
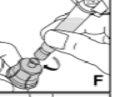
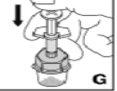
Cómo se prepara Kovaltry para la administración
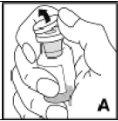
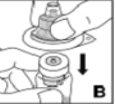
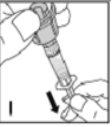
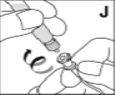
Utilice únicamente los componentes (adaptador del vial, jeringa precargada con el disolvente y equipo para punción venosa) incluidos en el envase para este medicamento. Por favor contacte a su medico si no es posible utilizar estos componentes. No lo utilice si alguno de los componentes del envase está abierto o dañado.
El medicamento reconstituido debe filtrarse usando el adaptador del vialantes de la administración para eliminar posibles partículas presentes en la solución.
No use el equipo de punción venosa suministrado para la extracción de sangre, porque contiene un filtro en línea.
Este medicamento nose debe mezclar con otras soluciones para perfusión. No utilice soluciones si observa partículas o si la solución está turbia. Siga las instrucciones de administración que le dé su médico y recogidas al final de este prospecto.
Si usa más Kovaltry del que debe
Informe a su médico si esto ocurre. No se han comunicado casos de sobredosis.
Si olvidó usar Kovaltry
Administre inmediatamente la siguiente dosis y continúe a intervalos regulares siguiendo las indicaciones de su médico.
No use una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Kovaltry
No deje de usar este medicamento sin consultarlo con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos más gravesson reacciones alérgicasque pueden incluir una reacción alérgica grave. Interrumpainmediatamente la inyección de Kovaltry y hable en seguida con su médico si ésta reacción ocurre.Los siguientes síntomas podríanser un signo precoz de estas reacciones :
- opresión en el pecho o sensación general de malestar
- mareo
- sensación de mareo al levantarse indicando una disminución de la presión arterial
- sensación de malestar (náuseas)
En niños no tratados previamente con medicamentos de factor VIII, se pueden formar de manera muy frecuente (más de 1 de cada 10 pacientes) inhibidores(ver sección 2). En los pacientes que han recibido tratamiento previo con factor VIII (más de 150 días de tratamiento), se pueden formar anticuerpos inhibidores (ver sección 2) con poca frecuencia (menos de 1 de cada 100 pacientes). Si esto sucede, el medicamento que toma puede dejar de funcionar correctamente y usted puede sufrir un sangrado persistente. En ese caso, por favor contacte con su médico inmediatamente.
Otros posibles efectos adversos:
Frecuentes(pueden afectar hasta 1 de cada 10 personas):
- dolor o malestar estomacal
- indigestión
- fiebre
- reacciones locales en el lugar donde se ha inyectado el medicamento (p. ej., sangrado debajo de la piel, picor fuerte, hinchazón, sensación de quemazón, enrojecimiento pasajero)
- dolor de cabeza
- dificultad para dormir
- ronchas
- sarpullido con o sin picor
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- aumento de tamaño de los nódulos linfáticos (hinchazón debajo de la piel del cuello, axila o ingle)
- palpitaciones (sensación de que el corazón late fuerte, rápida o irregularmente)
- latido cardiaco acelerado
- disgeusia (alteración del gusto)
- sofoco (enrojecimiento de la cara)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Kovaltry
Mantener este medicamento fuera de la vista y del alcance de los niños.
Noutilice este medicamento después de la fecha de caducidad que aparece en las etiquetas y las cajas.
La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (2 °C – 8 °C). No congelar.
Conservar este medicamento en el envase original para protegerlo de la luz.
Este medicamento puede conservarse a temperatura ambiente (hasta 25 °C) durante máximo de 12 meses, si lo mantiene en su envase original. Si conserva el medicamento a temperatura ambiente, caduca después de 12 meses o en la fecha de caducidad indicada, según cuál sea antes.
Debe anotar la nueva fecha de caducidad en el embalaje exterior cuando el medicamento se retire de la nevera.
Norefrigerar la solución después de su reconstitución. La solución reconstituida se debe utilizar en un plazo máximo de 3 horas. Utilizar el contenido una sola vez. Desechar la solución no utilizada.
Noutilice este medicamento si observa partículas en la solución o si la solución está turbia.
Los medicamentos nose deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Kovaltry
El principio activoes octocog alfa (factor VIII de la coagulación humano). Cada vial de Kovaltry contiene 250, 500, 1000, 2000 o 3000 UI de octocog alfa.
Los demáscomponentes son sacarosa, histidina, glicina (E 640), cloruro de sodio, cloruro de calcio dihidrato (E 509), polisorbato 80 (E 433), ácido acético glacial (E 260) y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Kovaltry se presenta en forma de polvo y disolvente para solución inyectable. El polvo es seco y de color blanco a ligeramente amarillo. El disolvente es un líquido claro.
Cada envase individual de Kovaltry contiene
- un vial de vidrio con polvo
- una jeringa precargada con disolvente
- émbolo independiente
- un adaptador de vial
- un equipo para punción venosa (para inyección en una vena).
Kovaltry está disponible en tamaños de:
- 1 envase individual
- 1 envase múltiple con 30 envases individuales
Puede que no todos los tamaños estén comercializados.
Titular de la autorización de comercialización
Bayer AG
51368 Leverkusen
Alemania
Responsable de la fabricación
Bayer AG
Kaiser-Wilhelm-Allee
51368 Leverkusen
Alemania
Puedensolicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 | Lietuva UAB Bayer Tel. +37 05 23 36 868 |
???????? ????? ???????? ???? T??.: +359-(0)2-424 72 80 | Luxembourg/Luxemburg Bayer SA-NV Tél/Tel: +32-(0)2-535 63 11 |
Ceská republika Bayer s.r.o. Tel: +420 266 101 111 | Magyarország Bayer Hungária KFT Tel:+36 14 87-41 00 |
Danmark Bayer A/S Tlf: +45 45 23 50 00 | Malta Alfred Gera and Sons Ltd. Tel: +35 621 44 62 05 |
Deutschland Bayer Vital GmbH Tel: +49 (0)214-30 513 48 | Nederland Bayer B.V. Tel: +31-(0)297-28 06 66 |
Eesti Bayer OÜ Tel: +372 655 8565 | Norge Bayer AS Tlf: +47 23 13 05 00 |
Ελλ?δα Bayer Ελλ?ς ΑΒΕΕ Τηλ: +30-210-61 87 500 | Österreich Bayer Austria Ges.m.b.H. Tel: +43-(0)1-711 46-0 |
España Bayer Hispania S.L. Tel: +34-93-495 65 00 | Polska Bayer Sp. z o.o. Tel: +48 22 572 35 00 |
France Bayer HealthCare Tél (N° vert): +33-(0)800 87 54 54 | Portugal Bayer Portugal, Lda. Tel: +351 21 416 42 00 |
Hrvatska Bayer d.o.o. Tel: +385-(0)1-6599 900 | România SC Bayer SRL Tel: +40 21 529 59 00 |
Ireland Bayer Limited Tel: +353 1 216 3300 | Slovenija Bayer d. o. o. Tel: +386 (0)1 58 14 400 |
Ísland Icepharma hf. Sími: +354 540 8000 | Slovenská republika Bayer spol. s r.o. Tel. +421 2 59 21 31 11 |
Italia Bayer S.p.A. Tel: +39 02 397 81 | Suomi/Finland Bayer Oy Puh/Tel: +358- 20 785 21 |
Κ?προς NOVAGEM Limited Tηλ: +357 22 48 38 58 | Sverige Bayer AB Tel: +46 (0) 8 580 223 00 |
Latvija SIA Bayer Tel: +371 67 84 55 63 | United Kingdom (Irlanda del Norte) Bayer AG Tel: +44-(0)118 206 3000 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
--------------------------------------------------------------------------------------------------------------------Instrucciones detalladas de reconstitución y administración de Kovaltry
Necesitará gasas estériles impregnadas en alcohol, gasas estériles, tiras adhesivas y torniquete. Estos artículos no están incluidos en el envase de Kovaltry.
| |
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
| |
| |
|
|
| |
| |
| |
| |
| |
|
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a KOVALTRY 250 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere recetaForma farmacéutica: INYECTABLE, 1.500 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere recetaForma farmacéutica: INYECTABLE, 1000 UI - tras reconstitución en 2 ml de agua para inyectables la dosis es de 500 UI/mlPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere receta
Médicos online para KOVALTRY 250 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de KOVALTRY 250 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes