HIZENTRA 200 MG/ML SOLUCIÓN INYECTABLE SUBCUTÁNEA

Cómo usar HIZENTRA 200 MG/ML SOLUCIÓN INYECTABLE SUBCUTÁNEA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Hizentra 200 mg/ml solución inyectable subcutánea
inmunoglobulina humana normal (IgSC = Inmunoglobulina Subcutánea)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque presenten los mismos síntomas de enfermedad que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Hizentra y para qué se utiliza
- Qué necesita saber antes de empezar a usar Hizentra
- Cómo usar Hizentra
- Posibles efectos adversos
- Conservación de Hizentra
- Contenido del envase e información adicional
1. Qué es Hizentra y para qué se utiliza
Qué es Hizentra
Hizentra pertenece a la clase de medicamentos llamados inmunoglobulinas humanas normales. Las inmunoglobulinas también se conocen como anticuerpos y son proteínas de la sangre que ayudan al organismo a luchar contra las infecciones.
Cómo actúa Hizentra
Hizentra contiene inmunoglobulinas que se han obtenido de la sangre de personas sanas. Las inmunoglobulinas son producidas por el sistema inmunológico del cuerpo. Ayudan al cuerpo a combatir infecciones causadas por bacterias y virus o a mantener el equilibrio en el sistema inmunológico (conocido como inmunomodulación). El medicamento funciona exactamente igual que las inmunoglobulinas presentes de forma natural en la sangre.
Para qué se utiliza Hizentra
Terapia sustitutiva
Hizentra se utiliza para elevar los niveles anormalmente bajos de inmunoglobulina en la sangre hasta los niveles normales (terapia sustitutiva). El medicamento se usa en adultos y niños (0-18 años) en las situaciones siguientes:
- Tratamiento de pacientes que nacen con una menor capacidad o con incapacidad para producir inmunoglobulinas (inmunodeficiencias primarias). Esto incluye condiciones del tipo:
- Niveles bajos de inmunoglobulina (hipogammaglobulinemia) o ausencia de inmunoglobulinas en la sangre (agammaglobulinemia)
- Combinación de niveles bajos de inmunoglobulinas, infecciones frecuentes e incapacidad de producir los niveles adecuados de anticuerpos tras una vacunación (inmunodeficiencia común variable)
- Combinación de niveles bajos o ausencia de inmunoglobulinas, y ausencia o no funcionalidad de las células inmunes (inmunodeficiencia combinada grave)
- Carencia de ciertas subclases de inmunoglobulina G que provocan infecciones recurrentes.
- Tratamiento de pacientes con niveles de inmunoglobulina bajos o disfuncionales en condiciones adquiridas (inmunodeficiencia secundaria) que experimentan infecciones graves o recurrentes debido a un sistema inmunológico debilitado como resultado de otras condiciones o tratamientos.
Terapia inmunomoduladora en pacientes con PDIC
Hizentra también se utiliza en pacientes con polineuropatía desmielinizante inflamatoria crónica (PDIC), un tipo de enfermedad autoinmune. PDIC se caracteriza por la inflamación crónica de los nervios periféricos que causan debilidad muscular y/o entumecimiento principalmente en piernas y brazos. Se cree que el ataque de las defensas del cuerpo acentúa esa inflamación y las inmunoglobulinas de Hizentra ayudan a proteger los nervios del ataque (terapia inmunomoduladora).
2. Qué necesita saber antes de empezar a usar Hizentra
NOperfusionar Hizentra:
- Si es alérgico a las inmunoglobulinas humanas, al polisorbato 80 o a la L-prolina.
- Informe a su médico o profesional sanitario antes del tratamiento si ha sufrido alguna intolerancia a alguno de estos componentes anteriormente.
- Si sufre hiperprolinemia (un trastorno genético causado por la presencia en sangre de altos niveles del aminoácido prolina).
En vasos sanguíneos.
Advertencias y precauciones
- Consulte a su médico, farmacéutico o enfermero antes de usar Hizentra.
Usted puede ser alérgico (hipersensible) a las inmunoglobulinas sin saberlo. No obstante, las reacciones alérgicas verdaderas son raras. Pueden darse aunque haya recibido anteriormente inmunoglobulinas humanas y las haya tolerado bien. Esto puede ocurrir sobre todo si no tiene suficiente cantidad de la inmunoglobulina tipo A (IgA) en la sangre (deficiencia de IgA).
- Informe a su médico o profesional sanitario si padece una deficiencia de inmunoglobulina de tipo A (IgA) antes de iniciar el tratamiento. Hizentra contiene cantidades residuales de IgA que pueden provocar reacciones alérgicas.
En estos casos raros, pueden producirse reacciones alérgicas, como una disminución repentina de la tensión arterial o un shock(ver también sección 4. "Posibles efectos adversos").
- Si nota síntomas de este tipo durante la perfusión de Hizentra, detenga la perfusión y contacte con su médico o vaya al hospital más cercano de forma inmediata.
- Informe a su médico si tiene antecedentes de afección cardíaca o vascular, o si ha sufrido la formación de coágulos sanguíneos, tiene la sangre demasiado espesa o ha estado inmovilizado durante algún tiempo. Estos factores pueden aumentar su riesgo de sufrir un coágulo sanguíneo después de tomar Hizentra. Asimismo, indique a su médico qué medicamentos está tomando, ya que algunos contienen estrógenos (una hormona que se encuentra, por ejemplo, en las píldoras anticonceptivas) que pueden aumentar su riesgo de desarrollar un coágulo sanguíneo. Póngase inmediatamente en contacto con su médico si experimenta signos y síntomas como dificultad para respirar, dolor en el pecho, dolor e inflamación de una extremidad, debilidad o adormecimiento de un lado del cuerpo después de haber tomado Hizentra.
- Póngase en contacto con su médico si experimenta los siguientes signos y síntomas: dolor de cabeza agudo, rigidez de cuello, somnolencia, fiebre, fotofobia, náuseas y vómitos después de haber tomado Hizentra. Su médico decidirá si es necesario realizar más pruebas y si debe seguir tomando el tratamiento con Hizentra.
Su profesional sanitario evitará posibles complicaciones comprobando que:
- Usted no es sensible a la inmunoglobulina humana normal.
El producto debe inyectarse a una velocidad lenta inicialmente. Debe respetarse estrictamente la velocidad de inyección recomendada en el apartado 3 “Cómo usar Hizentra”.
- Se vigila minuciosamente la presencia de cualquier síntoma durante todo el periodo de
perfusión, especialmente si:
- es la primera vez que recibe inmunoglobulina humana normal
- ha cambiado de tratamiento con otro medicamento
- ha transcurrido un periodo prolongado (más de ocho semanas) desde la última perfusión que recibió.
En estos casos, se le deberá observar durante la primera perfusión y durante una hora después de la misma. Si los puntos arriba mencionados no pueden aplicársele a usted, se recomienda su observación durante al menos 20 minutos después de la administración.
Interacción de Hizentra con otros medicamentos
- Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
- No debe mezclar Hizentra con otros medicamentos.
- Antes de vacunarse, informe a su médico acerca de su tratamiento con Hizentra.
Hizentra puede alterar el efecto de algunas vacunas con virus vivos como la vacuna contra el sarampión, rubeola, parotiditis y varicela. Por tanto, tras la administración de estos medicamentos, deberá esperar por lo menos 3 meses antes de recibir una vacuna viva atenuada. En el caso de la vacuna contra el sarampión, esta alteración puede persistir hasta 1 año.
Embarazo, lactancia y fertilidad
- Si está embarazada o en período de lactancia, o cree que podría estar embarazada o tiene intención de quedarse embarazada, informe a su médico o farmacéutico. Su médico decidirá si puede recibir Hizentra durante el embarazo o mientras esté dando el pecho.
No se han desarrollado estudios con Hizentra en mujeres embarazadas. No obstante, se han utilizado medicamentos que contienen inmunoglobulina en mujeres embarazadas o en periodo de lactancia desde hace años y no se han observado efectos perjudiciales en el curso del embarazo o en el bebé.
Si está dando el pecho y recibe Hizentra, las inmunoglobulinas del medicamento pueden también hallarse en la leche materna. Por tanto, su bebé puede estar protegido ante algunas infecciones.
Conducción y uso de máquinas
Durante el tratamiento con Hizentra, los pacientes pueden experimentar efectos, como mareos o náuseas, que podrían afectar la capacidad para conducir y utilizar máquinas. Si esto sucede, no debe conducir ni usar máquinas hasta que estos efectos hayan desaparecido.
Hizentra contiene prolina
No debe tomar este medicamento si sufre de hiperprolinemia (ver también el apartado 2 “Qué necesita saber antes de empezar a usar Hizentra”). Informe a su médico antes del tratamiento.
Otra información importante sobre Hizentra
Análisis de sangre
Después de recibir Hizentra, los resultados de algunos análisis de sangre (pruebas serológicas) pueden estar alterados durante algún tiempo.
- Antes de realizar cualquier análisis de sangre, informe a su médico acerca de su tratamiento con Hizentra.
Información acerca de los componentes de Hizentra
Hizentra se elabora a partir de plasma de sangre humana (esta es la parte líquida de la sangre). Cuando los medicamentos se fabrican a partir de la sangre o el plasma humano, se ponen en práctica ciertas medidas para evitar la transmisión de infecciones a los pacientes. Estas medidas incluyen:
- una selección meticulosa de los donantes de sangre o plasma para garantizar la exclusión de los posibles portadores de infecciones, y
- el examen de cada donación y de las mezclas de plasmas para comprobar la ausencia de signos de virus o infecciones.
Los fabricantes de estos medicamentos también incluyen pasos en el procesamiento de la sangre o del plasma que pueden desactivar o eliminar los virus. A pesar de estas medidas, al administrar medicamentos preparados a partir de sangre o plasma humano, no se puede excluir completamente la posibilidad de transmitir una infección. Esto también es cierto en el caso de cualquier virus desconocido o que aparezca, o de cualquier otro tipo de infección.
Las medidas adoptadas se consideran eficaces para los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH, el virus del SIDA), el virus de la hepatitis B y el virus de la hepatitis C (inflamación del hígado), y para los virus sin envoltura, como el virus de la hepatitis A y el parvovirus B19.
- Se recomienda encarecidamente que, cada vez que usted reciba una dosis de Hizentra, tome nota del nombre y del número de lote del producto, con el fin de mantener un registro de los lotes usados (ver la sección 3, “Cómo usar Hizentra”).
Hizentra contiene sodio
Este medicamento contiene menos de 23 mg de sodio (1 mmol) por vial/jeringa; esto es, esencialmente “exento de sodio”.
3. Cómo usar Hizentra
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. Consulte a su médico si tiene dudas.
Dosis
Su médico decidirá qué cantidad de Hizentra recibirá usted, en función de su peso y respuesta al tratamiento.
La dosis o el intervalo de administración no se deben cambiar sin consultar a su médico.
Si cree que debe recibir Hizentra de forma más o menos frecuente, por favor, consulte a su médico. Si cree que se le ha olvidado una dosis, hable con su médico lo antes posible.
Terapia sustitutiva
Su médico determinará si usted necesita una dosis de carga (para adultos y niños) de al menos 1 a 2,5 ml/kg de peso corporal dividida en varios días. Después se administrarán dosis de mantenimiento a intervalos repetidos, de una vez al día a una vez cada dos semanas, para alcanzar una dosis mensual acumulada de entre 2 y 4 ml/kg de peso corporal. Su profesional sanitario podría ajustar la dosis basándose en su respuesta al tratamiento.
Terapia inmunomoduladora
Su médico iniciará la terapia con Hizentra una semana después de su última perfusión intravenosa de inmunoglobulina administrándola bajo la piel (por manera subcutánea) con una dosis semanal de 1,0 a 2,0 ml/kg de peso corporal. Su médico determinará su dosis semanal de Hizentra. Las dosis semanales de mantenimiento se pueden dividir en dosis más pequeñas y administrarse con la frecuencia que se requiera durante la semana. Para pautas cada dos semanas, su médico duplicará la dosis semanal de Hizentra. Su profesional de la salud puede ajustar la dosis en función de su respuesta al tratamiento.
Forma y vía de administración
En el caso del tratamiento en casa, este debe iniciarlo un profesional sanitario con experiencia en el tratamiento de la inmunodeficiencia/PDIC con IgSC y en la instrucción de pacientes para el tratamiento en casa.
Se le instruirá y formará en:
- técnicas de perfusión aséptica,
- el mantenimiento de un diario de tratamiento, y
- medidas a tomar en caso de efectos adversos graves.
Punto(s) de perfusión
- Administre Hizentra únicamente por vía subcutánea.
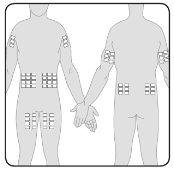
- Puede perfundir Hizentra en puntos tales como el abdomen, el muslo, el brazo y la parte lateral de la cadera. En caso de dosis altas (> 50 ml), administrar en múltiples puntos.
- Puede usar un número ilimitado de puntos de inyección de forma simultánea. Los puntos donde se aplican las inyecciones deben distar al menos 5 cm entre ellos.
- Si usa la técnica de perfusión asistida por dispositivo (por ejemplo, perfusión asistida por bomba), puede usar de forma simultánea más de un dispositivo de perfusión.
- Si usa la técnica de perfusión por empuje manual con una jeringa, puede usar solo un lugar de perfusión por jeringa. Si necesita administrar una jeringa adicional de Hizentra, debe usar una nueva aguja de inyección estéril y cambiar el lugar de perfusión.
- El volumen de producto perfundido en un sitio determinado puede variar.
Velocidad(es) de perfusión
Su médico determinará la técnica de perfusión adecuada y la velocidad de perfusión para usted teniendo en cuenta su dosis individual, frecuencia de dosificación y tolerabilidad del producto.
Perfusión asistida por dispositivo:
La velocidad de perfusión inicial recomendada es de hasta 20 ml/hora por punto. Si es bien tolerada, la velocidad de perfusión se puede aumentar de forma gradual a 35 ml/hora por punto para las dos perfusiones posteriores. A partir de entonces, la velocidad de perfusión se puede aumentar según su tolerabilidad.
Perfusión por empuje manual:
La velocidad de perfusión inicial recomendada es de hasta 0,5 ml/min por punto (30 ml/hora por punto). Si es bien tolerada, la velocidad de perfusión se puede aumentar hasta 2,0 ml/min por punto (120 ml/hora por punto) para perfusiones posteriores. A partir de entonces, la velocidad de perfusión se puede aumentar aún más según su tolerabilidad.
Instrucciones de uso
Siga los siguientes pasos y use una técnica aséptica para administrar Hizentra. | ||
1 | Limpie la superficie Limpie a fondo la mesa u otra superficie plana usando un paño antiséptico. | |
2 | Ensamble los accesorios Coloque Hizentra y el resto de accesorios y equipos necesarios para la perfusión sobre una superficie limpia y plana. | |
3 | Lávase y séquese a fondo las manos | |
4 | Revise los viales Inspeccione visualmente en Hizentra la presencia de partículas en la solución o la decoloración de la solución, así como la fecha de caducidad antes de administrar Hizentra. No utilice soluciones turbias o que contengan partículas. No use soluciones que se hayan congelado. Administre la solución cuando se encuentre a temperatura ambiente o a temperatura corporal. Una vez abierto el vial, use la solución inmediamente. | |
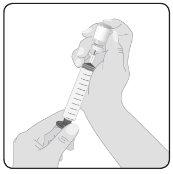
5 | Preparación de Hizentra para perfusión Limpie el tapón del vial– Retire la cápsula protectora del vial y deje al descubierto la porción central del tapón de goma. Limpie el tapón con un paño con alcohol o con un preparado antiséptico y deje que se seque. Transfiera Hizentra a la jeringa para perfusión– Acople el dispositivo de transferencia o la aguja a una jeringa estéril, usando una técnica aséptica. Si utiliza un dispositivo de transferencia (punzón ventilado), siga las instrucciones indicadas por el fabricante del dispositivo. Si utiliza una aguja, eche hacia atrás el émbolo para tomar aire en la jeringa en cantidad similar a la cantidad de Hizentra que se retirará. A continuación, inserte la aguja en el centro del tapón del vial y, evitando la formación de espuma, inyecte el aire en la cámara de aire del vial (no en el líquido). Finalmente, retire el volumen deseado de Hizentra. En caso de que utilice varios viales para conseguir la dosis deseada, repita este paso. |
|
6 | Prepare el conector Acople el conector de administración o el equipo de agujas a la jeringa. Cebe el conector para eliminar el aire restante. | |
7 | Prepare el(los) punto(s) de perfusión Seleccione el(los) punto(s) de perfusión –El número y la localización de los puntos de perfusión dependen del volumen total de la dosis. Cada punto de perfusión debe estar separado por al menos 5 cm. Puede utilizar un número ilimitado de puntos de perfusión de forma simultánea. |
|
Limpie el(los) punto(s) de perfusiónutilizando una preparación cutánea antiséptica. Deje que cada punto se seque antes de proceder. | ||
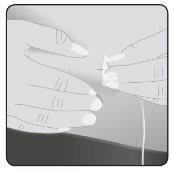
8 | Inserte la aguja Tome la piel entre 2 dedos e inserte la aguja en el tejido subcutáneo. |
|
Asegure la aguja a la piel– En caso necesario, use una gasa y esparadrapo o apósito transparente para asegurar la aguja en su sitio. | ||
9 | Perfunda Hizentra Inicie la perfusión. Si utiliza una bomba de perfusión, siga las instrucciones del fabricante. | |
10 | Registre la perfusión Registre los siguientes datos en su diario de tratamiento:
| |
11 | Limpieza Deseche el producto no utilizado y todos los accesorios de administración utilizados después de la administración de acuerdo con los requisitos locales. |
Si tiene alguna duda acerca del uso de este producto, consulte a su médico, farmacéutico o enfermero.
Si usa más Hizentra del que debe
Informe a su médico a la mayor brevedad si cree que ha recibido demasiado Hizentra.
Si olvidó usar Hizentra
Informe a su médico a la mayor brevedad si cree que ha omitido una dosis.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
- En casos aislados, puede ser alérgico (hipersensible) a las inmunoglobulinas y se pueden producir reacciones alérgicas como un descenso repentino de la tensión arterial o shock (p. ej., se puede sentir aturdido o mareado, sentir mareo al levantarse, tener las manos y los pies fríos, una sensación anómala de latido cardíaco o dolor torácico o tener visión borrosa).
- En casos aislados, puede experimentar dolor y/o hinchazón de un brazo o pierna con calor en la zona afectada, decoloración de un brazo o pierna, falta de aliento inexplicable, dolor torácico o malestar que empeora con la respiración profunda, pulso rápido inexplicable, entumecimiento o debilidad en un lado del cuerpo, confusión repentina o dificultad para hablar o comprender, que podrían ser signos de un coágulo de sangre.
- En casos aislados, puede tener un fuerte dolor de cabeza con náuseas, vómitos, rigidez en el cuello, fiebre y sensibilidad a la luz, que podrían ser signos de SMA (síndrome de meningitis aséptica), que es una inflamación temporal no infecciosa reversible de las membranas que rodean el cerebro y la médula espinal.
- Si nota tales signos durante la perfusión de Hizentra, interrumpa la perfusión y vaya al hospital más cercano de forma inmediata.
Ver también la sección 2 de este prospecto sobre el riesgo de reacciones alérgicas, coágulos de sangre y SMA.
Los efectos adversos observados en los ensayos clínicos controlados se presentan en orden decreciente de frecuencia. Los efectos adversos observados postcomercialización son de frecuencia desconocida:
Los efectos adversos siguientes son muy frecuentes(afectan a más de 1 de cada 10 pacientes):
- Dolor de cabeza
- Erupción
- Reacciones en la zona de perfusión
Los siguientes efectos adversos son frecuentes(afectan a entre 1 y 10, pacientes de cada 100):
- Mareos
- Migraña
- Presión arterial aumentada (hipertensión)
- Diarrea
- Dolor abdominal
- Malestar general (náuseas)
- Vómitos
- Picor (prurito)
- Ronchas (urticaria)
- Dolor relacionado con los músculos y huesos (dolor musculoesquelético)
- Fiebre
- Dolor articular (artralgia)
- Cansancio (fatiga), que incluye indisposición (malestar general)
- Dolor en el pecho
- Síntomas similares a los de la gripe
- Dolor
Los siguientes efectos adversos son poco frecuentes(afectan a entre 1 y 10 pacientes de cada 1.000):
- Hipersensibilidad
- Movimientos de agitación involuntarios en una o más partes del cuerpo (temblores, incluida hiperactividad psicomotora)
- Latido cardiaco rápido (taquicardia)
- Enrojecimiento
- Espasmos musculares
- Debilidad muscular
- Escalofríos, que incluye temperatura corporal baja
- Resultados anómalos de análisis de sangre que pueden indicar alteraciones de las funciones hepática y renal
En casos aislados, puede ocurrir una úlcera en el lugar de perfusión o sensación de ardor.
- Puede reducir posibles efectos adversos si perfunde lentamente Hizentra.
Estos efectos adversos pueden producirse aunque usted haya recibido anteriormente inmunoglobulinas humanas y las haya tolerado bien.
Consulte también la sección 2 "Qué necesita saber antes de empezar a usar Hizentra", donde encontrará información adicional sobre los factores que pueden aumentar el riesgo de sufrir efectos adversos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Hizentra
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en la etiqueta del vial después de EXP.
- Debe utilizar/perfundir este medicamento lo antes posible después de abrir el vial. No utilice Hizentra si el vial está abierto o defectuoso.
- No conservar a temperatura superior a 25 °C.
- No congelar.
- Conservar el vial en el embalaje exterior para protegerlo de la luz.
- No tire los medicamentos por los desagües ni a la basura. Pregunte a su farmacéutico dónde tirar los medicamentos que ya no utiliza. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Hizentra
- El principio activoes la inmunoglobulina humana normal. Un ml contiene 200 mg de inmunoglobulina humana normal, de la cual al menos un 98% es inmunoglobulina de tipo G (IgG).
El porcentaje aproximado de las subclases de IgG es el siguiente:
IgG1 .................................. 69%
IgG2 .................................. 26%
IgG3 .................................. 3%
IgG4 .................................. 2%
Este medicamento contiene trazas de IgA (no más de 50 microgramos/ml).
- Los demás componentes(excipientes) son L-prolina, polisorbato 80 y agua para preparaciones inyectables.
Aspecto de Hizentra y contenido del envase
Hizentra es una solución inyectable subcutánea (200 mg/ml). El color puede variar de amarillo pálido a marrón claro.
Hizentra está disponible en viales de 5, 10, 20 o 50 ml.
Hizentra también está disponible en jeringas precargadas de 5, 10, 20 y 50 ml.
Tamaños de envases
Packs de 1, 10 o 20 viales.
Hizentra también está disponible en envases de 1 (para 5, 10, 20, 50 ml)o 10 (para 5, 10, 20 ml) o 20 (para 10, 20 ml) jeringas precargadas.
Por favor, tenga en cuenta que este envase no contiene toallitas con alcohol, agujas ni otros accesorios o equipos.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
CSL Behring GmbH
Emil-von-Behring-Strasse 76
D-35041 Marburg
Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien CSL Behring NV Tél/Tel: +32 15 28 89 20 | Luxembourg/Luxemburg CSL Behring NV Tél/Tel: +32 15 28 89 20 |
| Magyarország CSL Behring Kft. Tel: +36 1 213 4290 |
Ceská republika CSL Behring s.r.o. Tel: + 420 702 137 233 | Malta AM Mangion Ltd. Tel: +356 2397 6333 |
Danmark CSL Behring AB Tel: +46 8 544 966 70 | Nederland CSL Behring BV Tel: + 31 85 111 96 00 |
Deutschland CSL Behring GmbH Tel: +49 69 30584437 | Norge CSL Behring AB Tlf: +46 8 544 966 70 |
Eesti CentralPharma Communications OÜ Tel: +3726015540 | Österreich CSL Behring GmbH Tel: +43 1 80101 2463 |
Ελλ?δα CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Polska CSL Behring Sp. z o.o. Tel: +48 22 213 22 65 |
España CSL Behring S.A. Tel: +34 933 67 1870 | Portugal CSL Behring Lda Tel: +351 21 782 62 30 |
France CSL Behring SA Tél: + 33 1 53 58 54 00 | România Prisum Healthcare S.R.L. Tel: +40 21 322 01 71 |
Hrvatska Marti Farm d.o.o. Tel: +385 1 5588297 | Slovenija EMMES BIOPHARMA GLOBAL s.r.o. - podružnica v Sloveniji Tel: +386 41 42 0002 |
Ireland CSL Behring GmbH Tel: +49 69 305 17254 | Slovenská republika CSL Behring Slovakia s.r.o. Tel: +421 911 653 862 |
Ísland CSL Behring AB Sími: +46 8 544 966 70 | Suomi/Finland CSL Behring AB Puh/Tel: +46 8 544 966 70 |
Italia CSL Behring S.p.A. Tel: +39 02 34964 200 | Sverige CSL Behring AB Tel: +46 8 544 966 70 |
Κ?προς CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | United Kingdom (Northern Ireland) CSL Behring GmbH Tel: +49 69 30517254 |
Latvija CentralPharma Communications SIA Tel: +371 6 7450497 | |
Lietuva CentralPharma Communications UAB Tel: +370 5 243 0444 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/.
----------------------------------------------------------------------------------------------------------------
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a HIZENTRA 200 MG/ML SOLUCIÓN INYECTABLE SUBCUTÁNEAForma farmacéutica: INYECTABLE, 165 mg/mlPrincipio activo: immunoglobulins, normal human, for extravascular adm.Fabricante: Octapharma S.A.Requiere recetaForma farmacéutica: INYECTABLE, 200 mg/mlPrincipio activo: immunoglobulins, normal human, for extravascular adm.Fabricante: Baxalta Innovations GmbhRequiere recetaForma farmacéutica: INYECTABLE, 200 mg/mlPrincipio activo: immunoglobulins, normal human, for extravascular adm.Fabricante: Csl Behring GmbhRequiere receta
Médicos online para HIZENTRA 200 MG/ML SOLUCIÓN INYECTABLE SUBCUTÁNEA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de HIZENTRA 200 MG/ML SOLUCIÓN INYECTABLE SUBCUTÁNEA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes