GADOVIST 1 mmol/ml SOLUCION INYECTABLE EN JERINGA PRECARGADA/ CARTUCHO PRECARGADO

Cómo usar GADOVIST 1 mmol/ml SOLUCION INYECTABLE EN JERINGA PRECARGADA/ CARTUCHO PRECARGADO
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto:información para el paciente
Gadovist 1 mmol/ml solución inyectable en jeringa precargada/
cartucho precargado
Gadobutrol
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento,porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o a la persona que le administre Gadovist (el radiólogo) o al personal del hospital o centro donde se realice la RM (resonancia magnética).
- Si experimenta efectos adversos, consulte a su médico o radiólogo, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Gadovist y para qué se utiliza
- Qué necesita saber antes de empezar a usar Gadovist
- Cómo usar Gadovist
- Posibles efectos adversos
- Conservación de Gadovist
- Contenido del envase e información adicional
1. Qué es Gadovist y para qué se utiliza
Gadovist es un medio de contraste para resonancia magnética (RM) usado para el diagnóstico del cerebro, columna vertebral y vasos sanguíneos. Gadovist también puede ayudar al médico a averiguar el tipo de anormalidades (benignas o malignas) conocidas o sospechadas en el hígado y riñones.
Gadovist también puede ser utilizado para RM de anormalidades de otras partes del cuerpo. Facilita la visualización de estructuras anormales o lesiones y ayuda en la diferenciación del tejido sano y el tejido enfermo.
Está indicado en adultos y niños de todas las edades (incluyendo neonatos a término).
Cómo funciona Gadovist
La RM es un método de diagnóstico por imagen que utiliza el comportamiento de las moléculas de agua en tejidos normales y anormales. Esto se lleva a cabo mediante un complejo sistema de imanes y ondas de radio. Unos ordenadores registran la actividad y la transforman en imágenes.
Gadovist se administra mediante una inyección en su vena. Este medicamento es únicamente para uso diagnóstico y solo le será administrado por un profesional sanitario con experiencia en la práctica clínica de RM.
2. Qué necesita saber antes de empezar a usar Gadovist
No use Gadovist si usted
- es alérgico al gadobutrol o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Gadovist si usted
- padece o ha padecido una alergia (por ejemplo, fiebre del heno, urticaria) o asma
- ha tenido una reacción previa a cualquier medio de contraste
- tiene la función renal muy deficiente
- padece trastornos cerebrales con convulsiones (ataques) o tiene otras enfermedades del sistema nervioso
- lleva un marcapasos o algún implante o clip que contenga hierro en su cuerpo.
Su médico decidirá si es posible o no el realizarle la exploración prevista.
- Pueden producirse reacciones de tipo alérgico u otros tipos de reacciones que conllevan problemas cardíacos, dificultad al respirar o reacciones cutáneas después del uso de Gadovist. Es posible que aparezcan reacciones graves. La mayoría de estas reacciones ocurren a la media hora tras la administración de Gadovist. Por ello, usted será observado tras el tratamiento. Se han observado reacciones retardadas (después de horas o días) (ver sección 4).
Riñones/Hígado
Informe a su médico si
- sus riñones no funcionan correctamente
- si recientemente se le ha realizado, o pronto se le va a realizar, un trasplante de hígado.
Su médico puede decidir realizarle un análisis de sangre para comprobar el correcto funcionamiento de sus riñones antes de decidir el uso de Gadovist, especialmente si usted tiene 65 años o es mayor.
Neonatosy lactantes
Debido a la inmadurez de la función renal de los neonatos de hasta 4 semanas y lactantes de hasta 1 año de edad, Gadovist sólo debe utilizarse en estos pacientes tras una valoración cuidadosa por el médico.
Otros medicamentos y Gadovist
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
- Embarazo
Gadobutrol puede atravesar la placenta. Se desconoce si afecta al feto. Debe informar a su médico si cree que está embarazada o que pudiera estarlo, ya que Gadovist no debe utilizarse durante el embarazo a menos que se considere absolutamente necesario.
- Lactancia
Informe a su médico si está dando el pecho o está a punto de empezar. Su médico valorará si usted debe continuar o si debe interrumpir la lactancia 24 horas después de la administración de Gadovist.
Gadovist contiene sodio
Este medicamento contiene menos de 23 mg de sodio por dosis (basado en la cantidad media administrada a una persona de 70 kg); esto es, esencialmente "exento de sodio".
3. Cómo usar Gadovist
Gadovist se inyecta por un profesional sanitario mediante una pequeña aguja dentro de una vena. Su exploración de RM puede empezar inmediatamente.
Tras la inyección quedará en observación durante al menos 30 minutos.
Posología habitual
La dosis habitual que es adecuada para usted dependerá de su peso corporal y de la región examinada por RM:
En adultos, se recomienda una única inyección de 0,1 mililitros de Gadovist por kg de peso corporal (esto significa que para una persona que pesa 70 kg la dosis sería de 7 mililitros), sin embargo, se puede administrar una inyección adicional de hasta 0,2 mililitros por kg de peso corporal dentro de los 30 minutos tras la primera inyección. Se puede administrar una cantidad total de 0,3 mililitros de Gadovist por kg de peso corporal como máximo (esto significa que para una persona de 70 kg la dosis sería de 21 mililitros) para la obtención de imágenes del sistema nervioso central (SNC) y la angiografía por resonancia magnética (ARM) con contraste. Puede administrarse una dosis mínima de 0,075 mililitros de Gadovist por kg de peso corporal (esto significa que para una persona de 70 kg la dosis sería de 5,25 mililitros) para el SNC.
Al final del prospecto, se incluye información adicional sobre la administración y manipulación de Gadovist.
Posología en poblaciones especiales
El uso de Gadovist no está recomendado en pacientes con problemas renales graves o en pacientes a los que recientemente se les haya, o pronto se les va a realizar, un trasplante de hígado. Sin embargo, si se requiere el uso, durante una exploración sólo se le debe administrar una dosis de Gadovist y no debe administrársele una segunda inyección hasta que hayan transcurrido al menos 7 días.
Uso enneonatos, lactantes,niños y adolescentes
La dosis recomendada en niños de todas las edades (incluyendo neonatos a término) es de una única inyección de 0,1 mililitros de Gadovist por kilogramo de peso corporal para todas las indicaciones (ver sección 1).
Debido a la inmadurez de la función renal de los neonatos de hasta 4 semanas y lactantes de hasta 1 año de edad, Gadovist sólo debe utilizarse en estos pacientes tras una valoración cuidadosa por el médico. Los neonatos y lactantes sólo deben recibir una dosis de Gadovist durante una exploración y no deben recibir una segunda inyección hasta transcurridos al menos 7 días.
Pacientes de edad avanzada
Si usted tiene 65 años o es mayor no es necesario que se le ajuste la dosis pero podría realizársele un análisis de sangre para comprobar el correcto funcionamiento de sus riñones.
Si usa más Gadovist del que debe
Es improbable que se produzca una sobredosis. Si ocurriera, el médico tratará todos los síntomas y es posible que utilice diálisis para eliminar Gadovist de su cuerpo. No hay evidencia que indique que la hemodiálisis es adecuada para la prevención del desarrollo de fibrosis nefrogénica sistémica (FNS; ver sección 4) por lo que no debe ser utilizada para el tratamiento de esta enfermedad. En algunos casos su corazón será controlado.
En caso de sobredosis o ingestión accidental, consulte al Servicio de Información Toxicológica (teléfono 91 562 04 20).
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o radiólogo.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. La mayoría de estas reacciones se producen en la media hora siguiente a la administración de Gadovist. Se han observado en casos raros reacciones de tipo alérgico retardadas o de otro tipo, desde unas horas a varios días tras haber recibido Gadovist. Si esto le sucediera a usted, informe inmediatamente a su médico o radiólogo.
Los efectos adversos más graves(que han sido fatales o que han puesto en peligro la vida en algunos casos) son:
- parada del latido del corazón (parada cardíaca) una enfermedad pulmonar grave (síndrome de dificultad respiratoria aguda)/ líquido en los pulmones (edema pulmonar)y reacciones alérgicas graves (anafilactoides) (incluyendo parada respiratoria y shock).
Adicionalmente, en algunos casos se han observado los siguientes efectos adversos que han puesto en peligro la vida o han sido fatales:
- falta de respiración (disnea), pérdida de conciencia, reacciones alérgicas graves, disminución grave de la tensión que puede conducir a colapso, parada respiratoria, líquido en los pulmones, inflamación de la boca y garganta y tensión baja.
En raroscasos:
- pueden ocurrir reacciones de tipo alérgico(hipersensibilidad y anafilaxis), incluyendo reacciones graves (shock) que pueden requerir intervención médica inmediata.
Si usted nota:
- inflamación de la cara, labios, lengua o garganta
- tos y estornudos
- dificultad para respirar
- picor
- congestión nasal
- urticaria (sarpullido como el que causa la ortiga)
informe inmediatamente al personal del departamento de RM.Éstos pueden ser los primeros indicios de que está ocurriendo una reacción grave. Su exploración puede ser suspendida y usted puede necesitar tratamiento posterior.
Los efectos adversos observados con mayor frecuencia(pueden afectar a 5 o más de cada 1.000 personas) son:
- cefaleas, sensación de malestar (náuseas) y mareo.
La mayoría de efectos adversos son de leves a moderados.
A continuación se enumeran posibles efectos adversosque han sido observados en ensayos clínicosantes de la aprobación de Gadovist según su probabilidad:
Frecuentes:pueden afectar hasta a 1 de cada 10 personas
- dolor de cabeza
- sensación de malestar (náuseas)
Poco frecuentes:pueden afectar hasta a 1 de cada 100 personas
- reacción de tipo alérgico, por ejemplo:
- tensión baja
- urticaria
- inflamación de la cara
- inflamación (edema) de los párpados
- rubor
La frecuencia de las siguientes reacciones alérgicas es no conocida:
- una reacción alérgica grave (shock anafilactoide)
- disminución grave de la tensión que puede conducir a colapso (shock)
- parada respiratoria
- dificultad al respirar (broncoespasmo)
- labios azulados
- inflamación de la boca y de la garganta
- inflamación de la garganta
- aumento de la tensión
- dolor en el pecho
- inflamación de la cara, garganta, boca, labios y/o lengua (angioedema)
- conjuntivitis
- aumento de la sudoración
- tos
- estornudos
- quemazón
- palidez (piel pálida)
- mareo, alteración del gusto, entumecimiento y hormigueo
- falta de respiración (disnea)
- vómito
- rojez en la piel (eritema)
- picor (prurito incluido prurito generalizado)
- erupción (incluido erupción generalizada, pequeñas manchas rojas planas (erupción macular), lesiones pequeñas elevadas circunscritas (erupción papular), erupción con picor (erupción prurítica))
- diferentes tipos de reacciones en el lugar de inyección (por ejemplo derrame en el tejido adyacente, quemazón, frío, calor, enrojecimiento, erupción, dolor o hematoma)
- sensación de calor
Raros:pueden afectar hasta a 1 de cada 1.000 personas
- desmayo
- convulsión
- alteración del olfato
- latido rápido del corazón
- palpitaciones
- sequedad de boca
- malestar general
- sensación de frío
Efectos adversos adicionales que han sido comunicados tras la aprobación de Gadovist de frecuencia desconocida(la frecuencia no puede ser estimada a partir de los datos disponibles):
- parada del latido del corazón (parada cardíaca)
- Una enfermedad pulmonar grave (síndrome de dificultad respiratoria aguda)
- Líquido en los pulmones (edema pulmonar)
- se han notificado casos de fibrosis nefrogénica sistémica – FNS (que provoca un endurecimiento de la piel y puede afectar también a los tejidos blandos y a los órganos internos).
Tras la administración de Gadovist, se han observado variaciones en los resultados de análisis de la función renal (por ejemplo, aumentos de la creatinina en suero).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o radiólogo, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Gadovist
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y el envase después de CAD. La fecha de caducidad es el último día del mes que se indica. Este medicamento no requiere condiciones especiales de conservación.
Se ha demostrado la estabilidad química, física y microbiológica en el uso durante un plazo de 24 horas a 20-25ºC. Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente tras su apertura.
Este medicamento es una solución clara, de incolora a amarillo pálido. No utilice este medicamento si observa una alteración severa del color, o la presencia de partículas o el envase aparece defectuoso.
Los medicamentos no se deben tirar por los desagües ni a la basura. El profesional sanitario se deshará de este medicamento cuando no se necesite. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Gadovist
El principio activo es gadobutrol.
1 ml de solución inyectable contiene 604,72 mg de gadobutrol (equivalente a 1 mmol de gadobutrol que contiene 157,25 mg de gadolinio).
1 jeringa precargada con 5,0 ml contiene 3.023,6 mg de gadobutrol.
1 jeringa precargada con 7,5 ml contiene 4.535,4 mg de gadobutrol.
1 jeringa precargada con 10 ml contiene 6.047,2 mg de gadobutrol.
1 jeringa precargada con 15 ml contiene 9.070,8 mg de gadobutrol.
1 jeringa precargada con 20 ml contiene 12.094,4 mg de gadobutrol.
1 cartucho precargado con 15 ml contiene 9.070,8 mg de gadobutrol.
1 cartucho precargado con 20 ml contiene 12.094,4 mg de gadobutrol.
1 cartucho precargado con 30 ml contiene 18.141,6 mg de gadobutrol.
Los demás componentes son calcobutrol de sodio (ver final sección 2), trometamol, ácido clorhídrico 1N y agua para preparaciones inyectable.
Aspecto del producto y contenido del envase
Gadovist es una solución inyectable transparente, de incolora a amarillo pálido.
El contenido de los envases es:
-1 o 5 jeringas precargadas que contienen 5, 7,5 y 10 ml de solución inyectable (en una jeringa de 10 ml de vidrio o plástico).
-1 o 5 jeringas precargadas que contienen 15 ml de solución inyectable (en una jeringa de 17 ml de vidrio o en una jeringa de 20 ml de plástico).
-1 o 5 jeringas precargadas que contienen 20 ml de solución inyectable (en una jeringa de 20 ml de vidrio o plástico).
-1 o 5 cartuchos precargados que contienen 15, 20 y 30 ml de solución inyectable (en un cartucho de 65 ml).
Envases clínicos:
- 5 jeringas precargadas que contienen 5, 7,5, 10, 15, 20 ml de solución inyectable
- 5 cartuchos precargados que contienen 15, 20, 30 ml de solución inyectable
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Bayer Hispania, S.L.
Av. Baix Llobregat, 3-5
08970 Sant Joan Despí (Barcelona)
España
Responsable de la fabricación
Bayer AG
Müllerstrasse 178
13353 Berlín
Alemania
Este medicamento está autorizado en los estados miembros delEspacio Económico Europeocon los siguientes nombres:
Austria, Alemania | Gadovist 1,0 mmol/ml Injektionslösung in Fertigspritzen/Patronen |
Bélgica, Bulgaria, Chipre, Dinamarca, Estonia, Finlandia, Grecia, Italia, Luxemburgo, Noruega, Portugal, Suecia | Gadovist |
Croacia | Gadovist 1,0 mmol/ml otopina za injekciju u napunjenoj štrcaljki/ulošku. |
Francia | GADOVIST 1,0 mmol/ml, solution injectable en seringue préremplie |
Islandia | Gadovist 1,0 mmól/ml stungulyf, lausn í áfylltum sprautum/rörlykjum |
Irlanda | Gadovist 1.0 mmol/ml solution for Injection in prefilled syringe Gadovist 1.0 mmol/ml solution for Injection in prefilled cartridge |
Holanda | Gadovist 1,0 mmol/ml, oplossing voor injectie in voorgevulde spuit/patroon |
Eslovenia | Gadovist 1,0 mmol/ml raztopina za injiciranje v napolnjeni injekcijski brizgi/vložku |
Eslovaquia | Gadovist 1,0 mmol/ ml |
España | Gadovist 1 mmol/ml solución inyectable en jeringa precargada/ cartucho precargado |
Malta | Gadovist 1.0 mmol/ml solution for injection pre-filled syringe/cartridge |
Fecha de la última revisión de este prospecto:09/2024.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es)
-----------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario:
- Insuficiencia renal
Antes de la administración de Gadovist se recomienda evaluar a todos los pacientes para detectar una posible disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis nefrogénica sistémica (FNS) asociados a la utilización de algunos agentes de contraste de gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG o tasa de filtración glomerular < 30ml/minuto/1,73m2). Los pacientes sometidos a trasplante hepático tienen un riesgo especial ya que la incidencia de un fallo renal es elevada en este grupo. Puesto que existe la posibilidad de que pueda ocurrir una FNS con Gadovist, éste solo debe utilizarse en pacientes con insuficiencia renal grave y en pacientes en el periodo perioperatorio de un trasplante hepático tras una evaluación cuidadosa del riesgo/beneficio y si la información diagnóstica es imprescindible y no puede estar disponible mediante resonancia magnética sin contraste. Si es necesario el uso de Gadovist, la dosis no debe exceder 0,1 mmol/kg de peso corporal. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, la administración de Gadovist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días.
Dado que la eliminación renal de Gadovist puede estar reducida en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de 65 años y mayores para detectar una posible disfunción renal.
La hemodiálisis poco después de la administración de Gadovist puede resultar útil para la eliminación corporal de Gadovist. No hay evidencia que apoye el inicio de la hemodiálisis para la prevención o tratamiento de la FNS en pacientes que todavía no están sometidos a hemodiálisis.
- Embarazo y Lactancia
No debe utilizarse Gadovist durante el embarazo a no ser que la situación clínica de la mujer requiera tratamiento con Gadovist.
La continuación o la interrupción de la lactancia 24 horas después de la administración de Gadovist, quedará a discreción del médico y de la madre en período de lactancia.
- Reacciones de hipersensibilidad
Como ocurre con otros medios de contraste intravenosos, Gadovist puede asociarse a reacciones de hipersensibilidad/anafilactoides o a otras reacciones idiosincrásicas caracterizadas por manifestaciones cardiovasculares, respiratorias o cutáneas, que abarcan hasta reacciones graves incluyendo shock. En general, pacientes con enfermedades cardiovasculares son más susceptibles a consecuencias graves o incluso fatales por reacciones de hipersensibilidad graves.
El riesgo de reacciones de hipersensibilidad puede ser mayor en los siguientes casos:
- reacción previa a medios de contraste
- antecedentes de asma bronquial
- antecedentes de trastornos alérgicos
En pacientes con predisposición alérgica, la decisión de utilizar Gadovist debe realizarse tras una evaluación cuidadosa de la relación beneficio-riesgo.
La mayoría de estas reacciones ocurren a la media hora tras la administración. Por ello, se recomienda la observación del paciente tras el tratamiento.
Es necesario disponer de la medicación adecuada para el tratamiento de las reacciones de hipersensibilidad, así como preparar la aplicación de medidas de emergencia.
En raras ocasiones se han observado reacciones retardadas (tras horas o varios días).
- Trastornos convulsivos
Al igual que con otros medios de contraste que contienen gadolinio, debe tomarse especial precaución en los pacientes con un umbral convulsivo bajo.
- Sobredosis
En caso de una sobredosis involuntaria, se recomienda la monitorización cardiovascular (incluyendo el ECG) y la vigilancia de la función renal como medidas de precaución.
En el caso de sobredosis en pacientes con insuficiencia renal, Gadovist puede eliminarse mediante hemodiálisis. Tras 3 sesiones de hemodiálisis se elimina del cuerpo aproximadamente un 98% del agente de contraste. Sin embargo, no hay evidencia de que la hemodiálisis sea adecuada para la prevención de fibrosis nefrogénica sistémica (FNS).
- Antes de la inyección
Este medicamento está indicado para un solo uso.
Este medicamento es una solución transparente, de incolora a amarillo pálido. La solución debe inspeccionarse visualmente antes de ser utilizada.
Gadovist no debe utilizarse en caso de presentar alteraciones significativas del color, de aparición de partículas o en caso de que el envase esté defectuoso.
- Instrucciones de uso
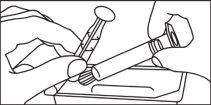
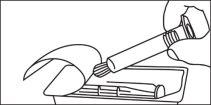
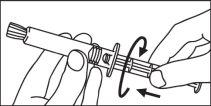
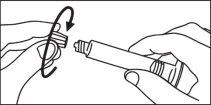
Jeringas precargadas
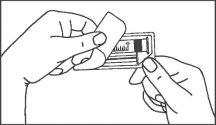
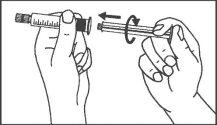
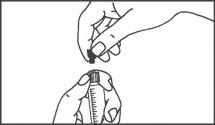
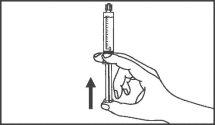
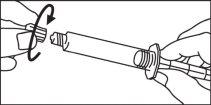
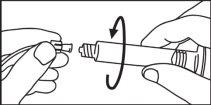
La jeringa precargada debe extraerse del envase y prepararse para la inyección inmediatamente antes de la administración.
El extremo del tapón debe ser retirado de la jeringa precargada inmediatamente antes del uso.
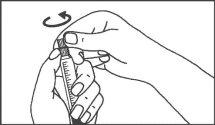
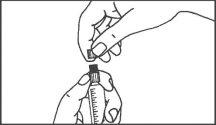
Jeringa de vidrio:
INYECCIÓN MANUAL | ||
|
| |
|
| |
|
| |
|
| |
|
| |
|
|
Jeringa de plástico:
INYECCIÓN MANUAL | INYECCIÓN CON INYECTOR | |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
| |
|
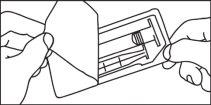
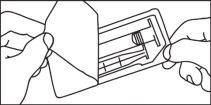
Cartuchos precargados
La administración de medios de contraste debe ser realizada por personal cualificado mediante los procedimientos y equipos adecuados.
La administración de medios de contraste debe realizarse mediante una técnica estéril.
El medio de contraste deberá administrarse mediante un inyector del tipo MEDRAD Spectris®.
Han de seguirse las instrucciones suministradas por los fabricantes de los dispositivos utilizados.
Cualquier medio de contraste no empleado en una exploración debe desecharse de acuerdo a las normas locales.
Período de validez tras la primera apertura del envase
Cualquier solución para inyección que no haya sido utilizada en una exploración ha de ser desechada. Se ha demostrado la estabilidad química, física y microbiológica en el uso durante 24 horas a 20-25ºC. Desde un punto de vista microbiológico, el producto debe ser utilizado inmediatamente. Si no es utilizado de manera inmediata, los tiempos de almacenamiento durante el uso y las condiciones previas a la utilización son responsabilidad del usuario.
La etiqueta separable de las jeringas precargadas/cartuchos precargados debe pegarse en la historia del paciente a fin de permitir un registro preciso del medio de contraste de gadolinio utilizado. También debería registrarse la dosis utilizada. En el caso que se utilicen registros electrónicos de pacientes, deben introducirse en los mismos el nombre del producto, el número de lote y la dosis administrada.
Posología
Debe utilizarse la dosis más baja que proporcione realce suficiente para fines diagnósticos. La dosis debe calcularse en función del peso corporal del paciente y no debe superar la dosis recomendada por kilogramo de peso corporal indicada en esta sección.
- Adultos
Indicaciones en el SNC
La dosis recomendada en adultos es de 0,1 mmol por kilogramo de peso corporal (mmol/kg p.c.), equivalente a 0,1 ml/kg p.c. de la solución 1,0 M.
Si persiste una sospecha clínica fundada de la existencia de una lesión a pesar de una RM sin hallazgos patológicos o cuando la obtención de una información más precisa pueda influir sobre el tratamiento del paciente, puede administrarse una dosis adicional de hasta 0,2 ml/kg p.c. durante los 30 minutos siguientes a la primera inyección. Se puede administrar una dosis de 0,075 mmol de gadobutrol por kg de peso corporal (equivalente a 0,075 ml de Gadovist por kg de peso corporal) como mínimo para la obtención de imágenes del SNC.
RM de cuerpo entero (excepto ARM)
En general, la administración de 0,1 ml de Gadovist por kg de peso corporal es suficiente para responder a la pregunta clínica.
Angiografía por Resonancia Magnética (ARM) con contraste
Obtención de imágenes de 1 campo de visión (FOV): 7,5 ml para pesos corporales inferiores a 75 kg; 10 ml para pesos corporales iguales o superiores a 75 kg (equivalente a 0,1-0,15 mmol/kg p.c.).
Obtención de imágenes de más de 1 campo de visión (FOV): 15 ml para pesos corporales inferiores a 75 kg; 20 ml para pesos corporales iguales o superiores a 75 kg (equivalente a 0,2-0,3 mmol/kg p.c.).
- Población pediátrica
La dosis recomendada en niños de todas las edades (incluyendo neonatos a término) es de 0,1 mmol de gadobutrol por kilogramo de peso corporal (equivalente a 0,1 ml de Gadovist por kilogramo de peso corporal) para todas las indicaciones (ver sección 1).
Debido a la inmadurez de la función renal de los neonatos de hasta 4 semanas y lactantes de hasta 1 año de edad, Gadovist sólo debe utilizarse en estos pacientes tras una valoración cuidadosa a una dosis no superior a 0,1 mmol/kg de peso corporal. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, la administración de Gadovist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días.
Imágenes
La dosis requerida se administra por vía intravenosa como inyección en bolo. La RM con contraste puede comenzar inmediatamente después (poco después de la inyección, dependiendo de las secuencias de pulsos empleadas y del protocolo de estudio).
Se observa un realce óptimo de la señal durante el primer paso arterial para la ARM con contraste y durante un periodo de aproximadamente 15 minutos tras la inyección de Gadovist para las indicaciones del sistema nervioso central (SNC) (el momento depende del tipo de lesión/tejido).
Las secuencias de imagen ponderadas en T1 son especialmente adecuadas para las exploraciones con contraste.
Se proporciona información adicional respecto a la utilización de Gadovist en la sección 3 del prospecto.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a GADOVIST 1 mmol/ml SOLUCION INYECTABLE EN JERINGA PRECARGADA/ CARTUCHO PRECARGADOForma farmacéutica: INYECTABLE, 604.72 mg gadobutrol/mlPrincipio activo: GadobutrolFabricante: Bayer Hispania S.L.Requiere recetaForma farmacéutica: INYECTABLE, 1,0 mmol/mlPrincipio activo: GadobutrolFabricante: Ge Healthcare Bio-Sciences, S.A.U.Requiere recetaForma farmacéutica: INYECTABLE, 1,0 mmol/mlPrincipio activo: GadobutrolFabricante: Ge Healthcare Bio-Sciences, S.A.U.Requiere receta
Médicos online para GADOVIST 1 mmol/ml SOLUCION INYECTABLE EN JERINGA PRECARGADA/ CARTUCHO PRECARGADO
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de GADOVIST 1 mmol/ml SOLUCION INYECTABLE EN JERINGA PRECARGADA/ CARTUCHO PRECARGADO, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes