
FANHDI 100 UI FVIII/120 UI FVW POR ml POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar FANHDI 100 UI FVIII/120 UI FVW POR ml POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Fanhdi 25 UI FVIII/30 UI FVW por ml, polvo y disolvente para solución inyectable
Fanhdi 50 UI FVIII/60 UI FVWpor ml, polvo y disolvente para solución inyectable
Fanhdi 100 UI FVIII/120 UI FVWpor ml, polvo y disolvente para solución inyectable
complejo de factor VIII de coagulación y factor von Willebrand humanos
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Fanhdi y para qué se utiliza
- Qué necesita saber antes de empezar a usar Fanhdi
- Cómo usar Fanhdi
- Posibles efectos adversos
- Conservación de Fanhdi
- Contenido del envase e información adicional
1. Qué es Fanhdi y para qué se utiliza
Fanhdi pertenece al grupo de medicamentos denominado antihemorrágicos: factores de la coagulación sanguínea: factor von Willebrand y factor VIII de coagulación sanguínea en combinación.
Este medicamento se utiliza para:
Hemofilia A
Fanhdi está indicado para el tratamiento y profilaxis (prevención) de hemorragias en pacientes con hemofilia A (déficit congénito de factor VIII). Estos pacientes no tienen suficiente factor VIII funcional. Fanhdi sirve para aumentar la cantidad de factor VIII en sangre, permitiendo así que la sangre coagule.
Este producto puede ser útil en el manejo de deficiencia adquirida de factor VIII.
Enfermedad de von Willebrand
Fanhdi está indicado para el tratamiento de hemorragias y tratamiento y profilaxis de sangrado quirúrgico en pacientes con la enfermedad de von Willebrand (EVW) cuando el tratamiento solo con desmopresina (DDAVP) no es efectivo o está contraindicado.
Los pacientes pueden padecer diferentes tipos de EVW. Todos los tipos de EVW son enfermedades innatas donde las hemorragias pueden durar más de lo esperado. Esto puede ser debido a una falta de FVW en la sangre o a que el FVW no funciona como debería.
2. Qué necesita saber antes de empezar a usar Fanhdi
No use Fanhdi
Si es alérgico al complejo de factor VIII de coagulación y factor von Willebrand humanos o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Si usted tiene alguna duda sobre lo anterior, consulte con su médico.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Fanhdi.
- Existe la remota posibilidad de que usted pueda experimentar una reacción anafiláctica (reacción alérgica repentina grave). Si usted observa erupciones cutáneas o urticaria generalizada, siente opresión en el pecho, sensación de mareo, vértigo o náusea, o bien se marea estando de pie, es posible que usted esté sufriendo una reacción anafiláctica a Fanhdi. Si ello ocurre, interrumpa inmediatamente la administración del producto y pida asistencia médica.
- Es posible que su médico desee realizar alguna prueba para asegurar que la dosis que usted recibe de Fanhdi es suficiente para alcanzar y mantener niveles adecuados de factor VIII.
La formación de inhibidores (anticuerpos) es una complicación conocida que puede producirse durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, especialmente en grandes cantidades, impiden que el tratamiento funcione correctamente, por lo que se les supervisará cuidadosamente a usted y a su hijo por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se está controlando con Fanhdi, consulte a su medico inmediatamente.
- Si usted ha desarrollado inhibidores del factor VIII previamente y ha cambiado de un producto de factor VIII a otro, es posible que vuelva a desarrollar inhibidores.
- En el caso del tratamiento de la enfermedad de von Willebrand existe riesgo de aparición de efectos trombóticos, particularmente en pacientes con riesgos clínicos. Así pues, su médico deberá realizar algunas pruebas para detectar signos iniciales de trombosis e iniciar tratamiento contra tromboembolismo vascular según recomendaciones vigentes.
- Los pacientes con enfermedad de von Willebrand, especialmente aquellos pacientes con el tipo 3, pueden desarrollar anticuerpos neutralizantes (inhibidores) al factor von Willebrand. Los inhibidores del factor von Willebrand son anticuerpos presentes en la sangre que bloquean el factor von Willebrand que está usted utilizando. Si no se alcanzan los niveles esperados de actividad de factor von Willebrand en plasma, o si la hemorragia no se controla con la dosis apropiada, su médico deberá realizar pruebas para determinar la presencia de inhibidor de factor von Willebrand. Ello hace que el factor von Willebrand sea menos efectivo en el control del sangrado.
- Si usted va a necesitar un dispositivo de acceso venoso central (DVAC) para la administración de Fanhdi, su médico debe considerar el riesgo de complicaciones relacionadas con el DVAC incluyendo infecciones locales, presencia de bacterias en la sangre (bacteriemia) y la formación de un coágulo en el vaso sanguíneo (trombosis) donde se inserta el catéter.
- Cuando los medicamentos se elaboran a partir de sangre o plasma humano, se deben adoptar un número de medidas para prevenir una posible transmisión de infecciones a los pacientes. Estas medidas incluyen una selección cuidadosa de los donantes de sangre y plasma para garantizar la exclusión de donantes con riesgo de padecer infecciones, el análisis de cada donación y de las mezclas de plasma para detectar posibles virus o infecciones y la inclusión de una serie de etapas en el procesamiento de la sangre o el plasma que pueden inactivar o eliminar los virus.
A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humano, no se puede excluir totalmente la posibilidad de transmisión de infecciones. Esto es aplicable también a los virus desconocidos o emergentes y a otros tipos de infecciones.
Las medidas adoptadas se consideran eficaces para los virus envueltos como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C, y para el virus no envuelto de la hepatitis A. Las medidas tomadas pueden tener un valor limitado para virus no envueltos tales como el parvovirus B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para personas cuyo sistema inmunológico está deprimido o que presentan algún tipo de anemia (p.ej. con anemia drepanocítica o anemia hemolítica).
Su médico puede recomendarle que considere la vacunación contra hepatitis A y B si recibe regularmente/repetidamente concentrados de factor VIII derivados de plasma humano.
Cada vez que se le administre una dosis de Fanhdi, se recomienda dejar constancia del nombre y el número de lote del medicamento para mantener un registro de los lotes utilizados.
Ver también apartado 4.
Niños y adolescentes
Las advertencias y precauciones indicadas se aplican tanto a adultos como a niños.
Uso de Fanhdi con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
No se han observado interacciones del complejo de factor VIII de coagulación y factor von Willebrand humanos con otros medicamentos.
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Durante el embarazo y la lactancia puede utilizarse el complejo de FVIII/FVW únicamente si está claramente indicado.
Conducción y uso de máquinas
No existe ningún indicio de que Fanhdi pueda afectar a la capacidad de conducir vehículos o utilizar máquinas.
Contenido en sodio
El contenido residual de sodio en Fanhdi, procedente del proceso de fabricación, no supera los 23 mg por vial en las presentaciones de 250, 500 y 1000 UI, y 34,5 mg por vial en la presentación de 1500 UI. Esto es equivalente al 1,15% y 1,72% respectivamente de la máxima cantidad diaria de sodio recomendada para un adulto. No obstante dependiendo del peso del paciente y la posología, el paciente puede recibir más de un vial.
3. Cómo usar Fanhdi
El producto debe administrarse por vía intravenosa. La velocidad de administración no debe sobrepasar los 10 ml/min.
Siga exactamente las instrucciones de administración indicadas por su médico o por el personal sanitario del centro de hemofilia. Si tiene alguna duda, consulte a su médico o farmacéutico.
La cantidad de Fanhdi que usted debe usar depende de muchos factores, como su peso, su estado clínico y el lugar e importancia del sangrado. Su médico calculará la dosis de Fanhdi y con qué frecuencia y a qué intervalos debe administrarse para alcanzar el nivel necesario de factor VIII o de factor von Willebrand en su sangre.
Su médico le indicará la duración de su tratamiento con Fanhdi.
Preparación de la solución:
Asegúrese de que trabaja en las condiciones más adecuadas en todas las etapas del proceso para evitar la contaminación del producto.
- Atemperar el vial y la jeringa del disolvente sin sobrepasar los 30 ºC.
- Acoplar el émbolo a la jeringa del disolvente.
- Desprecintar el filtro. Separar el tapón del cono de la jeringa del disolvente y acoplarla al filtro.
- Desprecintar el adaptador de vial y acoplarlo al conjunto filtro-jeringa.
- Desprecintar el vial, desinfectando el tapón con una de las toallitas con alcohol.
- Introducir la espina del adaptador en el vial.
- Trasvasar todo el disolvente de la jeringa al vial.
- Girar suavemente el vial procurando no producir espuma hasta la total disolución. No agitar. Como todos los productos de administración parenteral, no utilizar si la disolución es incompleta o presenta partículas.
- Separar el conjunto filtro-jeringa del resto para facilitar la aspiración posterior de la solución y acoplar inmediatamente de nuevo el conjunto filtro-jeringa al vial.
- Invertir el vial y aspirar el contenido en la jeringa.
Administración
Preparar la zona de inyección del paciente, separar la jeringa del resto e inyectar el producto utilizando la aguja mariposa suministrada a una velocidad de 3 ml/min por vía intravenosa. La velocidad de administración no debe sobrepasar los 10 ml/min para evitar reacciones vasomotoras.
Se recomienda utilizar el equipo para inyección suministrado con el medicamento. En el caso de que se utilicen equipos médicos de perfusión, comprobar la compatibilidad del sistema con la jeringa precargada. Puede requerirse la utilización de un adaptador para asegurar una administración del producto adecuada.
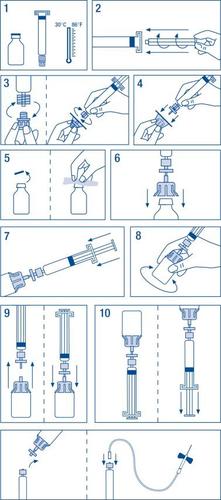
No deben reutilizarse los equipos de administración. En ningún caso se aprovechará la fracción que no se haya utilizado, ni guardándola en nevera.
Si usa más Fanhdi del que debiera
No se han comunicado casos de sobredosificación con complejo de factor VIII de coagulación y factor von Willebrand humanos. Sin embargo, si usted ha usado Fanhdi más de lo que debe, consulte inmediatamente a su médico o farmacéutico.
En caso de sobredosis o administración accidental, consultar al Servicio de Información Toxicológica. Teléfono 91 562 04 20.
Si olvidó usar Fanhdi
- Proceda inmediatamente con la siguiente administración y continúe a intervalos regulares siguiendo las indicaciones de su médico.
- No se administre una dosis doble para compensar las dosis olvidadas.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
En raros casos, usted puede notar alguno de estos efectos adversos después de la administración de Fanhdi:
- Prurito, reacciones locales en el lugar de la inyección (p.ej. sensación de quemazón u hormigueo y enrojecimiento transitorio)
- Reacciones alérgicas (p.ej. opresión en el pecho/sensación general de malestar, dificultad al respirar, mareo, náusea y ligera bajada de tensión que puede hacer que usted se maree estando de pie)
- Sabor peculiar en la boca
- Fiebre
- Taquicardia
- Inquietud
- Dolor de cabeza
- Somnolencia
- Vómitos
- Escalofríos
Tampoco puede excluirse completamente la posibilidad de un shock anafiláctico. Si usted nota cualquiera de los síntomas siguientes durante la administración:
- Opresión en el pecho/sensación general de malestar
- Mareo
- Hipotensión leve (ligera disminución de la presión arterial con sensación de mareo estando de pie)
- Náusea
puede ser un signo precoz de hipersensibilidad y reacción anafiláctica. Si se produce una reacción alérgica o anafiláctica, la administración debe interrumpirse y consultar a su médico inmediatamente.
Hemofilia A
En los niños que no han recibido tratamiento previo con medicamentos compuestos por factor VIII pueden producirse anticuerpos inhibidores (ver sección 2) muy frequentemente (más de 1 por cada 10 pacientes); sin embargo, en los pacientes que han recibido tratamiento previo con factor VIII (mas de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 cada 100 pacientes). Si esto sucede, los medicamentos que toman usted o su hijo pueden dejar de funcionar correctamente y usted o su hijo pueden sufrir una hemorragia persistente. En ese caso, contacte con su médico inmediatamente.
Enfermedad de von Willebrand
Cuando se usa un producto FVW que contiene FVIII para tratar la EVW, el tratamiento continuado puede producir un aumento excesivo de FVIII en la sangre. Esto puede incrementar el riesgo de que su flujo sanguíneo se altere (trombosis).
Si usted es un paciente con factores de riesgo conocidos clínicos o de laboratorio, le tienen que controlar los primeros signos de trombosis. Su médico debe establecer una prevención (profilaxis) de los episodios trombóticos, conforme a las recomendaciones actuales.
Especialmente si es usted un paciente con enfermedad de von Willebrand de tipo 3, en muy raras ocasiones, puede desarrollar anticuerpos neutralizantes (inhibidores) al factor von Willebrand. Si dichos inhibidores aparecen el factor von Willebrand es menos efectivo en el control del sangrado. En el caso de que su hemorragia continúe, hay que analizar la presencia de estos inhibidores en su sangre. Dichos anticuerpos pueden aparecer asociados a reacciones anafilácticas. Así pues, en aquellos pacientes que experimenten reacciones anafilácticas deberá evaluarse la presencia de inhibidores. En tales casos, consulte a su médico inmediatamente.
Para información sobre la seguridad viral, ver sección 2.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fanhdi
Mantener este medicamento fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30 ºC. No congelar.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD”.
No utilice este medicamento si observa que la solución presenta turbidez o sedimentos. Generalmente la solución es clara o ligeramente opalescente.
Una vez reconstituida, la solución debe desecharse si se observan partículas en su interior o algún tipo de decoloración.
Tras la reconstitución el producto es estable química y físicamente durante 12 horas a 25 ºC. Desde un punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, el tiempo y las condiciones de conservación antes de su uso son responsabilidad del usuario y, normalmente no serán más de 24 horas a 2 ºC - 8 ºC a menos que la reconstitución se haya realizado en condiciones asépticas controladas y validadas.
Todo producto no utilizado y el material de desecho deben eliminarse de acuerdo con los requisitos locales.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Fanhdi
- El principio activo es el complejo de factor VIII de coagulación y factor von Willebrand humanos. Una vez reconstituido Fanhdi contiene 25 UI FVIII/30 UI FVW por ml, 50 UI FVIII/60 UI FVW por ml o 100 UI FVIII/120 UI FVW por ml. Ver abajo “Presentaciones de Fanhdi”.
- Los demás componentes son albúmina, histidina y arginina.
Aspecto del producto y contenido del envase
Vial conteniendo polvo blanco o amarillo pálido y jeringa con agua para preparaciones inyectables (disolvente).
Contenido de la caja: 1 vial de liofilizado, 1 jeringa precargada de disolvente y accesorios (adaptador de vial, filtro, 2 toallitas con alcohol y aguja mariposa).
Presentaciones de Fanhdi
Fanhdi 25 UI FVIII/30 UI FVW por ml
Se presenta como polvo para solución inyectable conteniendo 250 UI de FVIII de coagulación humano y 300 UI de FVW humano por vial que se reconstituye con 10 ml de agua para inyectables.
Fanhdi 50 UI FVIII/60 UI FVW por ml
Se presenta como polvo para solución inyectable conteniendo 500 UI de FVIII de coagulación humano y 600 UI de FVW humano por vial que se reconstituye con 10 ml de agua para inyectables.
Fanhdi 100 UI FVIII/120 UI FVW por ml
Se presenta como polvo para solución inyectable conteniendo 1000 UI de FVIII de coagulación humano y 1200 UI de FVW humano por vial que se reconstituye con 10 ml de agua para inyectables.
O
Se presenta como polvo para solución inyectable conteniendo 1500 UI de FVIII de coagulación humano y 1800 UI de FVW humano por vial que se reconstituye con 15 ml de agua para inyectables.
Titular de la autorización de comercialización y responsable de la fabricación
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona – ESPAÑA
Fecha de la última revisión de este prospecto:
Diciembre 2020.
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es//
……………………………………………………………………………………………………………
Esta información está destinada únicamente a profesionales del sector sanitario:
Posología
Hemofilia A
La dosificación y la duración del tratamiento dependen de la gravedad de la deficiencia de factor VIII, de la localización y el grado de la hemorragia y del estado clínico del paciente.
El número de unidades de factor VIII administradas se expresa en Unidades Internacionales (UI), en relación con el estándar de la Organización Mundial de la Salud (OMS) vigente para concentrados de factor VIII. La actividad plasmática de factor VIII se expresa como un porcentaje (en relación con el plasma humano normal) o en Unidades Internacionales (en relación con un estándar internacional para factor VIII en plasma).
Una Unidad Internacional (UI) de actividad de factor VIII equivale a la cantidad de factor VIII en un ml de plasma humano normal.
Tratamiento a demanda
El cálculo de la dosis necesaria de factor VIII se basa en la observación empírica de que 1 Unidad Internacional (UI) de factor VIII por kg de peso corporal aumenta la actividad plasmática de factor VIII en un 2,1 ± 0,4% de la actividad normal. La dosis necesaria se determina utilizando la fórmula siguiente:
Unidades requeridas = peso corporal (kg) x aumento deseado de factor VIII (%) (UI/dl) x 0,5
La dosis y la frecuencia de administración deben calcularse según la respuesta clínica del paciente.
En el caso de episodios hemorrágicos como los detallados a continuación, la actividad de factor VIII no debe ser inferior al nivel plasmático de actividad establecido (en % de plasma normal o UI/dl) en el período correspondiente. Puede emplearse la siguiente tabla como guía de dosificación en episodios hemorrágicos y cirugía:
Grado de la hemorragia/ Tipo de cirugía | Nivel de factor VIII requerido (%)(UI/dl) | Frecuencia de dosificación (horas)/ Duración de la terapia (días) |
Hemorragia | ||
Hemartrosis y sangrado muscular u oral menores | 20 - 40 | Repetir cada 12 - 24 horas. Al menos 1 día, hasta que el episodio hemorrágico manifestado por dolor se detenga o hasta curación. |
Hemartrosis y hemorragia muscular o hematoma moderados | 30 - 60 | Repetir la administración cada 12 ‑ 24 horas durante 3 - 4 días o más hasta que el dolor y la discapacidad aguda desaparezcan. |
Hemorragias con peligro para la vida | 60 - 100 | Repetir la administración cada 8 ‑ 24 horas hasta que el riesgo desaparezca. |
Cirugía | ||
Cirugía menor incluyendo extracciones dentales Cirugía mayor | 30 - 60 80 - 100 (pre- y postoperatorio) | Cada 24 horas, al menos 1 día hasta curación. Repetir la administración cada 8 ‑ 24 horas hasta la adecuada cicatrización de la herida, y continuar la terapia durante un mínimo de 7 días para mantener un nivel de actividad de factor VIII de 30% a 60% (UI/dl). |
Profilaxis
En la profilaxis a largo plazo para impedir hemorragias en pacientes con hemofilia A grave deben administrarse dosis de 20 a 40 UI de FVIII/kg de peso corporal a intervalos de 2 a 3 días. En algunos casos, especialmente en pacientes jóvenes, puede ser necesario acortar los intervalos de administración o dosis más elevadas.
Enfermedad de von Willebrand (EVW)
Generalmente, 1 UI de FVW:RCo/kg eleva el nivel circulante del mismo aproximadamente en un 2%. Deben alcanzarse los niveles de FVW:RCo > 0,6 UI/ml (60%) y de FVIII:C > 0,4 UI/ml (40%).
Normalmente se recomienda 40 - 80 UI/kg de factor von Willebrand (FVW:RCo) y 20 - 40 UI/kg de FVIII:C para alcanzar la hemostasia.
Se puede necesitar una dosis inicial de 80 UI/kg de factor von Willebrand, especialmente en pacientes con el tipo 3 de la enfermedad de von Willebrand en que el mantenimiento de niveles adecuados puede necesitar dosis más elevadas que en otros tipos de la enfermedad de von Willebrand.
Se debe readministrar una dosis apropiada cada 12 - 24 horas. La dosis y la duración del tratamiento depende del estado clínico del paciente, del tipo y severidad de la hemorragia, y de los niveles de FVW:RCo y FVIII:C.
En el uso de un preparado de factor von Willebrand que contenga factor VIII, el médico que realiza el tratamiento debe tener en cuenta que el tratamiento continuado puede causar un aumento excesivo de FVIII:C. Después de 24 - 48 h de tratamiento, y para evitar un aumento excesivo de FVIII:C debe considerarse la reducción de la dosis y/o prolongación del intervalo en la administración de la dosis, o bien se debe considerar el uso de productos con factor von Willebrand que contengan un bajo nivel de factor VIII.
Población pediátrica
No se ha establecido la seguridad y eficacia de Fanhdi en niños menores de 6 años para las indicaciones autorizadas.
La posología en niños de 6 años o mayores no se considera distinta de la de los adultos, puesto que va asociada al peso corporal y se ajusta al resultado clínico de las condiciones arriba indicadas.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a FANHDI 100 UI FVIII/120 UI FVW POR ml POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 25 U.I. FVIII/ 30 U.I. FVW por mlPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: INYECTABLE, 50 U.I. FVIII/60 UI FVW por mlPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: INYECTABLE, 500 UI factor VIIIPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Csl Behring S.A.Requiere receta
Médicos online para FANHDI 100 UI FVIII/120 UI FVW POR ml POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de FANHDI 100 UI FVIII/120 UI FVW POR ml POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















