
EVIANA 0,5 mg/0,1 mg COMPRIMIDOS RECUBIERTOS CON PELICULA

Cómo usar EVIANA 0,5 mg/0,1 mg COMPRIMIDOS RECUBIERTOS CON PELICULA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Eviana 0,5 mg/0,1 mg comprimidos recubiertos con película
estradiol/acetato de noretisterona
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Eviana y para qué se utiliza
- Qué necesita saber antes de empezar a tomar Eviana
- Cómo tomar Eviana
- Posibles efectos adversos
- Conservación de Eviana
- Contenido del envase e información adicional
1. Qué es Eviana y para qué se utiliza
Eviana es una terapia hormonal sustitutiva (THS) combinada continua. Contiene dos tipos de hormonas femeninas, un estrógeno y un progestágeno. Eviana se utiliza en mujeres posmenopáusicas cuyo último período natural se produjo hace 1 año como mínimo.
Eviana se utiliza para:
Aliviar los síntomas que se producen tras la menopausia
Durante la menopausia, la cantidad de estrógenos que produce el cuerpo de la mujer desciende. Esto puede producir síntomas como calor en el rostro, el cuello y el pecho (“sofocos”). Eviana alivia estos síntomas tras la menopausia. Solo se le prescribirá Eviana si los síntomas dificultan seriamente su vida diaria.
Eviana se receta a mujeres a las que no se les ha extirpado el útero y cuyos períodos finalizaron hace más de un año.
La experiencia en el tratamiento de mujeres de más de 65 años es limitada.
2. Qué necesita saber antes de empezar a tomar Eviana
Historial médico y revisiones periódicas
El uso de la THS acarrea riesgos que deben tenerse en cuenta antes de decidir comenzar a tomarla o continuar tomándola.
La experiencia en el tratamiento de mujeres con menopausia prematura (debido a un fallo de los ovarios o a una intervención quirúrgica) es limitada. Si usted tiene una menopausia prematura, los riesgos de la THS pueden ser distintos. Consulte a su médico.
Antes de comenzar (o retomar) la THS, el médico le preguntará por su historial médico y el de su familia. Podría decidir realizarle una exploración física, que podría incluir una exploración de las mamas o un examen interno, si es necesario.
Una vez que haya comenzado a tomar Eviana, deberá acudir a revisiones periódicas (una vez al año como mínimo). En dichas revisiones podrá comentar con el médico los beneficios y riesgos de continuar el tratamiento con Eviana.
Acuda a realizarse regularmente exploraciones mamarias, tal como le recomiende su médico.
No tome Eviana
Si le afecta cualquiera de las siguientes situaciones clínicas. Si tiene dudas sobre alguno de los puntos siguientes, pregunte a su médicoantes de tomar Eviana.
No tome Eviana:
- Si tiene, ha tenido o sospecha que pueda tener cáncer de mama.
- Si tiene, ha tenido o sospecha que pueda tener cáncer de las células que revisten el útero
(cáncer de endometrio) u otro cáncer dependiente de estrógenos.
- Si sufre cualquier hemorragia vaginal de causa desconocida.
- Si tiene un engrosamiento excesivo de la capa que reviste el útero (hiperplasia endometrial) que no esté siendo tratada.
- Si tiene o ha tenido alguna vez coágulos sanguíneos en una vena(tromboembolia venosa), ya sea en las piernas (trombosis venosa profunda) o en los pulmones (embolia pulmonar).
- Si padece algún trastorno de la coagulación (como deficiencia de proteína C, proteína S o antitrombina).
- Si padece o ha padecido alguna enfermedad provocada por coágulos sanguíneos en las arterias, como infarto de miocardio, accidente cerebrovascular o angina de pecho.
- Si tiene o ha tenido alguna enfermedad del hígado y los análisis de función hepática todavía no se han normalizado.
- Si tiene un raro trastorno sanguíneo denominado “porfiria”, de transmisión hereditaria.
- Si es usted alérgica (hipersensible) al estradiol, el acetato de noretisterona o cualquiera de los demás componentes de Eviana (detallados en la sección 6,"Contenido del envase e información adicional").
Si alguno de estos trastornos se manifiesta por primera vez mientras está tomando Eviana, suspenda el tratamiento inmediatamente y consulte a su médico lo antes posible.
Advertencias y precauciones
Antes de comenzar el tratamiento, informe a su médico si ha tenido alguna vez cualquiera de los problemas siguientes, ya que podrían volver a presentarse o empeorar durante el tratamiento con Eviana. Si es así, deberá acudir a revisiones periódicas con más frecuencia:
- fibromas en el útero
- engrosamiento de la capa que reviste el útero (endometriosis) o antecedentes de engrosamiento excesivo de la capa que reviste el útero (hiperplasia endometrial)
- antecedentes de formación de coágulos sanguíneos (ver el apartado “Coágulos sanguíneos en una vena (tromboembolia venosa)”)
- aumento del riesgo de sufrir un cáncer sensible a los estrógenos (como haber tenido una madre, hermana o abuela que hayan padecido un cáncer de mama)
- presión arterial elevada
- un trastorno del hígado, como un tumor hepático benigno
- diabetes
- cálculos biliares
- migraña o dolores de cabeza intensos
- una enfermedad del sistema inmunitario que afecta a varios órganos del cuerpo (lupus eritematoso sistémico o LES)
- epilepsia
- asma
- una enfermedad que afecta a la membrana del tímpano y a la audición (otosclerosis)
- un nivel muy alto de grasa en la sangre (triglicéridos)
- retención de líquidos debido a problemas de corazón o riñón
- un trastorno en el que el tiroides no produce suficiente cantidad de hormona tiroidea (hipotiroidismo), y está usted siendo tratada con terapia de sustitución de la hormona tiroidea
- una enfermedad hereditaria que provoca episodios recurrentes de hinchazón intensa (angioedema hereditario), o si ha tenido episodios de hinchazón rápida de manos, cara, pies, labios, lengua, garganta (bloqueo de las vías respiratorias) o tubo digestivo (angioedema adquirido)
- intolerancia a la lactosa.
Interrumpa el tratamiento con Eviana e informe inmediatamente al médico
Si nota cualquiera de los siguientes síntomas al tomar la THS:
- cualquiera de los trastornos mencionados en el apartado “No tome Eviana”
- coloración amarillenta de la piel o el blanco de los ojos (ictericia). Pueden ser síntomas de una enfermedad del hígado
- hinchazón de la cara, la lengua y/o la garganta y/o dificultad para tragar o urticaria, junto con dificultad para respirar, que son síntomas indicativos de angioedema
- un gran aumento de la presión arterial (con síntomas como dolor de cabeza, cansancio, mareos)
- dolor de cabeza de tipo migrañoso, que puede presentarse por primera vez
- si se queda embarazada
- si nota síntomas de un coágulo sanguíneo, como:
- inflamación con dolor y enrojecimiento de las piernas
- dolor súbito en el pecho
- dificultad para respirar
Para más información, ver el apartado "Coágulos sanguíneos en una vena (tromboemboliavenosa)".
Nota:Eviana no es un anticonceptivo. Si han transcurrido menos de 12 meses desde que tuvo la última menstruación o tiene menos de 50 años, puede que aún necesite utilizar un método anticonceptivo para prevenir el embarazo. Pida consejo a su médico.
THS y cáncer
Engrosamiento excesivo del revestimiento del útero (hiperplasia endometrial) y cáncer del revestimiento del útero (cáncer de endometrio)
La THS solo con estrógenos aumenta el riesgo de un engrosamiento excesivo del revestimiento del útero (hiperplasia endometrial) y cáncer del revestimiento del útero (cáncer de endometrio).
El progestágeno en Eviana protege frente a este riesgo adicional.
Comparación
En mujeres de 50 a 65 años de edad con útero intacto que no toman THS, se diagnosticarán por término medio 5 casos de cáncer de endometrio por cada 1 000 mujeres.
En mujeres con útero intacto de 50 a 65 años de edad que toman THS solo con estrógenos, se diagnosticarán entre 10 y 60 casos de cáncer de endometrio por cada 1 000 usuarias (es decir, entre 5 y 55 casos adicionales), en función de la dosis y la duración del tratamiento.
Hemorragias irregulares
Puede tener hemorragias irregulares o pérdidas de sangre (manchados) durante los primeros 3 a 6 meses de toma de Eviana. Sin embargo, si la hemorragia irregular:
- persiste más allá de los primeros 6 meses
- comienza después de haber tomado Eviana durante más de 6 meses
- continúa después de haber dejado de tomar Eviana
debe contactar con su médico lo antes posible.
Cáncer de mama
Los datos existentes muestran que el uso de terapia hormonal sustitutiva (THS) con estrógenos-progestágenos combinados o con solo estrógenos aumenta el riesgo de cáncer de mama. El riesgo adicional depende del tiempo durante el que use la THS.
El riesgo adicional se hace patente después de 3 años de uso. Tras suspender la THS, el riesgo adicional disminuirá con el tiempo, pero el riesgo puede persistir durante 10 años o más si ha usado THS durante más de 5 años.
Comparación
En mujeres de 50 a 54 años de edad que no estén utilizando THS, en una media de 13 a 17 de cada 1000 se diagnosticará cáncer de mama en un período de 5 años.
En mujeres de 50 años que inicien una terapia hormonal sustitutiva con solo estrógenos para 5 años, habrá entre16 y 17 casos por cada 1000 mujeres usuarias (es decir, entre 0 y 3 casos adicionales).
En mujeres de 50 años que inicien tomando una THS con estrógenos-progestágenos durante 5 años, habrá entre 21 por cada 1000 mujeres usuarias (es decir, ente 4 a 8 casos adicionales).
En mujeres de 50 a 59 años que no estén tomando THS, se diagnosticarán un promedio de 27 casos de cáncer de mama por cada 1000 mujeres en un periodo de 10 años.
En mujeres de 50 años que inicien una terapia hormonal sustitutiva solo con estrógenos durante más de 10 años, habrá 34 casos por cada 1000 mujeres usuarias (es decir, 7 casos adicionales).
En mujeres de 50 años que inicien una THS con estrógenos-progestágenos durante 10 años, habrá 48 casos de cada 1000 usuarias (es decir, 21 casos adicionales).
Examine sus mamas regularmente. Acuda al médico si nota cualquier cambio, como:
- hoyuelos en la piel
- cambios en los pezones
- cualquier bulto que pueda ver o notar.
Además, se aconseja participar en programas de exploraciones de las mamas cuando se lo ofrezcan.
En las exploraciones de las mamas, es importante que informe a su enfermera/profesional sanitario que está tomando THS cuando le realice la exploración por rayos X, ya que este medicamento puede incrementar la densidad de las mamas, que puede afectar al resultado de la mamografía. Cuando la densidad de la mama es mayor, puede ser que la mamografía no detecte todos los bultos.
Cáncer de ovario
El cáncer de ovario se produce con menos frecuencia que el cáncer de mama. El uso de THS con estrógenos solos o con combinación de estrógenos-progestágenos se ha asociado con un riesgo ligeramente mayor de cáncer de ovario.
El riesgo de cáncer de ovario varía con la edad. Por ejemplo, en mujeres de entre 50 y 54 años de edad que no siguen THS, se han observado alrededor de 2 casos de cáncer de ovario por cada 2000 mujeres en un periodo de 5 años. En mujeres en tratamiento con THS durante 5 años, se han observado alrededor de 3 casos por cada 2000 pacientes (es decir, alrededor de 1 caso adicional).
Efecto de la THS sobre el corazón y la circulación
Coágulos sanguíneos en una vena (tromboembolia venosa)
El riesgo de coágulos sanguíneos en las venases aproximadamente de 1,3 a 3 veces superior en usuarias de THS que en no usuarias, especialmente durante el primer año.
Los coágulos sanguíneos pueden ser graves, y si uno de ellos llega a los pulmones, puede provocar dolor en el pecho, dificultad para respirar, síncope o incluso la muerte.
La probabilidad de padecer coágulos sanguíneos en las venas será mayor con el aumento de la edad y si interviene uno de los siguientes factores. En caso de que alguna de estas situaciones pueda aplicarse a usted, informe a su médico:
- no podrá caminar durante bastante tiempo debido a una operación quirúrgica mayor, lesión o enfermedad (ver también la sección 3, “Si debe someterse a cirugía”)
- tiene un sobrepeso importante (IMC > 30 kg/m2)
- sufre un problema de coagulación sanguínea que necesita un tratamiento prolongado con medicación para prevenir los coágulos
- algún familiar cercano ha tenido alguna vez un coágulo sanguíneo en piernas, pulmones u otros órganos
- padece lupus eritematoso sistémico (LES)
- tiene cáncer.
Para conocer los síntomas que provoca un coágulo sanguíneo, consulte el apartado “Interrumpa el tratamiento con Eviana e informe inmediatamente a su médico”.
Comparación
Se calcula que, durante un período de 5 años, una media de 4 a 7 de cada 1 000 mujeres en la cincuentena que no toman THS sufrirán un coágulo sanguíneo en una vena.
En las mujeres en la cincuentena que toman THS con estrógenos-progestágenos durante 5 años, habrá entre 9 y 12 casos por cada 1 000 usuarias (es decir, 5 casos adicionales).
Cardiopatías (infarto de miocardio)
No se ha demostrado que la THS previene el infarto de miocardio. Las mujeres de más de 60 años que utilizan la THS con estrógenos-progestágenos presentan un riesgo ligeramente superior de desarrollar cardiopatías que las que no toman THS.
Accidente cerebrovascular
El riesgo de accidente cerebrovascular es aproximadamente 1,5 veces superior en las usuarias de THS que en las no usuarias. El número de casos adicionales de accidente cerebrovascular debido al uso de THS aumentará con la edad.
Comparación
Se calcula que, durante un período de 5 años, por término medio 8 de cada 1000 mujeres en la cincuentena que no toman THS sufrirán un accidente cerebrovascular.
En las mujeres en la cincuentena que están tomando THS, el número de casos será de 11 por cada 1000 usuarias durante un período de 5 años (es decir, 3 casos adicionales).
Otros trastornos
La THS no previene la pérdida de memoria. Existen indicios de un mayor riesgo de pérdida de memoria en las mujeres que comienzan a utilizar la THS después de los 65 años. Pida consejo a su médico.
Uso con otros medicamentos
Algunos medicamentos pueden interferir con el efecto de Eviana. Esto puede provocar hemorragias irregulares.
Tales medicamentos son los siguientes:
- Medicamentos para la epilepsia (como fenobarbital, fenitoína y carbamazepina)
- Medicamentos para la tuberculosis (como rifampicina y rifabutina)
- Medicamentos para la infección por el VIH (como nevirapina, efavirenz, ritonavir y nelfinavir)
- Medicamentos para la hepatitis C (como telaprevir)
- Preparados a base de plantas que contengan Hierba de San Juan (Hypericum perforatum).
.
THS puede afectar el funcionamiento de ciertos medicamentos:
- Medicamento para epilepsia (lamotrigina), ya que puede aumentar la frecuencia de convulsiones.
- Medicamentos para el virus de hepatitis C (VHC) (como el régimen combinado ombitasvir/paritaprevir/ritonavir con o sin dasabuvir, así como un régimen con glecaprevir/pibrentasvir) pueden causar aumentos en los resultados de los análisis de sangre por la función hepática (aumento de la enzima hepática ALT) en mujeres que utilizan anticonceptivos hormonales combinados (AHC) que contienen etinilestradiol. Eviana contiene estradiol en lugar de etinilestradiol. Se desconoce si puede producirse un aumento de la enzima hepática ALT al utilizar Eviana con este régimen combinado contra el VHC.
Otros medicamentos pueden aumentar los efectos de Eviana:
- Medicamentos que contengan ketoconazol (un fungicida).
Eviana puede afectar al tratamiento concomitante con ciclosporina.
Informe a su médico o farmacéuticosi está tomando o ha tomado recientemente cualquier otro medicamento, incluso los adquiridos sin receta, los elaborados a base de plantas medicinales u otros productos naturales. Su médico le aconsejará.
Pruebas analíticas
Si necesita un análisis de sangre, informe a su médico o al personal de laboratorio de que está tomando Eviana, ya que este medicamento puede alterar los resultados de algunos parámetros de laboratorio.
Toma de Eviana con medicamentos y bebidas
Los comprimidos pueden tomarse con o sin alimentos o bebidas.
Embarazo y lactancia
Embarazo:Eviana solo debe utilizarse en mujeres posmenopáusicas. Si se queda embarazada, deje de tomar Eviana y póngase en contacto con su médico.
Lactancia:No debe tomar Eviana si está dando el pecho.
Conducción y uso de máquinas
Eviana no tiene efectos conocidos sobre la capacidad para conducir o utilizar máquinas.
Información importante sobre algunos de los componentes de Eviana:
Eviana contiene lactosa monohidrato. Si padece una intolerancia a ciertos azúcares, consulte con el médico antes de tomar este medicamento.
3. Cómo tomar Eviana
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte a su médico o farmacéutico.
Tome un comprimido una vez al día, aproximadamente a la misma hora cada día.Tome el comprimido con un vaso de agua.
Tome un comprimido cada día sin interrupción.Después de tomar los 28 comprimidos del envase disco-calendario, deberá continuar con uno nuevo.
Para más información sobre el uso del envase calendario consulte INSTRUCCIONES PARA EL USUARIO, al final de este prospecto.
Puede comenzar el tratamiento con Evianacualquier día de la semana. Sin embargo, si ha cambiado de otro producto de THS con el que tenía hemorragias menstruales, comience el nuevo tratamiento justo después de haber finalizado la hemorragia.
Su médico debe recetarle la dosis efectiva más baja y durante el menor tiempo posible que le proporcione el alivio de los síntomas. Hable con el médico si cree que la dosis es excesiva o insuficiente.
Si toma más Eviana del que debiera
Si ha tomado más Eviana del que debe, consulte a su médico o farmacéutico lo antes posible. Tomar más estrógenos de los que le ha recetado el médico puede provocarle sensibilidad en las mamas, náuseas, vómitos y/o sangrado vaginal irregular (metrorragia). Tomar más progestágenos de los que le ha recetado el médico puede provocarle estado de ánimo depresivo, fatiga, acné y crecimiento del vello corporal o facial (hirsutismo).
Si olvidó tomar Eviana
Si ha olvidado tomar el comprimido correspondiente a la hora habitual, tómelo dentro de las siguientes 12 horas. Si ya han pasado más de 12 horas, tómelo al día siguiente a la hora habitual. No tome una dosis doble para compensar la dosis olvidada.
El olvido de una dosis puede aumentar la probabilidad de sufrir hemorragias intercurrentes y manchados, a no ser que le hayan quitado el útero.
Si interrumpe el tratamiento con Eviana
Si usted quiere interrumpir el tratamiento con Eviana, hable en primer lugar con su médico, quien le explicará los efectos de interrumpir el tratamiento y comentará con usted otras posibilidades.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
Si debe someterse a cirugía
Si va a someterse a una intervención quirúrgica, informe al cirujano de que está tomando Eviana. Puede que tenga que suspender la toma de Eviana de 4 a 6 semanas antes de la operación para reducir el riesgo de coágulos sanguíneos (ver el apartado "Coágulos sanguíneos en una vena (tromboembolia venosa)", en la sección 2). Pregunte a su médico cuándo puede comenzar a tomar Eviana de nuevo.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los siguientes trastornos han sido comunicados con más frecuencia en las mujeres que utilizan la THS respecto a las que no la utilizan:
- cáncer de mama
- crecimiento anómalo o cáncer del revestimiento del útero (hiperplasia endometrial o cáncer de endometrio)
- cáncer de ovario
- coágulos sanguíneos en las venas de las piernas o los pulmones (tromboembolia venosa)
- cardiopatía
- accidente cerebrovascular
- probable pérdida de memoria si se empieza la THS con más de 65 años de edad.
Para obtener más información sobre estos efectos adversos, ver la sección 2, “Qué necesita saber antes de empezar a tomar Eviana”.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
- Hemorragia vaginal.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
- Infección por hongos en los genitales o inflamación vaginal
- Crecimiento excesivo del revestimiento del útero (hiperplasia endometrial)
- Náuseas
- Dolor abdominal (estómago)
- Dolor en la espalda o el cuello
- Dolor en los brazos o las piernas
- Cefalea.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
- Reacciones alérgicas (hipersensibilidad)
- Depresión o empeoramiento de una depresión existente
- Nerviosismo
- Mareos
- Migrañas (ver el apartado “Interrumpa el tratamiento con Eviana”, en la sección 2)
- Dolor o molestias en las mamas
- Inflamación o distensión abdominal (estómago)
- Aumento de peso por retención de líquidos
- Hinchazón de brazos y piernas (edema periférico)
- Calambres en las piernas
- Acidez (dispepsia)
- Acné
- Caída del cabello (alopecia)
- Picor o urticaria.
Efectos adversos muy raros (pueden afectar hasta 1 de cada 10000 personas)
- Se han comunicado reacciones de hipersensibilidad generalizadas (p. ej., reacción anafiláctica o choque anafiláctico).
Otros efectos adversos de la THS combinada
- Enfermedad de la vesícula biliar
- Diversos trastornos cutáneos:
- pigmentación de la piel, especialmente en la cara y el cuello, conocida como “manchas del embarazo” (cloasma)
- nódulos cutáneos rojos y dolorosos (eritema nodular)
- erupción con úlceras o enrojecimientos en forma de diana (eritema polimorfo).
- coloración roja o morada de la piel y/o las mucosas (púrpura vascular)
- Sequedad ocular
- Cambios en la composición de la lágrima.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir aproporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Eviana
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en el embalaje exterior, después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25 °C. No refrigerar.
Mantener el envase en el embalaje exterior para protegerlo de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente..
6. Contenido del envase e información adicional
Composición de Eviana
- Los principios activos de Eviana son estradiol y acetato de noretisterona. Cada comprimido contiene 0,5 mg de estradiol (como hemihidrato de estradiol) y 0,1 mg de acetato de noretisterona.
- Los demás componentes son: lactosa monohidrato, almidón de maíz, hidroxipropil celulosa, estearato de magnesio, hipromelosa, triacetina y talco.
Aspecto del producto y contenido del envase
Comprimidos recubiertos, blancos, redondos, con un diámetro de 6 mm. En una cara está grabado “NOVO 291” y en la otra, el logo de Novo-Nordisk (un toro de Apis).
Presentaciones:
- 28 comprimidos recubiertoscon película
- 3 x 28 comprimidos recubiertoscon película
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular:
Isdin S.A.
Provençals 33
Barcelona 08019
España
Responsable de la fabricación:
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Dinamarca
Este medicamento está autorizado en los Estados Miembros del Espacio Económico Europeo con los siguientes nombres:
Activelle: Austria, Portugal
Activelle low: Dinamarca, Islandia, Italia
Activelle minor: Bélgica, Luxemburgo
Eviana: Estonia, Hungría, Países Bajos, Noruega, España, Suecia
Noviana: Finlandia
Fecha de la última revisión de este prospecto:septiembre 2024
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de{nombre del Estado miembro/Agencia}:
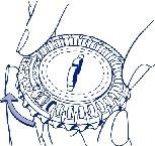
INSTRUCCIONES PARA LA USUARIA
Cómo utilizar el envase disco-calendario
- Colocar el indicador del día
Girar el disco interior y fijar el día de la semana frente a la apertura cerrada con una lengüeta de plástico.
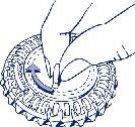
- Cómo extraer el primer comprimido
Romper la lengüeta de plástico y extraer el primer comprimido.
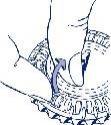
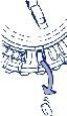
- Mover el dial cada día
Simplemente, girar 1 espacio el disco transparente en la dirección de las agujas del reloj, según indica la flecha. Extraer el siguiente comprimido.Recuerde tomar solo 1 comprimido al día.
El disco transparente solamente se puede girar una vez que se ha extraído el comprimido
correspondiente.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a EVIANA 0,5 mg/0,1 mg COMPRIMIDOS RECUBIERTOS CON PELICULAForma farmacéutica: COMPRIMIDO, 1 mg / 0,5 mgPrincipio activo: norethisterone and estrogenFabricante: Isdin S.A.Requiere recetaForma farmacéutica: CAPSULA, 1 mg/ 100 mgPrincipio activo: progesterone and estrogenFabricante: Theramex Ireland LimitedRequiere recetaForma farmacéutica: COMPRIMIDO, 2 mg dienogest-R; 2 mg estradiol valeratoPrincipio activo: dienogest and estrogenFabricante: Bayer Hispania S.L.Requiere receta
Médicos online para EVIANA 0,5 mg/0,1 mg COMPRIMIDOS RECUBIERTOS CON PELICULA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de EVIANA 0,5 mg/0,1 mg COMPRIMIDOS RECUBIERTOS CON PELICULA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes






