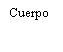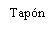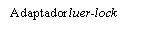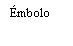CERVARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA

Cómo usar CERVARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto:información para el usuario
Cervarix suspensión inyectable en jeringa precargada
Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18]
(Recombinante, adyuvada, adsorbida)
Lea todo el prospecto detenidamente antes de empezar a recibir esta vacuna,porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es Cervarix y para qué se utiliza
- Qué necesita saber antes de recibir Cervarix
- Cómo administrar Cervarix
- Posibles efectos adversos
- Conservación de Cervarix
- Contenido del envase e información adicional
1. Qué es Cervarix y para qué se utiliza
Cervarix es una vacuna que está indicada para proteger a personas a partir de los 9 años de edad frente a las enfermedades causadas por la infección por los Virus del Papiloma Humano (VPH).
Estas enfermedades incluyen:
- cáncer de cérvix (es decir, de cuello uterino o matriz) y cáncer anal,
- lesiones precancerosas de cérvix, vulva, vagina y ano (cambios en las células genitales o anales que tienen riesgo de convertirse en cáncer).
Los tipos del Virus del Papiloma Humano (VPH) contenidos en la vacuna (tipos 16 y 18) son responsables de, aproximadamente, el 70% de los cánceres de cuello uterino, el 90% de los cánceres anales, el 70% de las lesiones precancerosas de la vulva y de la vagina relacionadas con el VPH y el 78% de las lesiones precancerosas del ano relacionadas con el VPH. Otros tipos del VPH pueden causar también cánceres ano-genitales. Cervarix no protege frente a todos los tipos del VPH.
Cuando se vacuna a una persona con Cervarix, el sistema inmunitario (el sistema de defensa natural del organismo) genera anticuerpos frente a los VPH tipos 16 y 18.
Cervarix no es infecciosa y, por tanto, no puede causar enfermedades relacionadas con el VPH.
Cervarix no se utiliza para curar enfermedades relacionadas con el VPH que ya estén presentes en el momento de la vacunación.
Cervarix debe utilizarse de acuerdo con las recomendaciones oficiales.
2. Qué necesita saber antes de empezar a recibir Cervarix
Cervarix no debe administrarse
- si es alérgico a alguno de los principios activos o a alguno de los demás componentes de esta vacuna (incluidos en la sección 6). Los signos de una reacción alérgica pueden incluir erupción de la piel con picor, dificultad para respirar e hinchazón de la cara o lengua
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de recibir Cervarix:
- si tiene un problema de coagulación o le aparecen cardenales con facilidad
- si tiene alguna enfermedad que reduzca su resistencia a la infección, como una infección por el VIH
- si tiene una infección grave con fiebre alta. Puede ser necesario que posponga la vacunación hasta que se recupere. Una infección de poca importancia, como un resfriado, no debería ser un problema para la vacunación, pero antes de vacunarse coménteselo a su médico.
Antes o después de cualquier inyección, podría producirse un desmayo (especialmente en los adolescentes), por lo que debe informar a su médico o enfermero si usted o su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Como todas las vacunas, puede que Cervarix no proteja completamente a todas las personas que se vacunen.
Cervarix no protege de las enfermedades causadas por la infección por los tipos 16 o 18 del VPH si en el momento de la vacunación los sujetos ya están infectados por los tipos 16 o 18 del Virus del Papiloma Humano.
Aunque la vacunación puede protegerle frente al cáncer de cuello uterino, no es un sustituto de la exploración ginecológica rutinaria del cuello uterino. Usted debe seguir los consejos de su médico respecto a la realización de citologías de cuello uterino /prueba de Papanicolau (prueba para detectar los cambios en las células del cuello uterino causados por una infección por el VPH) y a la utilización de medidas preventivas y protectoras.
Como Cervarix no protege frente a todos los tipos del Virus del Papiloma Humano, debe continuar tomando las precauciones apropiadas para evitar el contagio del VPH y de las enfermedades de transmisión sexual.
Cervarix no protege frente a otras enfermedades que no estén causadas por el Virus del Papiloma Humano.
Otros medicamentos y Cervarix
Cervarix puede administrarse con una vacuna combinada de recuerdo que contenga difteria (d), tétanos (T) y pertussis [acelular] (pa), con o sin poliomielitis inactivada (IPV) (vacunas dTpa, dTpa-IPV), con una vacuna combinada antihepatitis A y antihepatitis B (Twinrix), con una vacuna antihepatitis B (Engerix B) o con una vacuna conjugada con toxoide tetánico frente a los serogrupos meningocócicos A, C, W-135 e Y (MenACWY-TT), en un lugar de inyección diferente (otra parte de su cuerpo, por ejemplo, otro brazo) en la misma visita.
Puede que Cervarix no tenga un efecto óptimo si usted usa medicamentos que supriman el sistema inmune.
En los estudios clínicos, la utilización de anticonceptivos orales (por ejemplo, la píldora) no disminuyó la protección obtenida por Cervarix.
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento o si ha recibido recientemente cualquier otra vacuna.
Embarazo, lactancia y fertilidad
Si está embarazada, se ha quedado embarazada durante el periodo de vacunación o está intentando quedarse embarazada se recomienda que posponga o interrumpa la vacunación hasta la finalización del embarazo.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de recibir esta vacuna.
Conducción y uso de máquinas
Es poco probable que Cervarix afecte a su capacidad para conducir o usar máquinas. No obstante, no conduzca o maneje máquinas si no se encuentra bien.
Cervarix contiene sodio
Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es esencialmente “exento de sodio”.
3. Cómo administrar Cervarix
Cómo se administra la vacuna
El médico o el enfermero le administrará Cervarix mediante una inyección en el músculo de la parte superior del brazo.
Cuánto se administra
Cervarix está indicada en personas a partir de los 9 años de edad.
El número total de inyecciones que recibirá dependerá de su edad en el momento de la primera inyección.
Si tiene entre 9 y 14 años
Recibirá 2 inyecciones:
Primera inyección: en la fecha elegida.
Segunda inyección: entre 5 y 13 meses después de la primera inyección.
Si tiene 15 años o más
Recibirá 3 inyecciones:
Primera inyección: en la fecha elegida.
Segunda inyección: 1 mes después de la primera inyección.
Tercera inyección: 6 meses después de la primera inyección.
En caso necesario, el esquema de vacunación puede ser más flexible. Consulte a su médico para más información.
Una vez administrada la primera dosis de Cervarix, se recomienda que se utilice Cervarix (y no otra vacuna frente al VPH) para completar el esquema de vacunación.
No se recomienda el uso de Cervarix en personas menores de 9 años de edad.
La vacuna nunca debe inyectarse en una vena.
Si olvidó una dosis
Es importante que siga las instrucciones indicadas por su médico o enfermero en relación a las visitas posteriores. Si olvida volver a su médico en la cita programada, pida consejo a su médico.
Si no termina el ciclo completo de vacunación (dos o tres inyecciones, dependiendo de su edad en el momento de la vacunación), puede que no obtenga el mejor efecto y protección de la vacunación.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos que ocurrieron durante los ensayos clínicos con Cervarix fueron:
- Muy frecuentes (efectos adversos que tienen lugar en más de 1 por cada 10 dosis de vacuna): dolor o molestias en el lugar de la inyección, enrojecimiento o inflamación en el lugar de la inyección, dolor de cabeza, dolores musculares, sensibilidad o debilidad muscular (no causados por el ejercicio físico), cansancio.
- Frecuentes (efectos adversos que tienen lugar en menos de 1 por cada 10 pero en más de 1 por cada 100 dosis de vacuna): síntomas gastrointestinales incluyendo náuseas, vómitos, diarrea y dolor abdominal, picor, enrojecimiento de la piel y erupción cutánea, habón urtical (urticaria), dolor en las articulaciones, fiebre (?38°C).
- Poco frecuentes (efectos adversos que tienen lugar en menos de 1 por cada 100 pero más de 1 por cada 1.000 dosis de vacuna): infección en las vías respiratorias superiores (infección de nariz, garganta o tráquea), mareo, otras reacciones en el lugar de la inyección como induración, hormigueo o adormecimiento de la zona.
Los efectos adversos observados durante la comercialización de Cervarix incluyen:
- reacciones alérgicas. Estas se pueden reconocer por:
- erupción cutánea con picor en manos y pies,
- hinchazón de los ojos y la cara,
- dificultad para respirar o tragar,
- descenso repentino de la presión sanguínea y pérdida de conciencia.
Normalmente estas reacciones aparecerán antes de abandonar la consulta del médico. Sin embargo, si su hijo padece cualquiera de estos síntomas debe contactar urgentemente con un médico.
- hinchazón de los glanglios del cuello, de las axilas o de las ingles
- desfallecimiento, algunas veces acompañado de temblores o rigidez.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Cervarix
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2ºC y 8ºC).
No congelar.
Conservar en el embalaje original para protegerla de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deCervarix
- Los principios activos son:
Proteína L1 del Virus del Papiloma Humano1 tipo 162,3,4 20 microgramos
Proteína L1 del Virus del Papiloma Humano1 tipo 182,3,4 20 microgramos
1Virus del Papiloma Humano = VPH
2adyuvada con AS04 que contiene:
3-O-desacil-4’- monofosforil lípido A (MPL)3 50 microgramos
3adsorbida en hidróxido de aluminio, hidratado (Al(OH)3) 0,5 miligramos de Al3+
en total
4Proteína L1 en forma de partículas no infecciosas similares al virus (VLPs) producidas por tecnología de ADN recombinante usando un sistema de expresión en Baculovirus que utiliza células Hi-5 Rix4446 derivadas del insecto Trichoplusia ni.
- Los demás componentes son: cloruro de sodio (NaCl), dihidrógeno fosfato de sodio dihidrato (NaH2PO4.2 H2O) y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
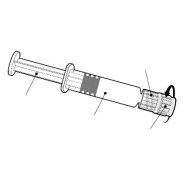
Suspensión inyectable en jeringa precargada.
Cervarix es una suspensión blanca turbia.
Cervarix está disponible en jeringa precargada de 1 dosis, con o sin agujas separadas; tamaños de envase de 1 y 10.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
GlaxoSmithKline Biologicals s.a.
Rue de l'Institut 89
B-1330 Rixensart, Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgique/België/Belgien GlaxoSmithKline Pharmaceuticals SA/NV Tél/Tel: + 32 10 85 52 00 | Lietuva GlaxoSmithKline Biologicals SA Tel: +370 80000334 |
???????? GlaxoSmithKline Biologicals SA ???. + 359 80018205 | Luxembourg/Luxemburg GlaxoSmithKline Pharmaceuticals SA/NV Tél/Tel: + 32 10 85 52 00 |
Ceská republika GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 | Magyarország GlaxoSmithKline Biologicals SA Tel.: + 36 80088309 |
Danmark GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 | Malta GlaxoSmithKline Biologicals SA Tel: + 356 80065004 |
Deutschland GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 | Nederland GlaxoSmithKline BV Tel: + 31 (0)30 69 38 100 |
Eesti GlaxoSmithKline Biologicals SA Tel: +372 8002640 | Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 |
Ελλ?δα GlaxoSmithKline Μονοπρ?σωπη A.E.B.E Tηλ: + 30 210 68 82 100 | Österreich GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 |
España GlaxoSmithKline, S.A. Tel: + 34 900 202 700 | Polska GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
France Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 Hrvatska GlaxoSmithKline Biologicals SA Tel.: + 385 800787089 | Portugal GlaxoSmithKline - Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00 România GlaxoSmithKline Biologicals SA Tel: +40 800672524 |
Ireland GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000 | Slovenija GlaxoSmithKline Biologicals SA Tel: + 386 80688869 |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika GlaxoSmithKline Biologicals SA Tel: + 421 800500589 |
Italia GlaxoSmithKline S.p.A. Tel: + 39 (0)45 7741 111 | Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 |
Κ?προς GlaxoSmithKline Biologicals SA Τηλ: + 357 80070017 | Sverige GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Latvija GlaxoSmithKline Biologicals SA Tel: + 371 80205045 | United Kingdom (Northern Ireland) GlaxoSmithKline Biologicals SA Tel: +44 (0)800 221 441 |
Fecha de la última revisión deeste prospecto:04/2023
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu, y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/).
-----------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales sanitarios:
Una vez fuera de la nevera, Cervarix debe administrarse lo antes posible. Sin embargo, se ha demostrado su estabilidad cuando se almacena fuera de la nevera hasta 3 días a una temperatura de entre 8ºC y 25ºC o hasta 1 día a una temperatura de entre 25ºC y 37ºC. Si no se ha utilizado transcurrido este periodo, desechar la vacuna.
Durante la conservación de la jeringa, puede observarse un depósito blanco y un sobrenadante transparente. Esto no es signo de deterioro.
Se debe examinar visualmente el contenido de la jeringa tanto antes como después de agitar para observar si existe alguna partícula extraña y/o variación del aspecto físico antes de su administración.
En caso de apreciar alguna de estas circunstancias, debe desechar la vacuna.
La vacuna debe agitarse bien antes de su uso.
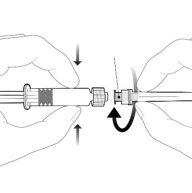
Instrucciones para la jeringa precargada
| Sostenga la jeringa por el cuerpo, no por el émbolo. Desenrosque el tapón de la jeringa girándola en sentido contrario a las agujas del reloj. |
| Para insertar la aguja, conecte la base al adaptador luer-locky gírelo un cuarto de vuelta en el sentido de las agujas del reloj hasta que sienta que se bloquea. No saque el émbolo de la jeringa del cuerpo. Si esto ocurre, no administre la vacuna. |
Eliminación de residuos
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a CERVARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: INYECTABLE, 20 µg / 20 µgPrincipio activo: papillomavirus (human types 16, 18)Fabricante: Glaxosmithkline BiologicalsRequiere recetaForma farmacéutica: INYECTABLEPrincipio activo: papillomavirus (human types 16, 18)Fabricante: Glaxosmithkline BiologicalsRequiere recetaForma farmacéutica: INYECTABLEPrincipio activo: papillomavirus (human types 16, 18)Fabricante: Glaxosmithkline BiologicalsRequiere receta
Médicos online para CERVARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de CERVARIX SUSPENSION INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes