
ADYNOVI 3000 UI/5 ML POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar ADYNOVI 3000 UI/5 ML POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
ADYNOVI 250 UI/5 ml polvo y disolvente para solución inyectable
ADYNOVI 500 UI/5 ml polvo y disolvente para solución inyectable
ADYNOVI 1 000 UI/5 ml polvo y disolvente para solución inyectable
ADYNOVI 2 000 UI/5 ml polvo y disolvente para solución inyectable
ADYNOVI 3000 UI/5 ml polvo y disolvente para solución inyectable
rurioctocog alfa pegol (factor VIII humano de coagulación recombinante pegilado)
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es ADYNOVI y para qué se utiliza
- Qué necesita saber antes de empezar a usar ADYNOVI
- Cómo usar ADYNOVI
- Posibles efectos adversos
- Conservación de ADYNOVI
- Contenido del envase e información adicional
1. Qué es ADYNOVI y para qué se utiliza
ADYNOVI contiene el principio activo rurioctocog alfa pegol, factor VIII humano de coagulación pegilado. El factor VIII humano de coagulación se ha modificado para prolongar la duración de su acción. El factor VIII es necesario para que la sangre forme coágulos y para detener las sangrados. En los pacientes con hemofilia A (falta congénita de factor VIII) no está presente o no actúa de forma correcta.
ADYNOVI se utiliza para el tratamiento y la prevención del sangrado en pacientes a partir de 12 años con hemofilia A (un trastorno hemorrágico hereditario provocado por la ausencia de factor VIII)
2. Qué necesita saber antes de empezar a usar ADYNOV
No use ADYNOVi
- si es alérgico a rurioctocog alfa pegol, octocog alfa o a alguno de los demás componentes de este medicamento (incluidos en la sección 6)
- si es alérgico a las proteínas de ratón o hámster
Si tiene alguna duda, consulte a su médico.
Advertencias y precauciones
Es importante mantener un registro del número de lote de su ADYNOVI. Por lo tanto, cada vez que obtenga un nuevo envase de ADYNOVI, anote la fecha y el número de lote (que está en el cartonaje después de la abreviatura “Lote”) y guarde esta información en un lugar seguro.
Consulte a su médico antes de empezar a usar ADYNOVI.
Existe un riesgo muy pequeño de que sufra una reacción anafiláctica (una reacción alérgica grave repentina) a ADYNOVI. Debe conocer los signos iniciales de las reacciones alérgicas, tales como erupción, habón urticarial, ronchas, picor generalizado, hinchazón de labios y lengua, dificultad para respirar, ruidos al respirar (sibilancia), opresión en el pecho, sensación de malestar general y mareo. Estos podrían ser síntomas iniciales de shock anafiláctico. Otros síntomas pueden incluir mareo intenso, pérdida de conciencia y mucha dificultad para respirar.
Si aparece alguno de estos síntomas, interrumpa de forma inmediata la inyección y consulte a su médico. Los síntomas graves, como la dificultad para respirar y el (pre)desmayo, necesitan tratamiento urgente.
Si sufre de alguna enfermedad cardíaca, informe a su médico, ya que existe un riesgo mayor de complicaciones por formación de coágulos en la sangre.
Pacientes que desarrollan inhibidores del factor VIII
La formación de inhibidores (anticuerpos) es una complicación conocida que se puede producir durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, en especial en grandes cantidades, impiden que el tratamiento funcione de forma correcta, por lo que a usted y a su hijo se les controlará cuidadosamente por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se está controlando con ADYNOVI, consulte a su médico de forma inmediata.
Complicaciones relacionadas con el catéterSi necesita utilizar un catéter venoso central (CVC), se debe tener en cuenta el riesgo de complicaciones relacionadas con dicho dispositivo, tales como infecciones locales, presencia de bacterias en sangre y trombosis en la zona del catéter.
Niños y adolescentes
ADYNOVI solo se puede utilizar en adolescentes y adultos (mayores de 12 años). Las advertencias y precauciones que se indican también se aplican a los adolescentes
Otros medicamentos y ADYNOVI
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. La hemofilia A afecta solo en raras ocasiones a las mujeres. Por tanto, no se dispone de experiencia en relación con el uso de ADYNOVI durante el embarazo y la lactancia
Conducción y uso de máquinas
La influencia de ADYNOVI sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
ADYNOVI contiene sodio
ADYNOVI contiene hasta 12,42 mg de sodio (componente principal de la sal de mesa/para cocinar) por vial. Esto equivale al 0,62 % de la ingesta diaria máxima de sodio recomendada para un adulto. Dependiendo de su peso corporal y de su dosis de ADYNOVI, podría recibir más de un vial. Esto debe ser tenido en cuenta si usted sigue una dieta baja en sal.
3. Cómo usar ADYNOVI
El tratamiento con ADYNOVI lo iniciará y supervisará un médico con experiencia en el tratamiento de pacientes con hemofilia A.
Su médico calculará su dosis de ADYNOVI en función de su estado y peso corporal y de si se utiliza para la prevención o para el tratamiento del sangrado. La frecuencia de la administración dependerá de cómo actúe ADYNOVI en su caso. El tratamiento de sustitución con ADYNOVI es normalmente un tratamiento de por vida.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Prevención del sangrado
La dosis habitual de ADYNOVI es de 40 a 50 UI por kg de peso corporal, administrada 2 veces por semana.
Tratamiento del sangrado
La dosis de ADYNOVI se calcula en función de su peso corporal y de los niveles de factor VIII que se quieren conseguir. Los niveles de factor VIII a alcanzar dependerán de la gravedad y de la localización del sangrado.
Consulte a su médico si cree que el efecto de ADYNOVI es insuficiente.
Su médico le realizará los análisis de laboratorio adecuados para asegurarse que tiene los niveles adecuados de factor VIII. Esto es, especialmente, importante si se va a someter a cirugía mayor.
Uso en niños y adolescentes
ADYNOVI solo se puede utilizar en adolescentes y adultos (mayores de 12 años). La dosis para los adolescentes se calcula también según el peso corporal y es la misma que para los adultos.
Cómo se administra ADYNOVI
Normalmente el médico o el enfermero inyectan ADYNOVI en una vena (vía intravenosa). Usted o cualquier otra persona pueden administrar también la inyección de ADYNOVI pero solo después de recibir la formación adecuada. Las instrucciones detalladas para la autoadministración se describen al final de este prospecto.
Si usa más ADYNOVI del que debe
Siga exactamente las instrucciones de administración de ADYNOVI indicadas por su médico. Consulte a su médico si tiene dudas. Si se inyecta una dosis mayor de ADYNOVI de la recomendada, consulte con su médico lo antes posible.
Si olvidó usar ADYNOVI
No se inyecte una dosis doble para compensar las dosis olvidadas. Adminístrese la siguiente inyección como está establecido y continúe como le había indicado su médico.
Si interrumpe el tratamiento con ADYNOVI
No deje de usar ADYNOVI sin consultarlo con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si se producen reacciones alérgicas (anafilácticas) graves y repentinas, se debe parar de forma inmediata la inyección. Contacte con su médico de forma inmediatasi tiene alguno de los siguientes síntomas iniciales de las reacciones alérgicas:
- erupción, habón urticarial, ronchas, picor generalizado,
- hinchazón de labios y lengua,
- dificultad para respirar, ruidos al respirar, opresión en el pecho,
- sensación de malestar general,
- mareo y pérdida de conciencia.
Los síntomas graves, como la dificultad para respirar y el (casi)desmayo, necesitan un tratamiento urgente inmediato
En los pacientes que han recibido tratamiento previo con factor VIII (más de 150 días de tratamiento), se pueden formar anticuerpos inhibidores (ver sección 2) con poca frecuencia (menos de 1 de cada 100 pacientes). Si esto sucede, el medicamento que toma puede dejar de funcionar correctamente y usted puede sufrir un sangrado persistente. En ese caso, contacte con su médico de forma inmediata.
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
Cefalea
Efectos secundarios frecuentes(pueden afectar hasta 1 de cada 10 personas)
Náuseas
Diarrea
Erupción
Mareo
Habón urticarial
Efectos adversos poco frecuentes(pueden afectar hasta 1 de cada 100 personas)
Rubefacción, reacción alérgica (hipersensibilidad)
Inhibidores del factor VIII (para pacientes que hayan recibido tratamiento anterior con factor VIII (más de 150 días de tratamiento))
Aumento de algún tipo de glóbulos blancos
Reacción a la perfusión
Enrojecimiento del ojo
Reacción adversa al fármaco de la piel
Otros efectos adversos en niños
Se espera que la frecuencia, el tipo y la gravedad de las reacciones adversas en los niños sean los mismos que en los adultos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de ADYNOVI
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 ºC y 8 ºC).
No congelar.
Conservar blíster en el embalaje exterior para protegerlo de la luz.
Durante su periodo de validez, el vial de polvo se puede conservar a temperatura ambiente (hasta30 ºC) durante un periodo único que no supere los 3 meses. En ese caso, este medicamento caduca al final de este periodo de 3 meses o en la fecha de caducidad impresa en el vial de producto, lo que ocurra antes. Por favor, anote en el envase exterior la fecha de finalización del periodo de conservación a temperatura ambiente de 3 meses. El medicamento no se puede refrigerar de nuevo después de conservarse a temperatura ambiente. No refrigerar el medicamento después de la preparación.
Utilizar el medicamento en un plazo de 3 horas tras la disolución completa del polvo.
Este medicamento es para un solo uso. Eliminar la solución no utilizada de forma adecuada
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de ADYNOVI
- El principio activo es rurioctocog alfa pegol (factor VIII humano de coagulación producido mediante tecnología de DNA recombinante). Cada vial de polvo contienenominalmente 250, 500, 1 000, 2 000 o 3000 UI de rurioctocog alfa pegol.
- El vial de disolvente contiene 5 ml de agua para preparaciones inyectables.
- Los demás ingredientes son manitol, dihidrato de trehalosa, histidina, glutatión, cloruro sódico, cloruro cálcico dihidratado, tris(hidroximetil)aminometano y polisorbato 80. Ver sección 2 “ADYNOVI contiene sodio”.
Aspecto del producto y contenido del envase
ADYNOVI se suministra en forma de polvo y disolvente para solución inyectable (polvo para solución inyectable). El polvo es un polvo de color blanco a blanquecino que se desmenuza. El disolvente es una solución incolora transparente. Después de su reconstitución, la solución es transparente, incolora y libre de partículas extrañas.
Titular de la autorización de comercialización
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Viena
Fabricante
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B-7860 Lessines
Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Takeda Belgium NV Tel/Tél: +32 2 464 06 11 | Lietuva Takeda, UAB Tel: +370 521 09 070 |
| Luxembourg/Luxemburg Takeda Belgium NV Tel/Tél: +32 2 464 06 11 |
Ceská republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel: +420 234 722 722 | Magyarország Takeda Pharma Kft. Tel: +36 1 270 7030 |
Danmark Takeda Pharma A/S Tlf: +45 46 77 10 10 | Malta Τakeda HELLAS S.A. Tel: +30 210 6387800 |
Deutschland Takeda GmbH Tel: +49 (0)800 825 3325 | Nederland Takeda Nederland B.V. Tel: +31 20 203 5492 |
Eesti Takeda Pharma AS Tel: +372 6177 669 | Norge Takeda AS Tlf: +47 800 800 30 |
Ελλáδα Τakeda ΕΛΛΑΣ Α.Ε. Tηλ: +30 210 6387800 | Österreich Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 [email protected] |
España Takeda Farmacéutica España, S.A Tel: +34 917 90 42 22 | Polska Takeda Pharma Sp. z o.o. tel: +48223062447 |
France Takeda France SAS Tel. + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Hrvatska Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | România Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Ireland Takeda Products Ireland Ltd Tel: 1800 937 970 |
|
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel: +421 (2) 20 602 600 |
Italia Takeda Italia S.p.A. Tel: +39 06 502601 | Suomi/Finland Takeda Oy Puh/Tel: 0800 774 051 |
Κ?προς Proton Medical (Cyprus) Ltd Τηλ: +357 22866000 | Sverige Takeda Pharma AB Tel: 020 795 079 |
Latvija Takeda Latvia SIA Tel: +371 67840082 | United Kingdom (Northern Ireland) Takeda UK Ltd Tel: +44 (0) 2830 640 902 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos: http://www.ema.europa.eu/
Instrucciones para la preparación y administración
ADYNOVI no se debe mezclar con otros medicamentos ni disolventes.
Se recomienda de forma encarecida registrar el nombre y el número de lote del producto cada vez que se administre ADYNOVI. El blíster lleva etiquetas que se pueden quitar.
Instrucciones para la reconstitución
- No utilizar después de la fecha de caducidad que aparece en las etiquetas y el envase.
- No utilizar si la tapa del blíster no está perfectamente sellada.
- No refrigerar el medicamento después de la preparación.
- Si el medicamento se encuentra todavía en la nevera, coger de la nevera el blíster sellado (contiene los viales de polvo y disolvente preensamblados en el sistema para su reconstitución) y esperar a que alcance la temperatura ambiente (entre 15 °C y 25 °C).
- Lavar las manos con jabón y agua templada.
- Abrir el blíster de ADYNOVI quitando la tapa. Sacar el sistema BAXJECT III del blíster.
- Colocar el vial de polvo en una superficie plana con el vial de disolvente encima (Figura 1). El vial de disolvente tiene una raya azul. No quitar el protector azul hasta que se le indique más adelante.
- Mientras sujeta el vial de polvo con una mano en el sistema BAXJECT III, presionar con fuerza el vial de disolvente con la otra mano hasta que el sistema quede totalmente contraído y el disolvente entre dentro del vial de polvo (Figura 2). No inclinar el sistema hasta que haya finalizado la transferencia.
- Comprobar que ha finalizado la transferencia del disolvente. Agitar con suavidad hasta que todo el material se haya disuelto (Figura 3). Comprobar que el polvo esté completamente disuelto; si no es así, toda la solución reconstituida no pasará a través del filtro del dispositivo. El medicamento se disuelve rápidamente (normalmente en menos de 1 minuto). Tras la reconstitución la solución debe ser transparente, incolora y libre de partículas extrañas.
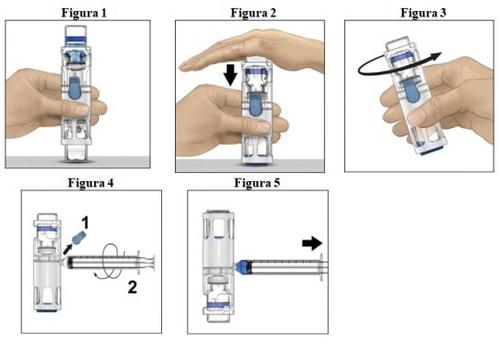
Instrucciones para la inyección
Durante la administración, se necesita una técnica antiséptica (en condiciones de limpieza y pocos gérmenes).
Nota importante:
- Examinar la solución preparada para detectar partículas o cambios de color antes de la administración (la solución debe ser transparente, incolora y libre de partículas).
No utilizar si la solución no es totalmente transparente o el producto no está disuelto completamente.
- Quitar el protector azul del dispositivo BAXJECT III (Figura 4). No introducir aire en la jeringa. Conectar la jeringa al BAXJECT III. Se recomienda utilizar una jeringa Luer-lock.
- Dar la vuelta al sistema (el vial de polvo estará ahora en la parte superior). Introducir la solución reconstituida en la jeringa, tirando del émbolo hacia atrás lentamente (Figura 5).
- Desconecte la jeringa, conecte una aguja de palomilla a la jeringa e inyectar la solución reconstituida en una vena. La solución se debe administrar lentamente, a una velocidad determinada de acuerdo con el nivel de comodidad del paciente, que no supere los 10 ml por minuto. (Ver sección 4 "Posibles efectos adversos").
- Eliminar la solución no utilizada de forma apropiada.
Esta información está destinada únicamente a profesionales del sector sanitario
Tratamiento a demanda
En el caso de los episodios de sangrado siguientes, la actividad de factor VIII no debe ser inferior al nivel de actividad plasmática dada (en % de la normalidad o UI/dl) en el periodo correspondiente. La siguiente tabla se puede utilizar como guía posológica en cirugía y en los episodios de sangrado:
Tabla 1: Guía posológica de dosificación en episodios de sangrado y cirugía
Grado de sangrado/tipo de procedimiento quirúrgico | Nivel de factor VIII requerido (% o UI/dl) | Frecuencia de las dosis (horas)/duración del tratamiento (días) |
HemorragiaHemartrosis incipiente o sangrado muscular u oral. | 20 – 40 | Repetir las inyecciones cada 12 a 24 horas. Al menos 1 día, hasta que el episodio de sangrado se haya resuelto, en función del dolor, o hasta que se produzca la cicatrización. |
Hemartrosis más extensa, sangrado muscular o hematoma | 30 – 60 | Repetir las inyecciones cada 12 a 24 horas durante 3–4 días o más hasta que el dolor y la discapacidad aguda se hayan resuelto. |
Hemorragias potencialmente mortales. | 60 – 100 | Repetir las inyecciones cada 8 a 24 horas hasta que el riesgo desaparezca. |
Cirugía Menor Incluyendo extracción dental | 30 – 60 | Cada 24 horas al menos 1 día, hasta que se produzca la cicatrización. |
Mayor | 80 – 100 (pre y posoperatorio) | Repetir las inyecciones cada 8 a 24 horas hasta que la herida cicatrice de forma adecuada y después continuar el tratamiento al menos otros 7 días para mantener una actividad de factor VIII del 30 % al 60 % (UI/dl). |
Profilaxis
Para la profilaxis a largo plazo, la dosis recomendada es de 40 a 50 UI de ADYNOVI por kg de peso corporal dos veces a la semana a intervalos de 3 a 4 días. Los ajustes de las dosis y los intervalos de administración se pueden considerar basados en niveles de factor VIII obtenidos y en la tendencia hemorrágica individual.
Población pediátrica
La posología del tratamiento a demanda en los pacientes pediátricos (12 a 18 años de edad) es la misma que para los pacientes adultos. El tratamiento profiláctico para pacientes de 12 a <18 años es el mismo que para los pacientes adultos. No se ha establecido todavía la seguridad a largo plazo de ADYNOVI en niños menores de 12 años. Los ajustes de las dosis y los intervalos de administración se pueden considerar basados en niveles de factor VIII obtenidos y en la tendencia hemorrágica individual.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a ADYNOVI 3000 UI/5 ML POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere recetaForma farmacéutica: INYECTABLE, 1.500 UIPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere recetaForma farmacéutica: INYECTABLE, 1000 UI - tras reconstitución en 2 ml de agua para inyectables la dosis es de 500 UI/mlPrincipio activo: factor de coagulación VIIIFabricante: Takeda Manufacturing Austria AgRequiere receta
Médicos online para ADYNOVI 3000 UI/5 ML POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de ADYNOVI 3000 UI/5 ML POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes

















