
Willfact 500 j.m.
Zapytaj lekarza o receptę na Willfact 500 j.m.

Jak stosować Willfact 500 j.m.
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA
Willfact 500 j.m.
proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Willfact 1000 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Willfact 2000 j.m. proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
ludzki czynnik von Willebranda
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku ponieważ zawiera ona
informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Willfact i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Willfact
- 3. Jak stosować lek Willfact
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Willfact
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Willfact i w jakim celu się go stosuje
Lek Willfact jest wytwarzany z ludzkiego osocza (płynnej części krwi) i zawiera substancję czynną o nazwie
ludzki czynnik von Willebranda (vWF).
Czynnik vWF bierze udział w krzepnięciu krwi. Brak tego czynnika, jak ma to miejsce np. w przebiegu
choroby von Willebranda, powoduje, że krew nie krzepnie tak szybko, jak powinna, a więc występuje
zwiększona tendencja do krwawień. Zastąpienie vWF lekiem Willfact tymczasowo naprawia mechanizmy
krzepnięcia krwi.
Lek Willfact jest wskazany w zapobieganiu krwawieniom związanym z zabiegami chirurgicznymi i innym
krwawieniom oraz leczeniu ich u pacjentów z rozpoznaniem choroby von Willebranda, jeśli leczenie jedynie
desmopresyną (DDAVP) jest nieskuteczne lub przeciwwskazane.
Lek Willfact może być stosowany we wszystkich grupach wiekowych.
Leku Willfact nie należy stosować w leczeniu hemofilii typu A.
2. Informacje ważne przed zastosowaniem leku Willfact
Kiedy nie stosować leku Willfact
- Jeśli pacjent ma uczulenie na ludzki czynnik von Willebranda lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
- Jeśli u pacjenta rozpoznano hemofilię typu A.
Ostrzeżenia i środki ostrożności
Leczenie lekiem Willfact powinien zawsze nadzorować lekarzz doświadczeniem w leczeniu zaburzeń
krzepnięcia krwi.
Jeśli u pacjenta występują silne krwawienia, a badanie krwi potwierdzi zmniejszenie ilości czynnika VIII,
pacjent otrzyma preparat czynnika krzepnięcia VIII i dodatkowo preparat vWF w ciągu pierwszych 12
godzin.
Reakcje alergiczne
Mogą wystąpić reakcje nadwrażliwości o charakterze reakcji alergicznej,podobnie jak po podaniu
innych białkowych dożylnych leków otrzymywanych z ludzkiej krwi lub osocza.
Pacjent będzie monitorowany podczas wstrzyknięcia w celu wykrycia wczesnych objawów nadwrażliwości.
Obejmują one wysypkę (pokrzywka bądź pokrzywka uogólniona), uczucie ucisku w klatce piersiowej,
świszczący oddech, zmniejszenie ciśnienia krwi (niedociśnienie) i ciężkie reakcje alergiczne (anafilaksja).
Lekarz poinformuje pacjenta o ostrzegawczych objawach świadczących o wystąpieniu reakcji alergicznej.
W przypadku wystąpienia objawów przedmiotowych lub podmiotowych nadwrażliwości należy przerwać
leczenie i natychmiast zgłosić się po pomoc lekarską.
Bezpieczeństwo wirusowe
W przypadku wytwarzania leków z ludzkiej krwi lub osocza stosowane są pewne środki zapobiegające
przenoszeniu zakażeń na pacjentów. Zaliczają się do nich:
- dokładny dobór dawców krwi i osocza, pozwalający wykluczyć osoby będące w grupie ryzyka zakażeń,
- badanie każdej oddanej partii oraz puli osocza pod kątem występowania wirusa/zakażeń,
- wprowadzenie w procesie przetwarzania krwi lub osocza kroków pozwalających inaktywować lub usunąć wirusy.
Pomimo stosowania tych środków podczas podawania leków wyprodukowanych z krwi lub osocza ludzkiego
nie można całkowicie wykluczyć możliwości przeniesienia zakażenia. Dotyczy to także nieznanych lub nowo
pojawiających się wirusów bądź zakażeń innego typu.
Podejmowane środki uznawane są za skuteczne w przypadku wirusów otoczkowych, takich jak ludzki wirus
niedoboru odporności (HIV, powodujący AIDS), wirus zapalenia wątroby typu B i wirus zapalenia wątroby
typu C.
Podejmowane środki mają ograniczoną wartość w przypadku wirusów bezotoczkowych, takich jak wirus
zapalenia wątroby typu A i parwowirus B19. Zakażenie parwowirusem B19 może być poważne w przypadku
kobiet w ciąży (ponieważ występuje ryzyko zakażenia nienarodzonego dziecka) i pacjentów z osłabionym
układem odpornościowym lub pewnego typu niedokrwistością (np. niedokrwistością sierpowatokrwinkową
lub niedokrwistością hemolityczną).
Szczepienia
Lekarz może zalecić pacjentowi przyjęcie szczepionek przeciwko wirusowemu zapaleniu wątroby typu A
oraz typu B, jeśli pacjent regularnie/powtarzalnie przyjmuje wytwarzany z osocza ludzki czynnik von
Willebranda.
Rejestrowanie numeru serii
Zdecydowanie zaleca się, by przy podawaniu każdej dawki leku Willfact zapisywać imię i nazwisko pacjenta
oraz numer serii leku, aby udokumentować, jakie serie leku podano.
Ryzyko zakrzepicy
Może dojść do zablokowania naczyń krwionośnych przez zakrzepy krwi (zakrzepica). Zagrożenie jest
szczególnie duże, jeśli w wywiadzie lekarskim lub badaniach laboratoryjnych stwierdzono określone
czynniki ryzyka. W takim przypadku stan pacjenta będzie bardzo dokładnie obserwowany w kierunku
wczesnych objawów zakrzepicy. Należy również podać leki zapobiegające (profilaktyka) zablokowaniu
naczyń krwionośnych przez zakrzepy krwi.
Lekarz stosujący czynnik krzepnięcia VIII zawierający czynnik von Willebranda powinien pamiętać, że
kontynuacja leczenia może powodować nadmierne zwiększenie aktywności czynnika VIII. Jeśli pacjent
otrzyma preparat vWF zawierający czynnik krzepnięcia VIII, lekarz powinien regularnie monitorować
aktywność czynnika VIII w osoczu. Uchroni to pacjenta przed nadmierną aktywnością czynnika VIII w
osoczu, która może zwiększyć ryzyko wystąpienia zdarzeń zakrzepowych.
Ograniczenie skuteczności
U pacjentów z chorobą von Willebranda (szczególnie typu 3) mogą tworzyć się białka neutralizujące
działanie czynnika von Willebranda. Takie białka nazywa się przeciwciałami neutralizującymi lub
inhibitorami. Lekarz sprawdzi, czy w organizmie pacjenta powstają inhibitory vWF, jeśli wyniki badań
laboratoryjnych wykażą brak prawidłowego przywrócenia stężeń vWF lub jeśli krwawienia nie zmniejszą się
mimo stosowania odpowiedniej dawki leku Willfact. Jeśli występuje duże stężenie inhibitorów, wówczas
leczenie vWF może nie być skuteczne. W takich przypadkach należy rozważyć inne metody leczenia. Nową
terapię przeprowadzi lekarz z doświadczeniem w leczeniu zaburzeń krzepnięcia krwi.
Lek Willfact a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta obecnie lub
ostatnio, a także o lekach, które pacjent planuje stosować.
Ciąża i karmienie piersią
Lek Willfact można stosować u kobiet w ciąży lub karmiących piersią wyłącznie, jeśli jest to jednoznacznie
wskazane.
Nie prowadzono kontrolowanych badań klinicznych oceniających bezpieczeństwo stosowania leku Willfact u
kobiet w ciąży i karmiących piersią, a badania na zwierzętach nie wystarczają do potwierdzenia
bezpieczeństwa stosowania w kontekście płodności, ciąży i rozwoju dziecka podczas ciąży i po porodzie.
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie obserwowano wpływu na zdolność do prowadzenia pojazdów lub obsługiwania maszyn.
Lek Willfact zawiera sód
Jedna fiolka z 5 ml (500 j.m.) leku Willfact zawiera 0,15 mmol (3,4 mg) sodu.
Odpowiada to 0,17% zalecanego maksymalnego dziennego spożycia sodu dla osoby dorosłej.
Jedna fiolka z 10 ml (1000 j.m.) leku Willfact zawiera 0,3 mmol (6,9 mg) sodu.
Odpowiada to 0,35% zalecanego maksymalnego dziennego spożycia sodu dla osoby dorosłej.
Jedna fiolka z 20 ml (2000 j.m.) leku Willfact zawiera 0,6 mmol (13,8 mg) sodu.
Odpowiada to 0,69% zalecanego maksymalnego dziennego spożycia sodu dla osoby dorosłej.
3. Jak stosować lek Willfact
Leczenie powinien rozpoczynać i monitorować lekarz z doświadczeniem w leczeniu zaburzeń krwotocznych.
Jeśli lekarz uzna, że pacjent może podawać lek w domu, odpowiednio poinstruuje on pacjenta.
Dawkowanie
Ten lek należy zawsze przyjmować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić się
do lekarza.
Najlepiej, gdy lek Willfact podaje lekarz lub pielęgniarka. Jeśli jednak pacjent otrzymał lek Willfact do
stosowania w domu, lekarz upewni się, że pacjent zostanie poinformowany o sposobie wykonywania
wstrzyknięcia i właściwej dawce leku. Należy przestrzegać zaleceń lekarza i poprosić o pomoc w przypadku
problemów z używaniem strzykawki. Strzykawka może być używana wyłącznie przez przeszkoloną do tego
osobę.
Lekarz wyliczy właściwą dawkę leku Willfact (wyrażoną w jednostkach międzynarodowych — j.m.).
Dawka zależy od:
- masy ciała,
- miejsca krwawienia,
- nasilenia krwawienia,
- stanu klinicznego pacjenta,
- konieczności przeprowadzenia zabiegu,
- aktywności vWF we krwi po przeprowadzeniu zabiegu,
- nasilenia choroby.
Dawka zawiera się w zakresie 40–80 j.m./kg mc.
Lekarz zaleci wykonywanie w trakcie leczenia badań krwi pod kątem:
- stężenia czynnika VIII (FVIII:C),
- stężenia czynnika von Willebranda (vWF:RCo),
- obecności inhibitorów,
- początkowych objawów powstawania skrzepów - u pacjentów w grupie ryzyka wystąpienia takich powikłań.
Na podstawie wyników tych badań lekarz może dostosować częstość wykonywania wstrzyknięć i podawaną
dawkę.
W pewnych przypadkach niezbędne może być zastosowanie preparatu czynnika VIII (innego białka o
działaniu koagulacyjnym) w dodatku do leku Willfact, aby umożliwić szybsze leczenie lub zapobiegnięcie
krwawieniu (w sytuacjach nagłych lub w przypadku ostrego krwawienia).
Lek Willfact można również stosować w długotrwałej profilaktyce, wówczas dawkę także ustala się
indywidualnie. Podawanie leku Willfact w dawce 40–60 j.m./kg mc. od dwóch do trzech razy w tygodniu
zmniejsza liczbę epizodów krwawienia.
Jeżeli pacjent uważa, że lek Willfact działa zbyt mocno lub zbyt słabo, należy zwrócić się do lekarza.
Stosowanie u dzieci i młodzieży
Dawkowanie u dzieci i młodzieży opiera się na masie ciała. W niektórych przypadkach, szczególnie
u młodszych pacjentów (poniżej 6 lat), konieczne może być zastosowanie wyższych dawek (maksymalnie do
100 j.m./kg mc.).
Sposób podawania
Szczegółowe instrukcje dotyczące rekonstytucji i podawania produktu leczniczego zamieszczono na końcu
ulotki.
Zastosowanie większej niż zalecana dawki leku Willfact
Nie zgłaszano objawów przedawkowania leku Willfact, jednak w przypadku podania dużej ilości nie można
wykluczyć ryzyka zakrzepicy.
Pominięcie zastosowania leku Willfact
W przypadku pominięcia zastosowania leku Willfact należy zwrócić się do lekarza.
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku, należy zwrócić się do
lekarza, farmaceuty lub pielęgniarki.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Należy natychmiast skontaktować się z lekarzem w następujących przypadkach:
- Wystąpienie objawów nadwrażliwości lub reakcji alergicznych (obserwowane niezbyt często, mogą dotyczyć do 1 na 100 pacjentów). W niektórych przypadkach takie reakcje mogą przekształcić się w ciężką reakcję alergiczną (anafilaksję), w tym we wstrząs anafilaktyczny (obserwowany z nieznaną częstością).
Ostrzegawcze objawy świadczące o wystąpieniu reakcji alergicznej to:
- trudności z oddychaniem i przełykaniem,
- świszczący oddech,
- ucisk w klatce piersiowej,
- przyspieszenie akcji serca,
- spadek ciśnienia krwi,
- omdlenie,
- skrajne zmęczenie,
- niepokój, nerwowość,
- ból głowy,
- dreszcze, uczucie zimna,
- uderzenia gorąca,
- obrzęk różnych części ciała,
- wysypka skórna, pokrzywka uogólniona,
- uczucie pieczenia i kłucia w miejscu podania,
- mrowienie,
- wymioty,
- nudności.
Jeśli wystąpi jeden z tych objawów, należy natychmiast przerwać leczenie i powiadomić lekarza,aby
rozpocząć odpowiednie leczenie, w zależności od rodzaju i stopnia nasilenia reakcji.
- Zauważenie zaniku właściwego działania leku (brak kontroli krwawienia). Może to wynikać z hamowania czynnika von Willebranda (obserwowane z nieznaną częstością).
U pacjentów z chorobą von Willebranda, zwłaszcza typu 3, możliwe jest powstawanie białek
neutralizujących działanie vWF. Białka takie nazywa się przeciwciałami neutralizującymi lub inhibitorami.
Pacjenci leczeni vWF powinni być dokładnie monitorowani przez lekarza pod kątem wystąpienia inhibitorów
na drodze odpowiedniej obserwacji klinicznej i wykonywania badań laboratoryjnych. W przypadku
pojawienia się inhibitorów stan taki może objawiać się występowaniem niewystarczającej odpowiedzi
klinicznej. Może on też współwystępować z ciężkimi reakcjami alergicznymi.
- Zauważenie objawów zaburzeń krążenia w kończynach (np. zimne i blade kończyny) lub ważnych narządach (np. dotkliwy ból w klatce piersiowej). Może to wynikać z tworzenia się skrzepów krwi w naczyniach krwionośnych (obserwowane z nieznaną częstością).
Istnieje ryzyko powstawania skrzepów krwi (zakrzepicy), zwłaszcza u pacjentów w grupie ryzyka. Po
skorygowaniu niedoboru czynnika von Willebranda pacjentów należy monitorować pod kątem wczesnych
objawów zakrzepicy lub rozsianego wykrzepiania naczyniowego i zastosować leczenie zapobiegające
zakrzepicy w sytuacjach, w których ryzyko jej wystąpienia jest podwyższone (po zabiegach, w przypadku
pacjentów leżących, w przypadku niedoboru inhibitora koagulacji lub enzymu fibrynolitycznego).
Jeżeli pacjent przyjmuje preparaty vWF zawierające FVIII, ryzyko zakrzepicy może być wyższe ze względu
na trwale podwyższone stężenia FVIII w osoczu.
Poniższe działania niepożądane obserwowano często(mogą dotyczyć do 1 na 10 pacjentów):
- reakcje w miejscu podania wlewu.
Poniższe działania niepożądane obserwowano niezbyt często(mogą dotyczyć do 1 na 100 pacjentów):
- zawroty głowy,
- parestezja, niedoczulica,
- uderzenia gorąca,
- świąd,
- uczucie ucisku w klatce piersiowej,
- dreszcze, uczucie zimna.
Poniższe działania niepożądane obserwowano z nieznaną częstością występowania:
- gorączka.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w
ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie, lub pielęgniarce. Działania niepożądane można
zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Willfact
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie fiolki i pudełku.
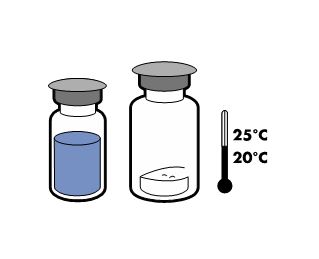
Nie przechowywać w temperaturze powyżej 25°C. Przechowywać w oryginalnym opakowaniu w celu
ochrony przed światłem.
Nie zamrażać.
W celu zachowania jałowości produkt zużyć bezpośrednio po rekonstytucji. Wykazano jednak stabilność
chemiczną i fizyczną produktu po przechowywaniu przez 24 godz. w 25°C.
Nie stosować tego leku, jeśli zauważy się zmętnienie lub cząstki stałe w roztworze.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Willfact
Substancją czynnąjest ludzki czynnik von Willebranda (500 j.m., 1000 j.m., 2000 j.m.) wyrażony w
jednostkach międzynarodowych aktywności kofaktora rystocetyny (vWF:RCo).
Po rekonstytucji z 5 ml (500 j.m.), 10 ml (1000 j.m.) albo 20 ml (2000 j.m.) wody do wstrzykiwań, jedna
fiolka zawiera w przybliżeniu 100 j.m./ml ludzkiego czynnika von Willebranda.
Przed dodaniem albuminy aktywność swoista roztworu wynosi co najmniej 60 j.m. vWF:RCo na 1 mg białka
całkowitego.
Pozostałe składniki:
Proszek: albumina ludzka, argininy chlorowodorek, glicyna, sodu cytrynian i wapnia chlorek dwuwodny.
Rozpuszczalnik: woda do wstrzykiwań.
Jak wygląda lek Willfact i co zawiera opakowanie
Lek Willfact jest dostarczany w postaci białego lub bladożółtego proszku albo kruchego ciała stałego i
przejrzystego, bezbarwnego rozpuszczalnika do sporządzania roztworu do wstrzykiwań po rekonstytucji za
pomocą systemu do przenoszenia.
Dostępne wielkości opakowań leku Willfact to 500 j.m./5 ml, 1000 j.m./10 ml, 2000 j.m./20 ml.
Roztwór po rekonstytucji powinien być przejrzysty lub lekko opalizujący, bezbarwny do nieznacznie
żółtawego.
Podmiot odpowiedzialny i wytwórca
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANCJA
[email protected]
Wytwórcy
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANCJA
LFB-BIOMEDICAMENTS
59 Rue de Trévise
59000 LILLE
FRANCJA
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego i w Zjednoczonym Królestwie (Irlandii Północnej) pod następującymi nazwami:
Austria
Willfact
Czechy
WILLFACT
Dania
Willfact
Hiszpania
Willfact
Niemcy
WILLFACT
Norwegia
Willfact
Polska
Willfact
Słowacja
Willfact
Szwecja
Willfact
Węgry
Willfact
Zjednoczone Królestwo (Irlandia Północna)
Willfact
Data ostatniej aktualizacji ulotki:
- 01.2024 ________________________________________________________________________________________
INSTRUKCJA UŻYTKOWANIA:
Dawkowanie
W ogólności podanie 1 j.m./kg mc. czynnika von Willebranda powoduje wzrost aktywności krążącego
vWF:RCo o około 0,02 j.m./ml (2%).
Należy dążyć do uzyskania stężeń vWF:RCo wynoszącego >0,6 j.m./ml (60%) i FVIII:C wynoszącego >0,4
j.m./ml (40%).
Uzyskanie hemostazy jest niepewne do momentu uzyskania aktywności koagulacyjnej czynnika VIII
(FVIII:C) wynoszącej 0,4 j.m./ml (40%). Wstrzyknięcie samego czynnika von Willebranda nie powoduje
maksymalnego zwiększenia aktywności FVIII:C przez co najmniej 6–12 godz. Nie wystarcza ono do
natychmiastowej normalizacji aktywności FVIII:C. Z tego względu jeśli więc wyjściowa aktywność FVIII:C
u pacjenta jest poniżej wartości krytycznej, a konieczne jest szybkie skorygowanie hemostazy — jak np. w
ramach leczenia krwotoku, ciężkiego urazu lub podczas przeprowadzania nagłego zabiegu operacyjnego — z
pierwszym wstrzyknięciem czynnika von Willebranda należy podać czynnik VIII, aby móc uzyskać
aktywność FVIII:C w osoczu zapewniającą hemostazę.
Jeśli jednak natychmiastowe zwiększenie aktywności FVIII:C nie jest konieczne — np. w przypadku
planowego zabiegu operacyjnego — lub jeśli wyjściowa aktywność FVIII:C pozwala na utrzymanie
hemostazy, lekarz może podjąć decyzję o pominięciu podania FVIII wraz z pierwszym wstrzyknięciem
czynnika von Willebranda.
- Rozpoczęcie leczenia: Pierwsza dawka leku Willfact wynosi 40-80 j.m./kg mc. w przypadku leczenia krwawienia lub urazu. Jest ona podawana w skojarzeniu z wymaganą ilością produktu zawierającego czynnik VIII, wyliczoną na podstawie wyjściowej aktywności FVIII:C w osoczu pacjenta, pozwalającą uzyskać właściwą aktywność FVIII:C w osoczu, bezpośrednio przed zabiegiem lub tak szybko, jak to tylko możliwe po rozpoczęciu epizodu krwawienia lub wystąpienia ciężkiego urazu. W przypadku zabiegu operacyjnego pierwsze wstrzyknięcie należy podać na godzinę przed zabiegiem. Podanie początkowej dawki 80 j.m./kg mc. leku Willfact może być konieczne zwłaszcza u pacjentów z chorobą von Willebranda typu 3, w przypadku której utrzymanie właściwej aktywności może wymagać dawek wyższych niż w przypadku pozostałych typów vWD.
W przypadku planowego zabiegu operacyjnego pierwsze wstrzyknięcie leku Willfact powinno być podane na
12–24 godz. przed zabiegiem, a drugie wstrzyknięcie — bezpośrednio przed zabiegiem. W takich
przypadkach jednoczesne podawanie preparatu czynnika VIII nie jest konieczne, ponieważ przed zabiegiem
stężenie endogennego FVIII:C zwykle osiąga krytyczną wartość 0,4 j.m./ml (40%). Należy to jednak
potwierdzić u każdego z pacjentów.
- Kolejne wstrzyknięcia: W razie potrzeby należy kontynuować leczenie lekiem Willfact w monoterapii w dawce 40-80 j.m./kg mc. na dobę w 1 albo 2 wstrzyknięciach dziennie przez jeden do kilku dni. Dawka i częstość podawania wstrzyknięć powinny być zawsze dostosowane do typu zabiegu, stanu klinicznego i biologicznego (vWF:RCo i FVIII:C) pacjenta oraz rodzaju i nasilenia epizodu krwawienia.
- Profilaktyka długoterminowa: Lek Willfact może być podawany w ramach profilaktyki długoterminowej w dawce dostosowanej indywidualnie do każdego pacjenta. Lek Willfact w dawce 40-60 j.m./kg mc. podawanej 2-3 razy w tygodniu ogranicza liczbę epizodów krwawienia.
- Leczenie ambulatoryjne: Za zgodą lekarza, zwłaszcza w przypadku pomniejszego lub umiarkowanego krwawienia lub długoterminowej profilaktyki krwawień można rozpocząć leczenie domowe.
Dzieci i młodzież
Wielkość dawki w przypadku każdego wskazania opiera się na masie ciała. Dawkę i długość leczenia należy
dostosować do stanu klinicznego pacjenta oraz stężeń vWF:RCo i FVIII:C w osoczu.
- Rozpoczęcie leczenia
- U dzieci w wieku poniżej 6 lat dawka początkowa może być ustalana na podstawie odzysku przyrostowego (IR) u pacjenta albo, w przypadku gdy dane IR nie są dostępne, konieczna może być dawka początkowa równa od 60 do 100 j.m./kg mc. w celu zwiększenia stężenia vWF:RCo u pacjenta do 100 j.m./dl.
- U dzieci w wieku powyżej 6 lat i młodzieży dawkowanie jest takie samo, jak u dorosłych pacjentów.
- Kolejne wstrzyknięcia U dzieci i młodzieży kolejne dawki należy ustalać indywidualnie w zależności od stanu klinicznego i stężenia vWF:RCo oraz dostosować je do odpowiedzi klinicznej.
Zabieg operacyjny w trybie planowym
- U dzieci w wieku poniżej 6 lat po pierwszej dawce podanej 12 do 24 godzin przed zabiegiem powtórną dawkę można podać 30 minut przed zabiegiem.
- U dzieci w wieku powyżej 6 lat i młodzieży dawkowanie jest takie samo, jak u dorosłych pacjentów.
- Profilaktyka U dzieci i młodzieży dawkę i częstość ponownego podawania należy ustalić indywidualnie w zależności od odzysku przyrostowego i stężenia vWF:RCo u pacjenta oraz dostosować do odpowiedzi klinicznej.
Sposób i droga podania
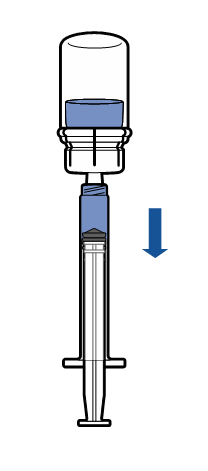
Podanie dożylne
Rekonstytucja
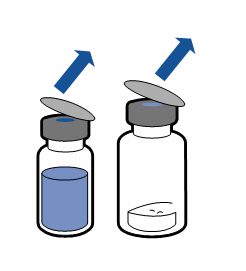
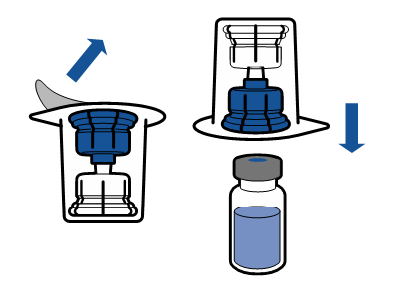
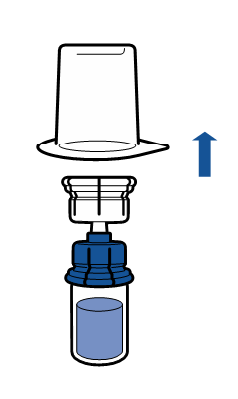
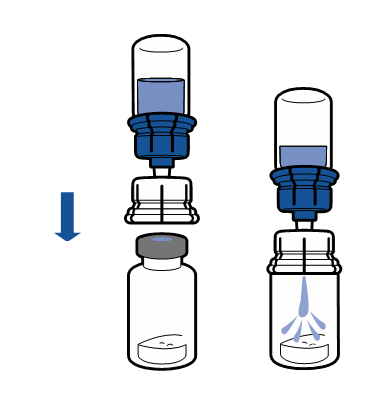
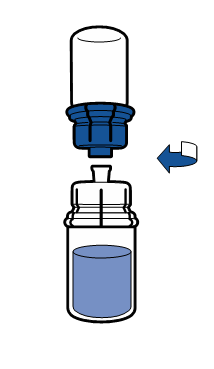
Należy przestrzegać aktualnych zaleceń dotyczących aseptycznej techniki pracy. System do przenoszenia stosuje się wyłącznie do rekonstytucji leku, zgodnie z opisem poniżej. System nie jest przeznaczony do podawania leku pacjentowi.
  |
|
    |
|
Proszek powinien rozpuścić się w czasie krótszym niż 5 minut, na ogół rozpuszcza się natychmiast.
Powstały roztwór powinien być przezroczysty lub lekko opalizujący, bezbarwny lub lekko żółty. Przed
podaniem zrekonstytuowany produkt należy skontrolować wizualnie pod kątem występowania cząstek stałych
i przebarwień.
Nie używać roztworu mętnego lub zawierającego osad.
Nie mieszać z innymi lekami.
Nie rozcieńczać produktu po rekonstytucji.
Podawanie
 |
|
Przechowywanie po rekonstytucji
W celu zachowania jałowości produkt zużyć bezpośrednio po rekonstytucji. Wykazano jednak stabilność
chemiczną i fizyczną produktu po przechowywaniu przez 24 godz. w 25°C.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyNie
- Producent
- ImporterLFB-Biomedicamensts LFB-Biomedicaments
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Willfact 500 j.m.Postać farmaceutyczna: Proszek, 1000 j.m.Substancja czynna: von Willebrand factorProducent: LFB-Biomedicamensts LFB-BiomedicamentsBez receptyPostać farmaceutyczna: Proszek, 2000 j.m./20 mlSubstancja czynna: von Willebrand factorProducent: LFB-Biomedicamensts LFB-BiomedicamentsBez receptyPostać farmaceutyczna: Proszek, 1000 j.m.Substancja czynna: coagulation factor VIIIProducent: CSL Behring GmbHWymaga recepty
Odpowiedniki Willfact 500 j.m. w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Willfact 500 j.m. – Hiszpania
Lekarze online w sprawie Willfact 500 j.m.
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Willfact 500 j.m. – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














