

Priorix

Zapytaj lekarza o receptę na Priorix

Jak stosować Priorix
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla użytkownika
Priorix,proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Szczepionka przeciw odrze, śwince i różyczce, żywa
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Szczepionkę przepisano ściśle określonej osobie. Nie należy jej przekazywać innym.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4. Treść tej ulotki została sformułowana zgodnie z założeniem, że będzie ona czytana przez osobę otrzymującą szczepionkę. Ponieważ jednak szczepionka ta może być podawana dorosłym i dzieciom, jest możliwe, że z treścią ulotki zapoznawać się będzie rodzic lub opiekun dziecka.
Spis treści ulotki:
- 1. Co to jest szczepionka Priorix i w jakim celu się ją stosuje
- 2. Informacje ważne przed zastosowaniem szczepionki Priorix
- 3. Jak stosować szczepionkę Priorix
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać szczepionkę Priorix
- 6. Zawartość opakowania i inne informacje
1. Co to jest szczepionka Priorix i w jakim celu się ją stosuje
Priorix jest szczepionką stosowaną u dzieci po ukończeniu 9. miesiąca życia, młodzieży oraz osób
dorosłych w celu zapobiegania odrze, śwince i różyczce.
Jak działa Priorix
System immunologiczny (naturalny system ochronny organizmu) osoby, której podano szczepionkę
Priorix będzie wytwarzał przeciwciała, dzięki czemu pacjent będzie chroniony przed infekcją
wirusami odry, świnki i różyczki.
Mimo iż szczepionka Priorix zawiera żywe wirusy, są one zbyt słabe, by powodować zachorowanie na
odrę, świnkę i różyczkę u zdrowych osób.
2. Informacje ważne przed zastosowaniem szczepionki Priorix
Kiedy nie stosować szczepionki Priorix:
- jeśli kiedykolwiek wystąpiła reakcja uczuleniowa na jakikolwiek składnik tej szczepionki (wymieniony w punkcie 6). Wśród objawów uczulenia należy wymienić swędzącą wysypkę skórną, trudności w oddychaniu, obrzęk twarzy lub języka,
- jeśli kiedykolwiek wystąpiła reakcja alergiczna na neomycynę (antybiotyk). Kontaktowe zapalenie skóry wywołane przez neomycynę (wysypka skórna w sytuacji, gdy występuje bezpośredni kontakt z alergenem takim jak neomycyna) nie stanowi przeciwwskazania do stosowania szczepionki, ale należy poinformować o tym lekarza,
- jeśli występuje ostra i ciężka choroba przebiegająca z gorączką. W takim przypadku szczepienie zostanie odłożone do czasu wyzdrowienia. Łagodna infekcja, taka jak np. przeziębienie, nie powinna być przeciwwskazaniem do szczepienia, ale należy najpierw porozmawiać o tym z lekarzem,
- jeśli występuje jakakolwiek choroba (np. zakażenie ludzkim wirusem niedoboru odporności (HIV) lub zespół nabytego niedoboru odporności (AIDS)) lub jeśli pacjent przyjmuje leki, które mogą osłabić układ immunologiczny. To, czy pacjent otrzyma szczepionkę będzie zależeć od poziomu odporności,
- jeśli stwierdzono ciążę. Ponadto należy unikać ciąży przez 1 miesiąc po szczepieniu.
Ostrzeżenia i środki ostrożności
Przed podaniem szczepionki Priorix należy omówić to z lekarzem lub farmaceutą jeśli:
- pacjent cierpi na zaburzenia ośrodkowego układu nerwowego, drgawki z towarzyszącą wysoką gorączką lub jeśli w jego rodzinie kiedykolwiek wystąpiły drgawki. W przypadku wystąpienia wysokiej gorączki po szczepieniu należy niezwłocznie skonsultować się z lekarzem,
- u pacjenta kiedykolwiek wystąpiła ciężka reakcja alergiczna na białko jaja kurzego,
- u pacjenta wystąpiły działania niepożądane po szczepieniu przeciwko odrze, śwince lub różyczce obejmujące łatwe powstawanie siniaków lub krwawienie dłuższe niż zwykle (patrz punkt 4),
- pacjent ma osłabiony układ immunologiczny (np. w przypadku zakażenia wirusem HIV). Pacjenta należy poddać ścisłej obserwacji z uwagi na to, że odpowiedź na szczepionkę może nie być wystarczająca do zapewnienia ochrony przed chorobą (patrz punkt 2 „Kiedy nie stosować szczepionki Priorix”).
Po lub nawet przed podaniem każdej szczepionki w postaci wstrzyknięcia może dojść do omdlenia
(szczególnie u młodzieży). W związku z tym należy poinformować lekarza lub pielęgniarkę, jeżeli u
pacjenta kiedyś wystąpiło omdlenie podczas podawania zastrzyku.
Jeśli pacjent zostanie zaszczepiony w ciągu 72 godzin od kontaktu z osobą chorą na odrę, szczepionka
Priorix w pewnym zakresie może zapewnić ochronę przed zachorowaniem.
Dzieci w wieku poniżej 12 miesięcy
Dzieci zaszczepione w pierwszym roku życia mogą nie być w pełni chronione. Jeśli konieczne będzie
podanie dodatkowych dawek szczepionki, lekarz zaleci ich podanie.
Tak jak w przypadku wszystkich szczepionek, szczepionka Priorix może nie w pełni chronić
wszystkie zaszczepione osoby.
Szczepionka Priorix a inne leki
Należy powiedzieć lekarzowi o wszystkich szczepieniach oraz lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach lub szczepionkach, które pacjent planuje przyjmować.
Szczepionka Priorix może zostać podana w tym samym czasie co inne szczepionki, takie jak:
szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa), szczepionka przeciw zakażeniom
Haemophilus influenzaetypu b, doustna lub inaktywowana szczepionka przeciw polio, szczepionka
przeciw wirusowemu zapaleniu wątroby typu A, szczepionka przeciw wirusowemu zapaleniu wątroby
typu B, szczepionka przeciw ospie wietrznej, szczepionka przeciw meningokokom grupy B, a także
skoniugowana szczepionka przeciw meningokokom serogrupy C, szczepionka skoniugowana
przeciwko meningokokom grup A, C, W135 i Y oraz skoniugowana szczepionka przeciw
pneumokokom. W celu uzyskania dodatkowych informacji należy skontaktować się z lekarzem lub
pielęgniarką.
Każda szczepionka powinna być wstrzyknięta w inne miejsce.
Jeżeli Priorix nie może być podany w tym samym czasie co inne szczepionki zawierające żywe,
atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami.
Szczepienie może zostać odroczone na co najmniej 3 miesiące, jeśli pacjent ostatnio miał przetaczaną
krew lub otrzymał ludzką immunoglobulinę.
Jeżeli u pacjenta ma być przeprowadzony test tuberkulinowy (skórne badanie w kierunku gruźlicy),
należy go wykonać przed lub równocześnie z podaniem szczepionki albo po upływie 6 tygodni od
szczepienia.
Ciąża, karmienie piersią i wpływ na płodność
Szczepionki Priorix nie powinno się podawać kobietom w ciąży .
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tej szczepionki.
Ponadto ważne jest, aby przez miesiąc po zaszczepieniu pacjentka nie zaszła w ciążę. W tym czasie
należy stosować skuteczną metodę antykoncepcji w celu uniknięcia ciąży.
Nieumyślne podanie szczepionki Priorix kobiecie w ciąży nie powinno być powodem przerwania
ciąży.
Priorix zawiera sorbitol, kwas para-aminobenzoesowy, fenyloalaninę, sód i potas
Ta szczepionka zawiera 9 mg sorbitolu w każdej dawce.
Priorix zawiera kwas para-aminobenzoesowy. Może powodować reakcje alergiczne (możliwe reakcje
typu późnego) i wyjątkowo skurcz oskrzeli.
Szczepionka zawiera 334 mikrogramy fenyloalaniny w każdej dawce. Fenyloalanina może być
szkodliwa dla pacjentów z fenyloketonurią (PKU), rzadką chorobą genetyczną, w której fenyloalanina
gromadzi się w organizmie, ponieważ organizm nie usuwa jej w odpowiedni sposób.
Ta szczepionka zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy szczepionkę uznaje się za
„wolną od sodu”.
Ta szczepionka zawiera potas, mniej niż 1 mmol (39 mg) potasu na dawkę, to znaczy szczepionkę uznaje
się za „wolną od potasu”.
3. Jak stosować szczepionkę Priorix
Szczepionkę Priorix podaje się podskórnie lub domięśniowo, w górną część ramienia lub zewnętrzną
część uda.
Priorix jest przeznaczony do stosowania u dzieci po ukończeniu 9. miesiąca życia, młodzieży oraz
osób dorosłych.
Odpowiedni moment szczepienia oraz liczba podawanych dawek zostanie określona przez lekarza w
oparciu o oficjalne zalecenia.
Szczepionki w żadnym wypadku nie należy podawać donaczyniowo.
4. Możliwe działania niepożądane
Jak każdy lek, ta szczepionka może powodować działania niepożądane, chociaż nie u każdego one
wystąpią.
Po podaniu szczepionki Priorix podczas badań klinicznych wystąpiły następujące działania
niepożądane:
♦
Bardzo często (mogą wystąpić częściej niż 1 na 10 dawek szczepionki):
- Zaczerwienienie w miejscu podania
- Gorączka (38°C lub wyższa)
♦
Często (mogą wystąpić rzadziej niż 1 na 10 dawek szczepionki):
- Ból i obrzęk w miejscu podania
- Gorączka (wyższa niż 39,5 C)
- Wysypka
- Zakażenie górnych dróg oddechowych
♦
Niezbyt często (mogą wystąpić rzadziej niż 1 na 100 dawek szczepionki):
- Zapalenie ucha środkowego
- Powiększenie węzłów chłonnych (węzły w okolicach szyi, pachy lub pachwiny)
- Utrata apetytu
- Nerwowość
- Nietypowy płacz
- Bezsenność
- Zaczerwienienie, podrażnienie lub łzawienie oczu (zapalenie spojówek)
- Zapalenie oskrzeli
- Kaszel
- Obrzęk ślinianek przyusznych (węzłów chłonnych w okolicy policzka)
- Biegunka
- Wymioty
♦
Rzadko (mogą wystąpić rzadziej niż 1 na 1000 dawek szczepionki):
- Drgawki z towarzyszącą wysoką temperaturą
- Reakcje alergiczne
Po wprowadzeniu szczepionki do obrotu bardzo rzadko zgłaszano występowanie następujących
działań niepożądanych:
- ból stawów i mięśni
- krwawienia lub łatwiejsze niż zwykle powstawanie sińców spowodowane spadkiem liczby płytek krwi
- nagłe reakcje alergiczne zagrażające życiu
- infekcja lub zapalenie mózgu, rdzenia kręgowego oraz nerwów obwodowych skutkujące przejściowymi trudnościami w chodzeniu (chwiejność) i/albo przejściową utratą koordynacji ruchowej, zapalenie niektórych nerwów z możliwym uczuciem mrowienia lub utratą czucia albo zaburzeniami ruchu (zespół Guillain-Barré)
- zwężenie lub niedrożność naczyń krwionośnych
- rumień wielopostaciowy (objawem są czerwone, często swędzące kropki, podobne do wysypki występującej w przebiegu odry, pojawiające się najpierw na kończynach oraz czasami na twarzy i innych częściach ciała)
- objawy podobne do odry i świnki (w tym przejściowy, bolesny obrzęk jąder oraz obrzęknięte gruczoły na szyi)
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: 22 49 21 301
Faks: 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać szczepionkę Priorix
Szczepionkę należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tej szczepionki po upływie terminu ważności zamieszczonego na opakowaniu
zewnętrznym.
Przechowywać i przewozić w stanie schłodzonym (2˚C – 8˚C).
Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Po rekonstytucji szczepionkę należy niezwłocznie podać. Jeśli nie jest to możliwe, powinna ona być
przechowywana w lodówce (2 C – 8 C) i zużyta w ciągu 8 godzin od momentu rekonstytucji.
Leków nie należy wrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera szczepionka Priorix
Substancjami czynnymi szczepionki są: żywe, atenuowane wirusy: odry, świnki i różyczki.
Pozostałe składniki szczepionki to:
Proszek: aminokwasy (w tym fenyloalanina), laktoza (bezwodna), mannitol (E 421), sorbitol (E 420),
medium 199 (w tym fenyloalanina, kwas para-aminobenzoesowy, sód i potas).
Rozpuszczalnik: woda do wstrzykiwań.
Jak wygląda szczepionka Priorix i co zawiera opakowanie
Szczepionka Priorix występuje jako proszek i rozpuszczalnik do sporządzania roztworu do
wstrzykiwań (proszek w jednodawkowej fiolce oraz rozpuszczalnik w ampułce (0,5 ml)) –
opakowanie 100 sztuk.
Priorix jest dostarczany w postaci białawego do lekko różowego proszku, którego część może być
żółtawa do lekko pomarańczowej, i przejrzystego, bezbarwnego rozpuszczalnika (woda do
wstrzykiwań), które po rekonstytucji tworzą szczepionkę.
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89
1330 Rixensart, Belgia
Data ostatniej aktualizacji ulotki:07/2025
Inne źródła informacji
Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych .
------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość
wystąpienia rzadkiej reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki
medycznej bezpośrednio po szczepieniu.
Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem
szczepionki, gdyż mogą one powodować inaktywację atenuowanych wirusów zawartych w
szczepionce.
Szczepionka Priorix w żadnym wypadku nie powinna być podawana dożylnie.
Z uwagi na brak badań zgodności, szczepionka nie powinna być mieszana z innymi produktami
leczniczymi.
Rozpuszczalnik oraz szczepionkę po rekonstytucji należy ocenić wizualnie przed rekonstytucją oraz
przed podaniem pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku
stwierdzenia nieprawidłowości w wyglądzie, nie należy używać rozpuszczalnika lub przygotowanej
szczepionki.
Szczepionkę należy poddać rekonstytucji poprzez dodanie do fiolki z proszkiem całej objętości
rozpuszczalnika z ampułki. Następnie należy energicznie wstrząsnąć, do momentu całkowitego
rozpuszczenia proszku.
Pod wpływem niewielkich wahań pH, szczepionka po rekonstytucji może przybierać barwę od
brzoskwiniowej do różowej o odcieniu fuksji, co pozostaje bez wpływu na jej skuteczność.
Należy pobrać całą zawartość fiolki.
Do podania szczepionki należy użyć nowej igły.
Po rekonstytucji szczepionkę należy użyć natychmiast. Jeśli nie jest to możliwe, powinna być
przechowywana w temperaturze 2 ° C - 8 ° C i zużyta w ciągu 8 godzin od jej rozpuszczenia.
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z
lokalnymi przepisami.
Ulotka dołączona do opakowania: informacja dla użytkownika
Priorix,proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Szczepionka przeciw odrze, śwince i różyczce, żywa
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Szczepionkę przepisano ściśle określonej osobie. Nie należy jej przekazywać innym.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4. Treść tej ulotki została sformułowana zgodnie z założeniem, że będzie ona czytana przez osobę otrzymującą szczepionkę. Ponieważ jednak szczepionka ta może być podawana dorosłym i dzieciom, jest możliwe, że z treścią ulotki zapoznawać się będzie rodzic lub opiekun dziecka.
Spis treści ulotki:
- 1. Co to jest szczepionka Priorix i w jakim celu się ją stosuje
- 2. Informacje ważne przed zastosowaniem szczepionki Priorix
- 3. Jak stosować szczepionkę Priorix
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać szczepionkę Priorix
- 6. Zawartość opakowania i inne informacje
1. Co to jest szczepionka Priorix i w jakim celu się ją stosuje
Priorix jest szczepionką stosowaną u dzieci po ukończeniu 9. miesiąca życia, młodzieży oraz osób
dorosłych w celu zapobiegania odrze, śwince i różyczce.
Jak działa Priorix
System immunologiczny (naturalny system ochronny organizmu) osoby, której podano szczepionkę
Priorix będzie wytwarzał przeciwciała, dzięki czemu pacjent będzie chroniony przed infekcją
wirusami odry, świnki i różyczki.
Mimo iż szczepionka Priorix zawiera żywe wirusy, są one zbyt słabe, by powodować zachorowanie na
odrę, świnkę i różyczkę u zdrowych osób.
2. Informacje ważne przed zastosowaniem szczepionki Priorix
Kiedy nie stosować szczepionki Priorix:
- jeśli kiedykolwiek wystąpiła reakcja uczuleniowa na jakikolwiek składnik tej szczepionki (wymieniony w punkcie 6). Wśród objawów uczulenia należy wymienić swędzącą wysypkę skórną, trudności w oddychaniu, obrzęk twarzy lub języka,
- jeśli kiedykolwiek wystąpiła reakcja alergiczna na neomycynę (antybiotyk). Kontaktowe zapalenie skóry wywołane przez neomycynę (wysypka skórna w sytuacji, gdy występuje bezpośredni kontakt z alergenem takim jak neomycyna) nie stanowi przeciwwskazania do stosowania szczepionki, ale należy poinformować o tym lekarza,
- jeśli występuje ostra i ciężka choroba przebiegająca z gorączką. W takim przypadku szczepienie zostanie odłożone do czasu wyzdrowienia. Łagodna infekcja, taka jak np. przeziębienie, nie powinna być przeciwwskazaniem do szczepienia, ale należy najpierw porozmawiać o tym z lekarzem,
- jeśli występuje jakakolwiek choroba (np. zakażenie ludzkim wirusem niedoboru odporności (HIV) lub zespół nabytego niedoboru odporności (AIDS)) lub jeśli pacjent przyjmuje leki, które mogą osłabić układ immunologiczny. To, czy pacjent otrzyma szczepionkę będzie zależeć od poziomu odporności,
- jeśli stwierdzono ciążę. Ponadto należy unikać ciąży przez 1 miesiąc po szczepieniu.
Ostrzeżenia i środki ostrożności
Przed podaniem szczepionki Priorix należy omówić to z lekarzem lub farmaceutą jeśli:
- pacjent cierpi na zaburzenia ośrodkowego układu nerwowego, drgawki z towarzyszącą wysoką gorączką lub jeśli w jego rodzinie kiedykolwiek wystąpiły drgawki. W przypadku wystąpienia wysokiej gorączki po szczepieniu należy niezwłocznie skonsultować się z lekarzem,
- u pacjenta kiedykolwiek wystąpiła ciężka reakcja alergiczna na białko jaja kurzego,
- u pacjenta wystąpiły działania niepożądane po szczepieniu przeciwko odrze, śwince lub różyczce obejmujące łatwe powstawanie siniaków lub krwawienie dłuższe niż zwykle (patrz punkt 4),
- pacjent ma osłabiony układ immunologiczny (np. w przypadku zakażenia wirusem HIV). Pacjenta należy poddać ścisłej obserwacji z uwagi na to, że odpowiedź na szczepionkę może nie być wystarczająca do zapewnienia ochrony przed chorobą (patrz punkt 2 „Kiedy nie stosować szczepionki Priorix”).
Po lub nawet przed podaniem każdej szczepionki w postaci wstrzyknięcia może dojść do omdlenia
(szczególnie u młodzieży). W związku z tym należy poinformować lekarza lub pielęgniarkę, jeżeli u
pacjenta kiedyś wystąpiło omdlenie podczas podawania zastrzyku.
Jeśli pacjent zostanie zaszczepiony w ciągu 72 godzin od kontaktu z osobą chorą na odrę, szczepionka
Priorix w pewnym zakresie może zapewnić ochronę przed zachorowaniem.
Dzieci w wieku poniżej 12 miesięcy
Dzieci zaszczepione w pierwszym roku życia mogą nie być w pełni chronione. Jeśli konieczne będzie
podanie dodatkowych dawek szczepionki, lekarz zaleci ich podanie.
Tak jak w przypadku wszystkich szczepionek, szczepionka Priorix może nie w pełni chronić
wszystkie zaszczepione osoby.
Szczepionka Priorix a inne leki
Należy powiedzieć lekarzowi o wszystkich szczepieniach oraz lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach lub szczepionkach, które pacjent planuje przyjmować.
Szczepionka Priorix może zostać podana w tym samym czasie co inne szczepionki, takie jak:
szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa), szczepionka przeciw zakażeniom
Haemophilus influenzaetypu b, doustna lub inaktywowana szczepionka przeciw polio, szczepionka
przeciw wirusowemu zapaleniu wątroby typu A, szczepionka przeciw wirusowemu zapaleniu wątroby
typu B, szczepionka przeciw ospie wietrznej, szczepionka przeciw meningokokom grupy B, a także
skoniugowana szczepionka przeciw meningokokom serogrupy C, szczepionka skoniugowana
przeciwko meningokokom grup A, C, W135 i Y oraz skoniugowana szczepionka przeciw
pneumokokom. W celu uzyskania dodatkowych informacji należy skontaktować się z lekarzem lub
pielęgniarką.
Każda szczepionka powinna być wstrzyknięta w inne miejsce.
Jeżeli Priorix nie może być podany w tym samym czasie co inne szczepionki zawierające żywe,
atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami.
Szczepienie może zostać odroczone na co najmniej 3 miesiące, jeśli pacjent ostatnio miał przetaczaną
krew lub otrzymał ludzką immunoglobulinę.
Jeżeli u pacjenta ma być przeprowadzony test tuberkulinowy (skórne badanie w kierunku gruźlicy),
należy go wykonać przed lub równocześnie z podaniem szczepionki albo po upływie 6 tygodni od
szczepienia.
Ciąża, karmienie piersią i wpływ na płodność
Szczepionki Priorix nie powinno się podawać kobietom w ciąży .
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tej szczepionki.
Ponadto ważne jest, aby przez miesiąc po zaszczepieniu pacjentka nie zaszła w ciążę. W tym czasie
należy stosować skuteczną metodę antykoncepcji w celu uniknięcia ciąży.
Nieumyślne podanie szczepionki Priorix kobiecie w ciąży nie powinno być powodem przerwania
ciąży.
Priorix zawiera sorbitol, kwas para-aminobenzoesowy, fenyloalaninę, sód i potas
Ta szczepionka zawiera 9 mg sorbitolu w każdej dawce.
Priorix zawiera kwas para-aminobenzoesowy. Może powodować reakcje alergiczne (możliwe reakcje
typu późnego) i wyjątkowo skurcz oskrzeli.
Szczepionka zawiera 334 mikrogramy fenyloalaniny w każdej dawce. Fenyloalanina może być
szkodliwa dla pacjentów z fenyloketonurią (PKU), rzadką chorobą genetyczną, w której fenyloalanina
gromadzi się w organizmie, ponieważ organizm nie usuwa jej w odpowiedni sposób.
Ta szczepionka zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy szczepionkę uznaje się za
„wolną od sodu”.
Ta szczepionka zawiera potas, mniej niż 1 mmol (39 mg) potasu na dawkę, to znaczy szczepionkę uznaje
się za „wolną od potasu”.
3. Jak stosować szczepionkę Priorix
Szczepionkę Priorix podaje się podskórnie lub domięśniowo, w górną część ramienia lub zewnętrzną
część uda.
Priorix jest przeznaczony do stosowania u dzieci po ukończeniu 9. miesiąca życia, młodzieży oraz
osób dorosłych.
Odpowiedni moment szczepienia oraz liczba podawanych dawek zostanie określona przez lekarza w
oparciu o oficjalne zalecenia.
Szczepionki w żadnym wypadku nie należy podawać donaczyniowo.
4. Możliwe działania niepożądane
Jak każdy lek, ta szczepionka może powodować działania niepożądane, chociaż nie u każdego one
wystąpią.
Po podaniu szczepionki Priorix podczas badań klinicznych wystąpiły następujące działania
niepożądane:
♦ Bardzo często (mogą wystąpić częściej niż 1 na 10 dawek szczepionki):
- Zaczerwienienie w miejscu podania
- Gorączka (38°C lub wyższa)
♦ Często (mogą wystąpić rzadziej niż 1 na 10 dawek szczepionki):
- Ból i obrzęk w miejscu podania
- Gorączka (wyższa niż 39,5 C)
- Wysypka
- Zakażenie górnych dróg oddechowych
♦ Niezbyt często (mogą wystąpić rzadziej niż 1 na 100 dawek szczepionki):
- Zapalenie ucha środkowego
- Powiększenie węzłów chłonnych (węzły w okolicach szyi, pachy lub pachwiny)
- Utrata apetytu
- Nerwowość
- Nietypowy płacz
- Bezsenność
- Zaczerwienienie, podrażnienie lub łzawienie oczu (zapalenie spojówek)
- Zapalenie oskrzeli
- Kaszel
- Obrzęk ślinianek przyusznych (węzły chłonne w okolicy policzka)
- Biegunka
- Wymioty
♦ Rzadko (mogą wystąpić rzadziej niż 1 na 1000 dawek szczepionki):
- Drgawki z towarzyszącą wysoką temperaturą
- Reakcje alergiczne
Po wprowadzeniu szczepionki do obrotu bardzo rzadko zgłaszano występowanie następujących
działań niepożądanych:
- ból stawów i mięśni
- krwawienia lub łatwiejsze niż zwykle powstawanie sińców spowodowane spadkiem liczby płytek krwi
- nagłe reakcje alergiczne zagrażające życiu
- infekcja lub zapalenie mózgu, rdzenia kręgowego oraz nerwów obwodowych skutkujące przejściowymi trudnościami w chodzeniu (chwiejność) i / albo przejściową utratą koordynacji ruchowej, zapalenie niektórych nerwów z możliwym uczuciem mrowienia lub utratą czucia albo zaburzeniami ruchu (zespół Guillain-Barré)
- zwężenie lub niedrożność naczyń krwionośnych
- rumień wielopostaciowy (objawem są czerwone, często swędzące kropki, podobne do wysypki występującej w przebiegu odry, pojawiające się najpierw na kończynach oraz czasami na twarzy i innych częściach ciała)
- objawy podobne do odry i świnki (w tym przejściowy, bolesny obrzęk jąder oraz obrzęknięte gruczoły na szyi)
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: 22 49 21 301
Faks: 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać szczepionkę Priorix
Szczepionkę należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tej szczepionki po upływie terminu ważności zamieszczonego na opakowaniu
zewnętrznym.
Przechowywać i przewozić w stanie schłodzonym (2˚C – 8˚C).
Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Po rekonstytucji szczepionkę należy niezwłocznie podać. Jeśli nie jest to możliwe, powinna ona być
przechowywana w lodówce (2 C – 8 C) i zużyta w ciągu 8 godzin od momentu rekonstytucji.
Leków nie należy wrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera szczepionka Priorix
Substancjami czynnymi szczepionki są żywe atenuowane wirusy: odry, świnki i różyczki.
Pozostałe składniki szczepionki to:
Proszek: aminokwasy (w tym fenyloalanina), laktoza (bezwodna), mannitol (E 421), sorbitol (E 420),
medium 199 (w tym fenyloalanina, kwas para-aminobenzoesowy, sód i potas).
Rozpuszczalnik: woda do wstrzykiwań.
Jak wygląda szczepionka Priorix i co zawiera opakowanie
Szczepionka Priorix występuje jako proszek i rozpuszczalnik do sporządzania roztworu do
wstrzykiwań (proszek w jednodawkowej fiolce oraz rozpuszczalnik w ampułko-strzykawce (0,5 ml)
z igłami lub bez igieł) w następujących wielkościach opakowań:
- z 2 oddzielnymi igłami: opakowania po 1 lub 10 sztuk,
- bez igieł: opakowania po 1 lub 10 sztuk.
Priorix jest dostarczany w postaci białawego do lekko różowego proszku, którego część może być
żółtawa do lekko pomarańczowej, i przejrzystego, bezbarwnego rozpuszczalnika (woda do
wstrzykiwań). Składniki te po rekonstytucji tworzą szczepionkę.
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89
1330 Rixensart, Belgia
Data ostatniejaktualizacji ulotki:07/2025
Inne źródła informacji
Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych .
------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość
wystąpienia rzadkiej reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki
medycznej bezpośrednio po szczepieniu.
Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem
szczepionki, gdyż mogą one powodować inaktywację atenuowanych wirusów zawartych w
szczepionce.
Szczepionka Priorix w żadnym wypadku nie powinna być podawana dożylnie.
Z uwagi na brak badań zgodności szczepionka nie powinna być mieszana z innymi produktami
leczniczymi.
Rozpuszczalnik oraz szczepionkę po rekonstytucji należy ocenić wizualnie przed rekonstytucją oraz
przed podaniem pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku
stwierdzenia nieprawidłowości w wyglądzie, nie należy używać rozpuszczalnika lub przygotowanej
szczepionki.
Szczepionkę należy poddać rekonstytucji poprzez dodanie całego rozpuszczalnika z ampułko-
strzykawki do fiolki z proszkiem.
Aby dołączyć igłę do ampułko-strzykawki należy uważnie zapoznać się z instrukcją przedstawioną
pod rysunkami 1 i 2. Ampułko-strzykawka dostarczana ze szczepionką PRIORIX może jednak różnić
się nieznacznie od przedstawionej na rysunku (może nie mieć gwintu do wkręcania igły). W takim
przypadku igła powinna być zamocowana bez wkręcania.
Igła
Ampułko-strzykawka
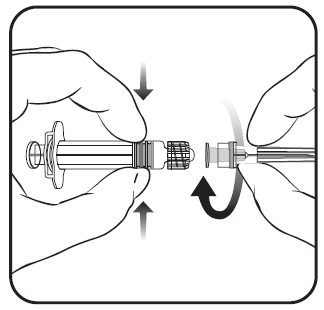
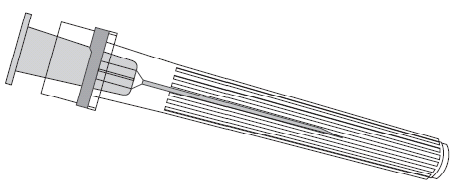
Należy zawsze trzymać ampułko-strzykawkę za jej korpus, nie za tłok ani za adapter Luer Lock (ang.
Luer Lock Adaptor, LLA), a igłę należy utrzymywać w osi ampułko-strzykawki (jak przedstawiono na
rysunku 2.). Niezastosowanie się do tych zaleceń może spowodować przekrzywienie adaptera LLA i
wyciek z ampułko-strzykawki.
Jeśli podczas przyłączania igły do ampułko-strzykawki dojdzie do odłączenia się adaptera LLA,
należy użyć nowej dawki szczepionki (nowej ampułko-strzykawki i fiolki).
Rysunek 1. Rysunek 2.
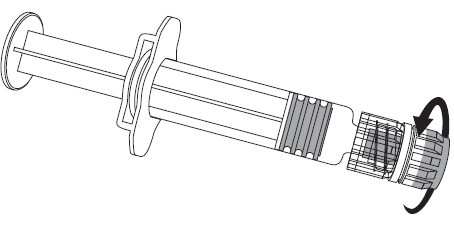
- 1. Należy odkręcić nasadkę ampułko-strzykawki poprzez przekręcenie jej w kierunku przeciwnym do ruchu wskazówek zegara (jak pokazano na rysunku 1.).
Niezależnie od tego, czy adapter LLA obraca się czy nie, należy postępować zgodnie z
poniższymi instrukcjami:
- 2. Należy przymocować igłę do ampułko-strzykawki poprzez delikatne przyłączenie nasadki igły do adaptera LLA i obrócenie jej ćwierć obrotu w kierunku zgodnym z ruchem wskazówek zegara, do chwili aż poczuje się zablokowanie igły (jak pokazano na rysunku 2).
- 3. Należy zdjąć osłonkę igły, która może stawiać opór.
- 4. Należy dodać rozpuszczalnik do proszku. Następnie należy energicznie wstrząsnąć, do momentu całkowitego rozpuszczenia proszku.
Zależnie od niewielkich wahań pH, szczepionka po rekonstytucji może przybierać barwę od
brzoskwiniowej do różowej o odcieniu fuksji, co pozostaje bez wpływu na jej skuteczność.
- 5. Należy pobrać całą zawartość fiolki.
- 6. Do podania szczepionki należy użyć nowej igły. W tym celu należy odkręcić igłę z ampułko- strzykawki i dołączyć igłę do wstrzykiwań, postępując zgodnie z opisem zawartym w punkcie
- 2.
Po rekonstytucji szczepionkę należy użyć natychmiast. Jeśli nie jest to możliwe, powinna być
przechowywana w temperaturze 2 ° C - 8 ° C i zużyta w ciągu 8 godzin od jej rozpuszczenia.
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z
lokalnymi przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterGlaxoSmithKline Biologicals S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki PriorixPostać farmaceutyczna: Proszek, -Substancja czynna: measles, combinations with mumps, rubella and varicella, live attenuatedWymaga receptyPostać farmaceutyczna: Proszek, -Substancja czynna: measles, combinations with mumps, rubella and varicella, live attenuatedProducent: GlaxoSmithKline Biologicals S.A.Wymaga receptyPostać farmaceutyczna: Zawiesina, 160 jednostek antygenowych ELISA wirusa zapalenia wątroby typu A, szczep GBM/0,5 ml; 1 dawka (0,5 ml)Substancja czynna: hepatitis A, inactivated, whole virusWymaga recepty
Odpowiedniki Priorix w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Priorix – Hiszpania
Odpowiednik Priorix – Ukraina
Lekarze online w sprawie Priorix
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Priorix – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














