Jak stosować Activelle
Ulotka dołączona do opakowania: informacja dla użytkownika
Activelle, 1 mg + 0,5 mg, tabletki powlekane
Estradiolum hemihydricum+ Norethisteroni acetas
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie nawet, jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Activelle i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Activelle
- 3. Jak stosować lek Activelle
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Activelle
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Activelle i w jakim celu się go stosuje
Activelle to lek do stosowania w ciągłej złożonej hormonalnej terapii zastępczej (HTZ). Lek zawiera
dwa żeńskie hormony płciowe: estrogen i progestagen. Lek Activelle jest stosowany u kobiet
po menopauzie, u których upłynął co najmniej rok od wystąpienia ostatniej naturalnej miesiączki.
Lek Activelle jest stosowany w celu:
złagodzenia objawów pojawiających się po menopauzie
W czasie menopauzy zmniejsza się ilość estrogenów produkowanych w organizmie kobiety, co może
powodować takie objawy jak uczucie gorąca na twarzy, szyi i klatce piersiowej („uderzenia gorąca”).
Activelle łagodzi te objawy po menopauzie. Lek Activelle może zostać zalecony pacjentce tylko, gdy
objawy znacznie utrudniają jej codzienne życie;
zapobiegania osteoporozie
Po menopauzie u niektórych kobiet rozwija się kruchość kości (osteoporoza). Wszystkie dostępne
możliwości należy przedyskutować z lekarzem.
Jeśli pacjentka jest narażona na zwiększone ryzyko złamań z powodu osteoporozy i inne leki nie są
odpowiednie, lek Activelle można stosować w celu zapobiegania osteoporozie po menopauzie.
Activelle jest wskazany u kobiet z zachowaną macicą i u kobiet, u których upłynął co najmniej rok
od ustania miesiączkowania.
Istnieje tylko ograniczone doświadczenie ze stosowaniem leku Activelle w leczeniu kobiet w wieku
powyżej 65 lat.
2. Informacje ważne przed zastosowaniem leku Activelle
Wywiad lekarski i regularne badania lekarskie
Stosowanie HTZ niesie ze sobą ryzyko, które powinno być rozważone przy podejmowaniu decyzji
o zastosowaniu hormonalnej terapii zastępczej lub jej kontynuowaniu.
Doświadczenie w leczeniu kobiet w okresie przedwczesnej menopauzy (z powodu niewydolności
jajników lub zabiegu chirurgicznego) jest ograniczone. Jeśli pacjentka przechodzi przedwczesną
menopauzę, ryzyko związane ze stosowaniem HTZ może się różnić. Należy porozmawiać z lekarzem.
Przed rozpoczęciem (lub wznowieniem) stosowania HTZ, lekarz powinien przeprowadzić wywiad
lekarski, w tym rodzinny. Lekarz może zdecydować o przeprowadzeniu badań lekarskich, w tym
badania piersi i (lub) badania ginekologicznego, jeśli są niezbędne.
Jeśli pacjentka rozpocznie stosowanie leku Activelle, powinna regularnie zgłaszać się na badania
lekarskie (przynajmniej raz w roku). Podczas tych badań, powinna rozważyć z lekarzem korzyści
i zagrożenia wynikające z kontynuacji stosowania leku Activelle.
Pacjentka powinna regularnie przechodzić badania mammograficzne, zgodnie z zaleceniami lekarza.
Kiedy nie stosować leku Activelle
W przypadku wystąpienia któregokolwiek z wymienionych poniżej schorzeń lub w razie wątpliwości
dotyczących stanów wymienionych poniżej, należypowiedzieć o tym lekarzowiprzed
zastosowaniem leku Activelle.
Nie należy rozpoczynać stosowania leku Activelle, jeśli:
- rozpoznano, występował w przeszłości lub podejrzewa się raka piersi;
- rozpoznano, występował w przeszłości lub podejrzewa się nowotwór zależny od estrogenów, np. rak błony śluzowej macicy (rak endometrium);
- występują niewyjaśnionekrwawienia z dróg rodnych;
- występuje nadmierny rozrost błony śluzowej trzonu macicy(hiperplazja endometrium) i nie jest on leczony;
- rozpoznano lub występowały w przeszłości zakrzepy krwi w żyłach(żylna choroba zakrzepowo-zatorowa), np. w żyłach kończyn dolnych (zakrzepica żył głębokich) lub płucach (zatorowość płucna);
- występuje zaburzenie krzepnięcia krwi(takie jak niedobór białka C, białka S lub antytrombiny);
- występują lub występowały w przeszłości choroby wywołane przez zakrzepy krwi w tętnicach, takie jak zawał mięśnia sercowego, udarlub dusznica bolesna;
- występuje lub występowała w przeszłości choroba wątroby, a wyniki prób wątrobowych nie powróciły do wartości prawidłowych;
- występuje rzadka, dziedziczna choroba krwi porfiria;
- pacjentka ma uczulenie(nadwrażliwość) na estradiol noretysteronu octanlub którykolwiek z pozostałych składników leku Activelle (wymienionych w punkcie 6. „Zawartość opakowania i inne informacje”).
Jeśli którekolwiek z powyższych schorzeń wystąpi po raz pierwszy podczas stosowania leku Activelle
należy przerwać jego przyjmowanie i natychmiast skontaktować się z lekarzem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem leczenia należy poinformować lekarza o występowaniu w przeszłości
któregokolwiek z wymienionych poniżej schorzeń, gdyż mogą one wystąpić ponownie lub nasilić się
w czasie stosowania leku Activelle. W takim przypadku lekarz może stwierdzić, że pacjentka wymaga
częstszego monitorowania:
- mięśniaki macicy (włókniaki macicy),
- rozrost błony śluzowej macicy poza jamą macicy (endometrioza) lub nadmierny rozrost błony śluzowej macicy (hiperplazja endometrium) w wywiadzie,
- czynniki zwiększające ryzyko zakrzepów krwi (patrz ”Zakrzepy krwi w żyłach (żylna choroba zakrzepowo-zatorowa)”),
- czynniki zwiększające ryzyko nowotworów estrogenozależnych (takich jak rak piersi u matki, siostry lub babki),
- wysokie ciśnienie tętnicze krwi,
- choroba wątroby, np. łagodny nowotwór wątroby,
- cukrzyca,
- kamica żółciowa,
- migrena lub silne bóle głowy,
- choroba układu immunologicznego mająca wpływ na wiele narządów (toczeń rumieniowaty układowy),
- padaczka,
- astma oskrzelowa,
- choroba ucha prowadząca do stopniowej utraty słuchu (otoskleroza),
- duże stężenie tłuszczów (trójglicerydów) we krwi,
- zatrzymywanie płynów spowodowane zaburzoną czynnością serca lub nerek,
- dziedziczny i nabyty obrzęk naczynioruchowy,
- nietolerancja laktozy.
W przypadku wystąpienia poniższych schorzeń podczas stosowania HTZ należy przerwać
stosowanie leku Activelle i natychmiast skontaktować się z lekarzem:
- jeśli wystąpi którekolwiek ze schorzeń wymienionych w punkcie ”Kiedy nie stosować leku Activelle”,
- jeśli skóra lub białkówki oczu zżółkną (żółtaczka), co może być objawem zaburzeń czynności wątroby,
- jeśli wystąpi obrzęk twarzy, języka i (lub) gardła, lub trudności z przełykaniem albo pokrzywka, jednocześnie z utrudnionym oddychaniem, które wskazują na obrzęk naczynioruchowy,
- jeśli wystąpi znaczące zwiększenie ciśnienia tętniczego krwi (objawami mogą być: ból głowy, zmęczenie i zawroty głowy),
- jeśli po raz pierwszy pojawi się ból głowy typu migrenowego,
- jeśli zostanie stwierdzona ciąża,
- jeśli wystąpią objawy zakrzepu krwi, takie jak:
- bolesny obrzęk i zaczerwienienie kończyn dolnych,
- nagły ból w klatce piersiowej,
- trudności w oddychaniu. W celu uzyskania dodatkowych informacji patrz punkt ”Zakrzepy krwi w żyłach (żylna choroba zakrzepowo-zatorowa)”.
Uwaga:Activelle nie jest środkiem antykoncepcyjnym. Jeżeli minęło mniej niż 12 miesięcy
od momentu wystąpienia ostatniej miesiączki lub pacjentka jest w wieku poniżej 50 lat, może
być konieczne zastosowanie dodatkowej metody zapobiegania ciąży. Należy zasięgnąć porady
lekarza.
HTZ i rak
Nadmierny rozrost błony śluzowej macicy (hiperplazja endometrium) i rak błony śluzowej macicy (rak endometrium)
Stosowanie wyłącznie estrogenów w HTZ zwiększa ryzyko nadmiernego rozrostu błony śluzowej
macicy (hiperplazja endometrium) i raka błony śluzowej macicy (rak endometrium).
Progestagen w leku Activelle pomaga zmniejszyć to dodatkowe ryzyko.
Nieregularne krwawienia
W czasie pierwszych 3 do 6 miesięcy przyjmowania leku Activelle mogą wystąpić nieregularne
krwawienia lub pojawić się krople krwi (plamienie).
Natomiast, jeżeli nieregularne krwawienie:
- utrzymuje się w czasie dłuższym niż przez pierwsze 6 miesięcy,
- wystąpi po stosowaniu leku Activelle przez dłużej niż 6 miesięcy,
- utrzymuje się pomimo zaprzestania stosowania leku Activelle, należy skontaktować się z lekarzem tak szybko, jak to jest możliwe.
Rak piersi
Dane potwierdzają, że przyjmowanie hormonalnej terapii zastępczej (HTZ) w postaci skojarzenia
estrogenu i progestagenu lub samego estrogenu zwiększa ryzyko wystąpienia raka piersi. Dodatkowe
ryzyko zależy od tego, jak długo pacjentka stosuje HTZ. To dodatkowe ryzyko ujawnia się po 3 latach
stosowania HTZ. Po zakończeniu HTZ dodatkowe ryzyko będzie się z czasem zmniejszać, ale ryzyko
może się utrzymywać przez 10 lat lub dłużej, jeśli HTZ trwała ponad 5 lat.
Porównanie
W przypadku kobiet w wieku od 50 do 54 lat, które nie stosują HTZ, rak piersi zostanie rozpoznany
u średnio 13 do 17 na 1000 kobiet w okresie 5 lat.
W przypadku kobiet w wieku 50 lat, które rozpoczną pięcioletnią estrogenową HTZ, liczba
zachorowań wyniesie 16–17 na 1000 pacjentek (tj. dodatkowe 0 do 3 przypadków).
W przypadku kobiet w wieku od 50 lat, które rozpoczną pięcioletnią estrogenowo-progestagenową
HTZ, liczba zachorowań wyniesie 21 na 1000 pacjentek (tj. dodatkowe 4 do 8 przypadków).
W przypadku kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, rak piersi zostanie rozpoznany
u średnio 27 na 1000 kobiet w okresie 10 lat.
W przypadku kobiet w wieku 50 lat, które rozpoczną 10-letnią estrogenową HTZ, liczba zachorowań
wyniesie 34 na 1000 pacjentek (tj. dodatkowe 7 przypadków).
W przypadku kobiet w wieku 50 lat, które rozpoczną 10-letnią estrogenowo-progestagenową HTZ,
liczba zachorowań wyniesie 48 na 1000 pacjentek (tj. dodatkowe 21 przypadków).
Należy regularnie badać piersi. Należy skontaktować się z lekarzem w przypadku zauważenia którejkolwiek ze zmian:
- zapadanie się skóry,
- zmiany w obrębie brodawki sutkowej,
- obecność guzków, które są widoczne lub wyczuwalne.
Dodatkowo, zaleca się udział w oferowanych programach przesiewowych badań mammograficznych.
Ważne jest, aby przed badaniem poinformować pielęgniarkę lub osobę z personelu medycznego, która
przeprowadza badanie rentgenowskie, o stosowaniu hormonalnej terapii zastępczej, ponieważ lek ten
może zwiększać gęstość piersi, co z kolei może wpłynąć na wynik badania mammograficznego. Nie
wszystkie guzki mogą zostać wykryte podczas badania mammograficznego w miejscach zwiększonej
gęstości piersi.
Nowotwór jajnika
Nowotwór jajnika występuje rzadko - znacznie rzadziej, niż nowotwór piersi. Stosowanie HTZ
obejmującej tylko estrogeny lub skojarzenie estrogenów i progestagenów wiąże się z nieznacznie
zwiększonym ryzykiem nowotworu jajnika.
Ryzyko nowotworu jajnika zależy od wieku. Na przykład u kobiet w wieku od 50 do 54 lat, które nie
stosują HTZ, nowotwór jajnika zostanie rozpoznany w okresie 5 lat u około 2 na 2000 kobiet.
U kobiet, które przyjmowały HTZ przez 5 lat, wystąpi u około 3 kobiet na 2000 stosujących (tj. około
1 dodatkowy przypadek).
Wpływ HTZ na serce i krążenie
Zakrzepy krwi w żyłach (żylna choroba zakrzepowo-zatorowa)
Ryzyko zakrzepów krwi w żyłachjest od 1,3- do 3-krotnie większe u kobiet stosujących HTZ
w porównaniu do niestosujących, zwłaszcza w pierwszym roku stosowania.
Zakrzepy krwi mogą stanowić zagrożenie i jeśli przemieszczą się do płuc, mogą powodować ból
w klatce piersiowej, duszność, omdlenie, a nawet śmierć.
Ryzyko zakrzepów krwi w żyłach jest większe, jeżeli pacjentka jest w starszym wieku oraz
w przypadku wystąpienia poniższych czynników. Należy poinformować lekarza, jeśli:
- pacjentka nie może chodzić przez dłuższy czas z powodu poważnych zabiegów chirurgicznych, urazu lub choroby (patrz także punkt 3. „Jeśli planowana jest operacja”),
- występuje otyłość (wskaźnik masy ciała - WMC > 30 kg/m ),
- występują zaburzenia zakrzepowo-zatorowe, które wymagają długotrwałego przyjmowania leków zapobiegających powstawaniu zakrzepów krwi,
- u kogokolwiek z bliskiej rodziny dochodziło w przeszłości do powstawania zakrzepów krwi w kończynach dolnych, płucach lub innych narządach,
- występuje toczeń rumieniowaty układowy,
- u pacjentki zdiagnozowano raka.
Jeśli wystąpią objawy zakrzepów krwi, patrz „W przypadku wystąpienia poniższych schorzeń podczas
stosowania HTZ należy przerwać stosowanie leku Activelle i natychmiast skontaktować się
z lekarzem”.
Porównanie
U kobiet w wieku od 50 do 59 lat niestosujących HTZ, średnio liczbę przypadków zakrzepów krwi
w żyłach w ciągu 5 lat szacuje się na 4 do 7 na 1000 kobiet.
Natomiast u kobiet w wieku od 50 do 59 lat stosujących estrogenowo-progestagenową HTZ, liczba
przypadków w ciągu 5 lat wyniesie od 9 do 12 na 1000 kobiet (tzn. 5 dodatkowych przypadków).
Choroba naczyń wieńcowych (zawał serca)
Nie ma dowodów ,że HTZ zapobiega zawałowi serca. U kobiet w wieku powyżej 60 lat stosujących
estrogenowo-progestagenową HTZ występuje nieznacznie większa skłonność do rozwoju choroby
wieńcowej niż u kobiet niestosujących HTZ.
Udar mózgu
Ryzyko udaru mózgu jest około 1,5-krotnie większe u kobiet stosujących HTZ w porównaniu
do kobiet jej niestosujących. Liczba dodatkowych przypadków udaru spowodowanych stosowaniem
HTZ będzie się zwiększać wraz z wiekiem.
Porównanie
U kobiet w wieku od 50 do 59 lat niestosujących HTZ, średnio liczbę przypadków wystąpienia udaru
w ciągu 5 lat szacuje się na 8 na 1000 kobiet.
Natomiast u kobiet w wieku od 50 do 59 lat stosujących HTZ, liczba przypadków w ciągu 5 lat
wyniesie 11 na 1000 kobiet (tzn. 3 dodatkowe przypadki).
Inne stany
HTZ nie zapobiega utracie pamięci. Istnieją pewne dowody zwiększonego ryzyka utraty pamięci
u kobiet, które rozpoczęły stosowanie HTZ w wieku powyżej 65 lat. Należy zasięgnąć porady lekarza.
Lek Activelle a inne leki
Niektóre leki mogą wpływać na skuteczność działania leku Activelle, co może prowadzić
do nieregularnych krwawień. Dotyczy to leków wymienionych poniżej:
- •leki przeciwpadaczkowe(takie jak: fenobarbital, fenytoina i karbamazepina),
- •leki przeciwgruźlicze(takie jak: ryfampicyna i ryfabutyna),
- •leki stosowane w zakażeniu wirusem HIV(takie jak: newirapina, efawirenz, rytonawir i nelfinawir),
- leki stosowane w zapaleniu wątroby typu C(takie jak telaprewir),
- leki roślinne i inne preparaty ziołowe zawierające dziurawiec zwyczajny( Hypericumperforatum).
HTZ może wpływać na działanie innych leków:
- lek przeciwpadaczkowy (lamotrygina), co może spowodować zwiększenie częstości napadów;
- leki stosowane w wirusowym zapaleniu wątroby typu C (HCV; np. schemat leczenia skojarzonego ombitaswir/parytaprewir/rytonawir z dazabuwirem albo bez dazabuwiru, jak również schemat glekaprewir/pibrentaswir) mogą powodować zwiększenie wyników badań krwi dotyczących czynności wątroby (zwiększenie aktywności enzymu wątrobowego AlAT) u kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające etynyloestradiol. Lek Activelle zawiera estradiol, nie etynyloestradiol. Nie wiadomo, czy podczas stosowania leku Activelle łącznie z tym schematem leczenia skojarzonego przeciwko HCV może wystąpić zwiększenie aktywności enzymu wątrobowego AlAT.
Inne leki mogą zwiększać działanie leku Activelle:
- leki zawierające ketokonazol(lek przeciwgrzybiczy).
Lek Activelle może mieć wpływ na równoczesne leczenie cyklosporyną.
Należy powiedzieć lekarzowi lub farmaceucieo wszystkich lekach przyjmowanych obecnie
lub ostatnio, a także o lekach, które pacjent planuje stosować, w tym o lekach wydawanych
bez recepty, lekach roślinnych lub innych naturalnych produktach. Lekarz udzieli pacjentce porady na
ten temat.
Badania laboratoryjne
W przypadku konieczności wykonania badania krwi, należy poinformować lekarza lub personel
laboratorium o stosowaniu leku Activelle, ponieważ może on wpływać na wyniki niektórych badań.
Stosowanie leku Activelle z jedzeniem i piciem
Tabletki mogą być przyjmowane zarówno z jedzeniem i piciem, jak i bez.
Ciąża i karmienie piersią
Ciąża:lek Activelle jest przeznaczony do stosowania wyłącznie u kobiet po menopauzie.
W przypadku stwierdzenia ciąży należy natychmiast przerwać stosowanie leku Activelle
i skontaktować się z lekarzem.
Karmienie piersią:nie należy przyjmować leku Activelle w okresie karmienia piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Nieznany jest wpływ leku Activelle na prowadzenie pojazdów lub obsługiwanie maszyn.
Ważne informacje o niektórych składnikach leku Activelle
Lek Activelle zawiera laktozę jednowodną. Jeśli stwierdzono u pacjentki nietolerancję niektórych
cukrów, pacjentka powinna skontaktować się z lekarzem przed zastosowaniem leku Activelle.
3. Jak stosować lek Activelle
Ten lek należy zawsze przyjmować zgodnie z zaleceniami lekarza. W razie wątpliwości należy
zwrócić się do lekarza lub farmaceuty.
Należy przyjmować jedną tabletkę na dobę codziennie, mniej więcej o tej samej porze.
Po wykorzystaniu wszystkich 28 tabletek z opakowania leczenie należy kontynuować, rozpoczynając
kolejne opakowanie leku bez stosowania przerwy.
Instrukcja stosowania opakowania kalendarzykowego znajduje się na końcu niniejszej ulotki, w części
zatytułowanej „INSTRUKCJA DLA UŻYTKOWNIKA”.
Stosowanie leku Activelle można rozpocząćw dowolnym dniu. Jeśli dotychczas pacjentka stosowała
produkt HTZ, który wywoływał krwawienie z odstawienia, leczenie należy rozpocząć od razu
po zakończeniu krwawienia.
Lekarz powinien przepisać pacjentce najmniejszą dawkę zapewniającą zmniejszenie objawów,
do stosowania przez możliwie najkrótszy czas. Jeśli pacjentka uważa, że dawka leku jest zbyt duża
lub za mała powinna skonsultować się z lekarzem.
Przyjęcie większej niż zalecana dawki leku Activelle
W razie przyjęcia większej niż zalecana dawki leku Activelle, należy zwrócić się do lekarza
lub farmaceuty .Przedawkowanie leku Activelle może spowodować nudności lub wymioty.
Pominięcie zastosowania leku Activelle
Jeżeli pacjentka zapomniała przyjąć tabletkę o zwykłej porze, powinna ją przyjąć w ciągu następnych
12 godzin. Jeśli upłynęło więcej niż 12 godzin, należy pominąć nieprzyjętą dawkę i kontynuować
przyjmowanie leku o zwykłej porze następnego dnia. Nie należy stosować podwójnej dawki w celu
uzupełnienia dawki pominiętej. U pacjentek z zachowaną macicą pominięcie dawki może zwiększyć
prawdopodobieństwo wystąpienia krwawienia lub plamienia.
Przerwanie stosowania leku Activelle
Chęć zaprzestania stosowania leku Activelle należy najpierw zgłosić lekarzowi, który wyjaśni skutki
przerwania leczenia i omówi inne możliwe formy terapii.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić
się do lekarza lub farmaceuty.
Jeśli planowana jest operacja
Jeśli u pacjentki planuje się wykonanie operacji, powinna ona powiedzieć chirurgowi, że przyjmuje
lek Activelle. Może być konieczne przerwanie stosowania leku Activelle na 4 do 6 tygodni przed
operacją, aby zmniejszyć ryzyko zakrzepu krwi (patrz punkt 2. „Zakrzepy krwi w żyłach (żylna
choroba zakrzepowo-zatorowa)”). Przed ponownym rozpoczęciem stosowania leku Activelle należy
skonsultować się z lekarzem.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
U kobiet stosujących HTZ występuje zwiększone ryzyko rozwoju następujących chorób,
w porównaniu do kobiet niestosujących HTZ:
- rak piersi;
- nadmierny rozrost lub rak błony śluzowej macicy (hiperplazja endometrium lub rak);
- rak jajnika;
- zakrzepy krwi w żyłach nóg lub płucach (żylna choroba zakrzepowo-zatorowa);
- choroba wieńcowa;
- udar mózgu;
- prawdopodobnie utrata pamięci, jeśli rozpoczęto stosowanie HTZ w wieku powyżej 65 lat.
W celu uzyskania dalszych informacji, patrz punkt 2. ”Informacje ważne przed zastosowaniem leku
Activelle”.
Nadwrażliwość (uczulenie) (niezbyt częste działanie niepożądane - dotyczy od 1 do 10 kobiet na 1000)
Chociaż nadwrażliwość (uczulenie) jest niezbyt częstym działaniem niepożądanym, może ono
wystąpić. Objawem nadwrażliwości (uczulenia) może być jeden lub więcej z następujących objawów:
pokrzywka, świąd, obrzęk, trudności w oddychaniu, niskie ciśnienie krwi (blada i chłodna skóra,
szybkie bicie serca), zawroty głowy, poty, które mogą być objawami reakcji anafilaktycznej i (lub)
wstrząsu anafilaktycznego. Jeśli pojawi się którykolwiek z wymienionych powyżej objawów, należy
zaprzestać przyjmowania leku Activelle i natychmiast wezwać pomoc medyczną.
Bardzo częste działania niepożądane (dotyczy więcej niż 1 na 10 kobiet)
- bolesność lub tkliwość piersi,
- krwawienia z dróg rodnych.
Częste działania niepożądane (dotyczy od 1 do 10 na 100 kobiet)
- ból głowy,
- zwiększenie masy ciała spowodowane zatrzymaniem płynów,
- zapalenie pochwy,
- pojawienie się lub nasilenie migreny,
- grzybicze zapalenie pochwy,
- pojawienie się lub nasilenie depresji,
- nudności,
- powiększenie piersi lub obrzmienie piersi (obrzęk piersi),
- ból pleców,
- mięśniaki macicy (nowotwory łagodne), nasilenie, wystąpienie lub nawrót,
- obrzęki rąk i nóg (obrzęk obwodowy),
- zwiększenie masy ciała.
Niezbyt częste działania niepożądane (dotyczy od 1 do 10 na 1000 kobiet)
- wzdęcia, ból brzucha, rozdęcie brzucha, uczucie dyskomfortu, wzdęcia z oddawaniem wiatrów,
- trądzik,
- utrata włosów (łysienie),
- nadmierne owłosienie (typu męskiego),
- świąd lub pokrzywka,
- zapalenie żył (zakrzepowe zapalenie żył powierzchownych),
- skurcze mięśni kończyn dolnych,
- nieskuteczność leku,
- reakcje uczuleniowe,
- nerwowość.
Rzadkie działania niepożądane (dotyczy od 1 do 10 na 10 000 kobiet)
- zakrzepy krwi w naczyniach krwionośnych nóg lub płuc (zakrzepica żył głębokich, zatorowość płucna).
Bardzo rzadkie działania niepożądane (dotyczy mniej niż 1 na 10 000 kobiet)
- rak błony śluzowej macicy (rak endometrium),
- nadmierny rozrost błony śluzowej macicy (hiperplazja endometrium),
- wysokie ciśnienie krwi lub nasilenie nadciśnienia tętniczego,
- choroba pęcherzyka żółciowego, pojawienie się lub nawrót kamieni żółciowych, nasilenie się dolegliwości,
- nadmierne wydzielanie łoju, pojawienie się wysypki na skórze,
- ostry lub nawracający obrzęk (obrzęk naczynioruchowy),
- bezsenność, zawroty głowy, niepokój,
- zmiany popędu płciowego,
- zaburzenia widzenia,
- zmniejszenie masy ciała,
- wymioty,
- zgaga (niestrawność),
- świąd pochwy i sromu,
- zawał mięśnia sercowego i udar,
- uogólnione reakcje uczuleniowe (reakcja anafilaktyczna, wstrząs anafilaktyczny).
Inne działania niepożądane złożonej HTZ
- choroby pęcherzyka żółciowego,
- różne zaburzenia skóry:
- przebarwienia skórne zwłaszcza w obrębie twarzy lub szyi, zwane „plamami ciążowymi” (ostuda),
- czerwonawe, tkliwe guzy (rumień guzowaty),
- wysypka, w tym rumieniowo-obrzękowe zmiany w kształcie pierścieni (rumień wielopostaciowy),
- czerwone lub fioletowe przebarwienia obejmujące skórę i (lub) błony śluzowe (plamica naczyniowa).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie, lub pielęgniarce. Działania
niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań
Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, faks: 22 49-21-309, strona internetowa:
https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Activelle
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i opakowaniu
zewnętrznym po „Termin ważności”. Termin ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać w temperaturze poniżej 25 °C w suchym miejscu.
Nie przechowywać w lodówce.
W celu ochrony przed światłem lek przechowywać w opakowaniu zewnętrznym.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, co zrobić z lekami, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Activelle
- Substancjami czynnymi leku są estradiol 1 mg (w postaci estradiolu półwodnego) i noretysteronu octan 0,5 mg.
- Pozostałe składniki to: laktoza jednowodna, skrobia kukurydziana, kopowidon, talk i magnezu stearynian.
- Składniki otoczki tabletki to: hypromeloza, triacetyna i talk.
Jak wygląda lek Activelle i co zawiera opakowanie
Tabletki powlekane są białe, okrągłe o średnicy 6 mm. Tabletki mają wytłoczone oznaczenie NOVO
288 po jednej stronie, a po drugiej logo Novo Nordisk (byk Apis).
Wielkości opakowań:
- 28 tabletek powlekanych w opakowaniu kalendarzykowym.
Podmiot odpowiedzialny i wytwórca
Novo Nordisk A/S
Novo Allé
2880 Bagsværd, Dania
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do miejscowego przedstawiciela podmiotu odpowiedzialnego:
Novo Nordisk Pharma Sp. z o.o.
Tel.: 22 444 49 00
Faks: 22 444 49 01
Data ostatniej aktualizacji ulotki:
Inne źródła informacji
Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych http://www.urpl.gov.pl .
INSTRUKCJA DLA UŻYTKOWNIKA
Jak stosować opakowanie kalendarzykowe
1. Ustawienie wskaźnika dnia
Przekręcić wewnętrzną tarczę tak, aby ustawić dzień tygodnia naprzeciw małej plastikowej klapki.

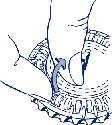
2. Jak wyjąć pierwszą tabletkę
Wyłamać plastikową klapkę i wyjąć pierwszą tabletkę.

3. Przesuwanie tarczy każdego dnia
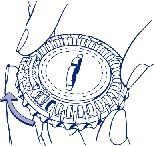
Następnego dnia, należy przekręcić przezroczystą tarczę zgodnie z kierunkiem ruchu wskazówek
zegara o jedno miejsce, jak wskazuje strzałka. Wyjąć następną tabletkę. Należy pamiętać,
by przyjmować tylko jedną tabletkę raz na dobę.
Przezroczysta część może być obrócona jedynie po wyjęciu tabletki znajdującej się w otworze.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterNovo Nordisk A/S
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki ActivellePostać farmaceutyczna: Tabletki, 1 mg + 2 mgSubstancja czynna: norethisterone and estrogenProducent: Bayer AGWymaga receptyPostać farmaceutyczna: Tabletki, 1 mg + 0,5 mgSubstancja czynna: norethisterone and estrogenWymaga receptyPostać farmaceutyczna: Tabletki, 1 mg + 5 mgSubstancja czynna: norethisterone and estrogenProducent: Abbott Biologicals B.V.Wymaga recepty
Odpowiedniki Activelle w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Activelle – Hiszpania
Lekarze online w sprawie Activelle
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Activelle – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.